海水中规模化培养西藏拟溞的技术优化研究
由志欣,赵文,魏杰,王珊,刘钢
(大连海洋大学辽宁省水生生物学重点实验室,辽宁大连116023)
西藏拟溞Daphniopsis tibetana在中国主要分布于新疆、青海、西藏等海拔较高、温度较低的地区,是一种罕见的冷水性盐水枝角类。赵文等[1]在西藏羌北无人区考察时采集了此溞。首次在海水中对其进行了一系列驯化试验,得到了西藏拟溞在实验室生长的重要生物学参数。目前,已有学者在西藏拟溞的生态分布、形态构造、生长发育、实验种群生态学、营养价值、遗传多样性、分子进化和大量培养等诸多方面进行了研究[2-7]。
西藏拟溞在中国西北地区多数高寒贫营养型半咸水湖的浮游生物中生物量相当可观,占有种群优势的地位,而且与海产桡足类相比其繁殖力高,若对其在海水中进行驯养后,可为北方海水养殖业提供一种优质新型活饵料,从而弥补喜暖性活生物饵料应用的缺憾,因此,对西藏拟溞最佳海水培养条件的摸索具有重要的意义。为此,本研究中在前期对西藏拟溞研究的基础上,选择最优化的培养条件,利用现有的大型可控温消毒循环水槽装置对其进行大量培养,研究了西藏拟溞规模化培养过程中起始放养密度、充纯氧和日采收率对该溞试验种群动态及生产量的影响,旨在为西藏拟溞海水中规模化培养提供科学的技术工艺参数。
1 材料与方法
1.1 材料
试验用西藏拟溞取自大连海洋大学水生生物学重点实验室,该溞是赵文等于2007年6月采自藏北纳木卡错碳酸盐型湖水并驯养于稀释海水中,由于海水对大气中CO2的吸收能力较强,与水形成碳酸,为驯养西藏拟溞提供了条件。
1.2 方法
1.2.1 西藏拟溞的培养及试验用水的配制 试验前将溞分离、提纯后,再将纯溞种逐级扩大培养成试验种群,繁殖几百个孤雌世代后进行接种规模培养。培养期间,水温保持 (16±0.5)℃,盐度为18~20,以浓缩饵料为食。
试验用海水取自大连市黑石礁海域 (pH为8.0~8.3,盐度为32~34),经沉淀及沙滤处理,用4层300目 (孔径为35 μm)尼龙筛绢网及一层脱脂棉过滤后,与自来水混合配制成盐度为18~20、pH 为7.15±0.05、溶解氧为 6~7 mg/L 的培养液。采用纯次氯酸钠溶液对配制好的海水消毒24 h,再用硫代硫酸钠中和至淀粉碘化钾试纸无色,水体连续循环12 h后待用。
1.2.2 饵料单胞藻的培养 采用光合微藻培养系统对蛋白核小球藻Chlorella pyrenoidosa、盐生杜氏藻Dunaliella salina、牟氏角毛藻Chaetoceros muelleri、湛江等鞭金藻Isochrysis zhanjiangensis高密度扩繁至指数期并进行浓缩,作为混合饵料进行投喂(浓缩混合饵料密度约为2×107cells/mL)。
1.2.3 试验设计 培养试验在9组容积为200 L的可控温消毒循环水槽中进行。充气装置采用空压机连续充气,气泡细密为宜,调节充气量使水体刚翻滚,保证表层和底层充分交换即可。增氧设备采用液氧,纯氧曝气头为进口纳米筛盘,供给氧气压力及气泡量不可过大,以免浪费氧气达不到充纯氧的预期效果。
试验期间,培养水体为150 L,在培养槽中先注入浓缩饵料,水体呈淡绿色为宜,引入种溞后,早晚各投喂一次浓缩饵料 (盐藻、金藻、角毛藻、小球藻按2∶1∶1∶1比例混合,饵料密度保持在2×107cells/mL),并根据溞密度适当增加饵料至预定投喂量,根据天气变化,及时调整设定温度,将温度控制在 (16±0.5)℃,盐度为18~20,自然光照,每天于8:00投喂后2 h时进行水体循环,于18:00停止水体循环后再进行投喂,每天循环10~12 h,水流速度为60 L/h,定期吸底。
试验分 3批进行:(1)在 200、550、900、1250 ind./L 4个放养量条件下,分别进行不同放养量对西藏拟溞种群密度及日产量的影响试验,每组设3个重复;(2)在起始放养密度为1250 ind./L时,分别进行充空气及充纯氧对西藏拟溞种群密度及日产量的影响试验,每组设3个重复;(3)在起始放养密度为1250 ind./L的条件下,分别进行日采收量为10%、20%、30%对西藏拟溞种群密度及日产量的影响试验,每组设3个重复。
1.2.4 计数方法 试验期间,每4 d计数一次,在早上未开始水体循环前进行,用PVC管缓慢搅动水体,待西藏拟溞均匀地分布于水层中时,用100 mL烧杯在水体上、中、下层取样,每组各取9个重复样,在显微镜下测量其体长并计数后,放回各水槽内继续培养。
1.2.5 平均湿质量及日产量的计算 西藏拟溞的生物量 (平均湿质量)按照其体长 (L)与体质量(W)的回归方程[8]进行计算:

其中:W为湿质量 (mg);L为体长 (mm)。
日产量(g·m-3·d-1)= [(Nt-N0)×W]/t。其中:Nt为最大种群密度 (ind./L);N0为起始放养量 (ind./L);W为西藏拟溞不同发育阶段的平均湿质量 (mg/ind.);t为西藏拟溞种群达到最大培养密度时所需要的时间 (d)。
经计算得到,西藏拟溞个体的湿质量为(0.083 3 ~ 1.0500)mg, 个 体 平 均 湿 质 量为 0.500 0 mg。
1.3 数据处理
试验数据以平均值±标准误表示,并采用Excel和SPSS 17.0软件进行方差分析和多重比较,显著性水平设为0.05。
2 结果与分析
2.1 不同放养密度下西藏拟溞的种群增长潜力
在起始放养密度分别为200、550、900、1250 ind./L的条件下,根据西藏拟溞种群密度结果拟合的曲线方程分别为
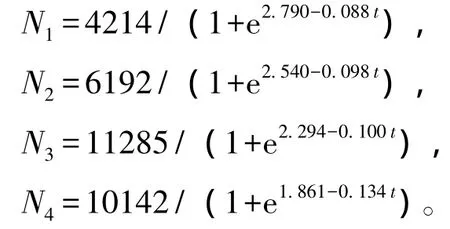
种群密度实测值与拟合种群的增长曲线如图1所示,对数据统计分析可知,不同放养密度下的西藏拟溞种群环境容纳量 K=4214~10142 ind./L,由Logistic方程得到种群瞬时增长率为0.088~0.134 d-1。
从表1可知,在本试验培养条件下,西藏拟溞的 日 产 量 为 (36.22 ± 2.57) ~ (125.00 ±8.35)g/(m3·d),当放养量为 200 ~ 900 ind./L时,随放养量的增加西藏拟溞的种群密度逐渐增加,均在第41天时达到最大;当放养量为1250 ind./L时,最大种群密度略有降低,但培养时间提前,仅为33 d,其日产量最大,为(125.00±8.35)g/(m3·d)。对各组试验数据进行方差分析结果表明,放养量为900 ind./L、1250 ind./L的两个试验组间最大种群密度无显著性差异 (P=0.41>0.05),日产量无显著性差异 (P=0.09>0.05),但两组的最大种群密度、日产量均显著高于其他组 (P<0.05)。
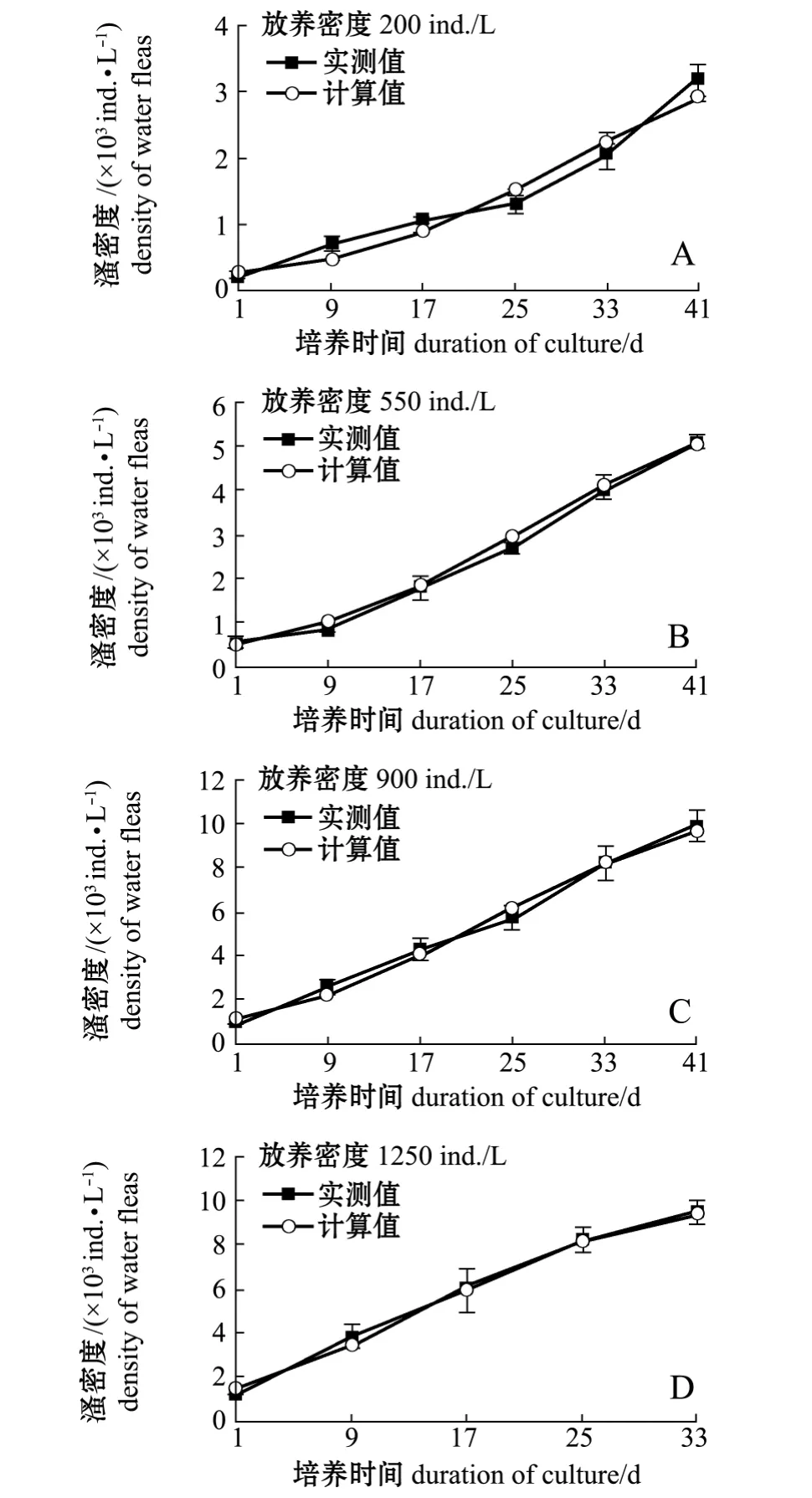
图1 起始放养密度对西藏拟溞种群密度生长的影响Fig.1 Effect of initial stocking density on the population density of water fleas Daphniopsis tibetana
2.2 不同充氧条件下西藏拟溞的种群增长潜力
在起始放养密度为1250 ind./L、充空气条件的对照组,根据西藏拟溞种群密度结果拟合的曲线方程为 N=10142/(1+e1.861-0.134t),种群密度的实测值与拟合的种群增长曲线如图2-A所示,经统计分析得出,对照组西藏拟溞的种群环境容纳量K为10 142 ind./L,由Logistic方程得到种群瞬时增长率为 0.134 d-1。
在起始放养密度为1250 ind./L、充纯氧条件的试验组,根据西藏拟溞种群密度结果拟合的曲线方程为 N=12507/(1+e2.167-0.135t),种群密度的实测值与拟合的种群增长曲线如图2-B所示,经分析可知,试验组西藏拟溞的种群环境容纳量 K为12 507 ind./L,由Logistic方程得到种群瞬时增长率为 0.135 d-1。
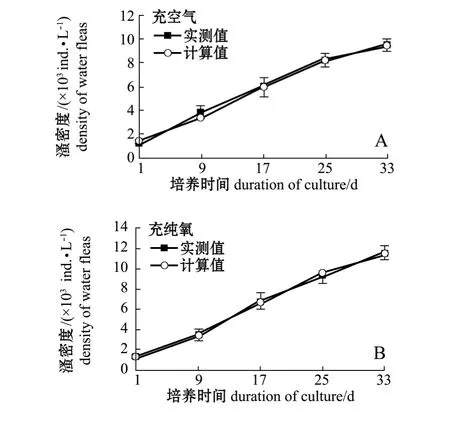
图2 不同充氧条件下放养量为1250 ind./L时西藏拟溞种群的增长曲线Fig.2 Population growth curve of water fleas Daphniopsis tibetana at initial stocking density of 1250 ind./L under air(A)and pure oxygen(B)areation
培养条件改进后,放养量为1250 ind./L时西藏拟溞的日产量见表2。由表2可知,在充纯氧条件下,西藏拟溞的最大种群密度为(11 600±560.45)ind./L,日产量可达到(156.82 ±8.49)g/(m3·d),结合表1分析表明,充纯氧条件下最大种群密度及日产量显著高于其他各处理组(P<0.05)。
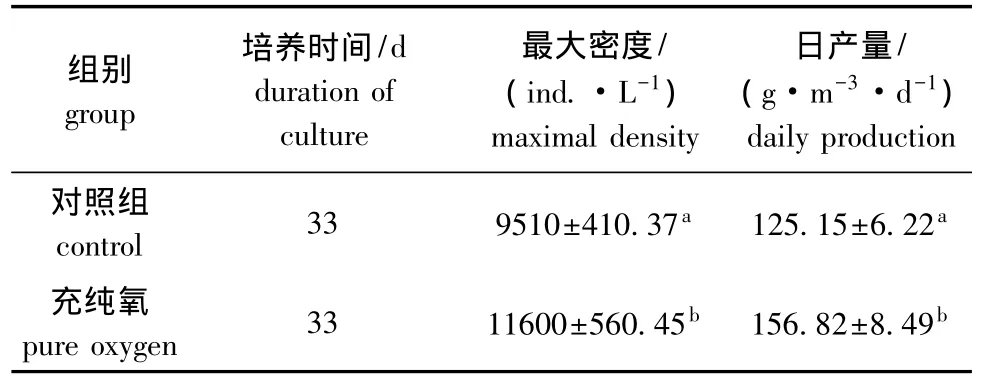
表2 不同充氧条件下放养量为1250 ind./L时西藏拟溞的日产量Tab.2 Daily production of water fleas Daphniopsis tibetana at initial stocking density of 1250 ind./L under air and pure oxygen aeration
2.3 不同日采收率时西藏拟溞的种群增长潜力
在放养密度为1250 ind./L、充纯氧条件下,采用不同的日采收率对西藏拟溞进行培养,测得西藏拟溞的种群密度如图3和表3所示。
从图3和表3可见,采用不同的日采收率,西藏拟溞种群密度变化趋势基本一致,均呈现一定的模式曲线。日采收率为20%时,培养的第33天时,西藏拟溞种群密度出现一次峰值,为(12 900±995.04)ind./L,西藏拟溞日产量最高达到(176.52 ±15.08)g/(m3·d),显著高于其他试验组 (P<0.05);日采收率为10%时,在第33天时西藏拟溞的密度峰值为(110 20±1173.84)ind./L,日产量下降为 (148.03 ±17.78)g/(m3·d);而在日采收率为30%时,在第41天时达最大种群密度,但较日采收率为10%及20%试验组的最大种群密度均低,为(8310±478.85)ind./L,日产量为(86.10±5.84)g/(m3·d)。方差分析表明,各试验组最大种群密度及日产量之间均存在显著性差异(P<0.05)。
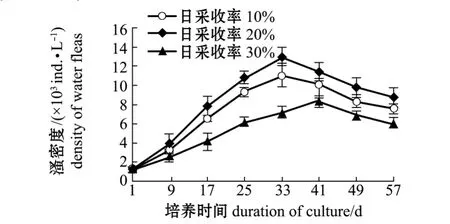
图3 放养量为1250 ind./L时不同日采收率对西藏拟溞种群培养效果的影响Fig.3 Effect of different daily harvesting ratios on water fleas Daphniopsis tibetana population density at initial density of 1250 ind./L
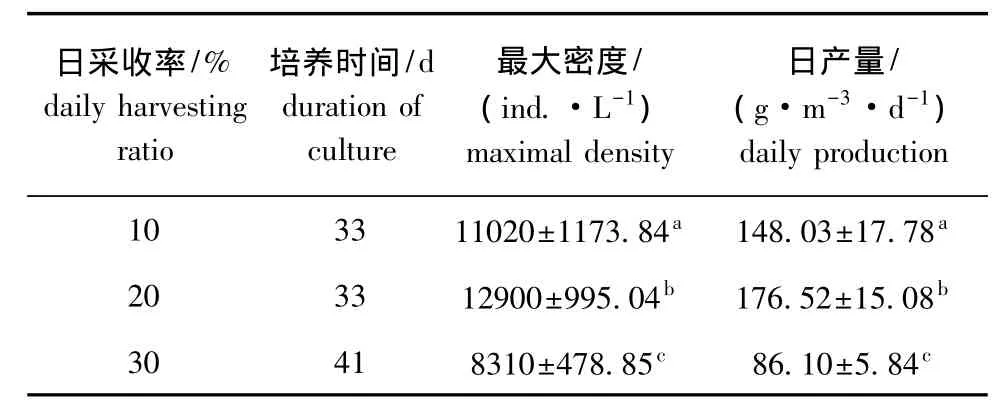
表3 不同日采收率下放养量为1250 ind./L时西藏拟溞的日产量Tab.3 Daily production of water fleas Daphniopsis tibetana at initial stocking density of 1250 ind./L under different daily harvesting ratios
3 讨论
3.1 放养密度对西藏拟溞种群生产量的影响
根据阿利氏规律 (Allee principle),适度群聚有利于种群的最适增长和存活,一定范围的群聚对生物有利,过密会产生拥挤效应对种群生长不利[9],因此,研究适宜放养密度和高密度培养技术工艺非常重要。本试验在放养密度分别为200、550、900、1250 ind./L条件下,大量培养西藏拟溞的最大种群密度分别可达到(3170±210.71)、(5070 ± 268.89)、 (9960 ± 757.17)、(9500 ±550.73)ind./L,日产量分别为 (36.22 ± 2.57)、(55.12 ± 3.28)、 (110.49 ± 9.23)、 (125.00 ±8.35)g/(m3·d),试验结果表明,一定的初始放养密度是西藏拟溞适应新环境并形成稳定种群所必须的,是一种自我调节以保证种群稳定并在适宜条件下通过孤雌生殖来扩大种群密度的重要因素。
在海水鱼虾蟹类育苗中,活生物饵料主要有轮虫、卤虫、桡足类、蒙古裸腹溞等,Fukusho[10]在静水中培养虎斑猛水蚤Tigriopus japonica时发现,其日产量仅为5 g/(m3·d),在优化管理和环境条件下,其日产量可达到10~15 g/(m3·d),但由于培养成本较高且日产量低,并未推广应用。李多慧[11]在对3种桡足类 (短角异剑水蚤、分叉小猛水蚤、大尾猛水蚤)大量培养时,得出其最大种群密度分别可达到3120、6130、6620 ind./L,其日产量仅为 2.17 ~3.62 g/(m3·d)。何志辉等[12]在静水中培养蒙古裸腹溞时发现,其日产量可达50 g/(m3·d),在改进试验条件,充气并吸底培养下,其日产量可达103.3 g/(m3·d),最大种群密度为10 520 ind./L。相比之下,霍元子等[13]在海水中大量培养西藏拟溞作为红鳍东方鲀鱼苗活饵料的试验研究显示,在放养密度为110 ind./L条件下,静水培养时,其种群密度为1570~2320 ind./L,日产量可达 23.0 ~35.2 g/(m3·d),该研究结果远高于虎斑猛水蚤,略低于蒙古裸腹溞。
在本试验现有的培养条件下,随着放养量的增加其种群密度并未持续增加,但是达到最大种群密度的时间提前,在放养密度为1250 ind./L时,种群瞬时增长率最高,达0.134 d-1,达最大种群密度的时间最短,为33 d,最大种群密度为 (9500±550.73)ind./L,日产量为(125.00 ±8.35)g/(m3·d),培养效果最好,本试验所得日产量相对其他学者的研究结果较高,一方面与试验采用大型可控温消毒循环水培养装置有关,获得了较理想的研究结果。另一方面,其日产量与平均湿体质量大小有关,西藏拟溞个体平均湿质量为 0.500 0 mg/ind.,蒙古裸腹溞为 0.106 0 mg/ind.,其他桡足类如短角异剑水蚤仅为0.034 mg/ind.。
3.2 充氧条件及日采收率对西藏拟溞种群增长潜力的影响
本试验在放养密度为1250 ind./L、充空气时,最大种群密度为(9510±410.37)ind./L,日产量为(125.15±6.22)g/(m3·d),改进试验条件采用充纯氧设备,最大种群密度可达(11 600±560.45)ind./L,环境容纳量 K值为12 507 ind./L,其日产量高达(156.82 ±8.49)g/(m3·d),但并未缩短西藏拟溞达最大种群密度的时间,仍为33 d,霍元子等[13]研究认为,如果对现有培养条件进行优化,如增加起始放养量、优化饵料配方和投喂量等均可缩短到达K值所需时间,从而更有效地提高西藏拟溞种群日产量。
影响西藏拟溞生长繁殖的因素很多,如温度、盐度、饵料、光照、pH、放养密度、溶氧和采收率等,在整个西藏拟溞的培养体系中,各因子间相互影响,其中,采收率大小是影响其高密度繁殖的重要因子之一,种群达到一定密度时若不及时采收可导致西藏拟溞种群生殖转化产生休眠卵,另外,在高密度条件下残饵及死溞分解后会败坏水质,两种因素均影响其大量生长繁殖,本试验中采用虹吸原理从不同日采收率结果看,日采收率为20%时,西藏拟溞的最大种群密度可达(12 900±995.04)ind./L,显著高于日采收率为10%和30%时 (P<0.05),在相同的培养时间下,其平均日产量高于充纯氧试验组,分析原因可能是适当量的更换培养液可以改善水质,促进西藏拟溞的繁殖,从而达到较高密度,而当日采收率为30%时,过大的换水量稀释了西藏拟溞的种群密度,其繁殖率跟不上培养液稀释耗损,不利于种群的增长。由此看出,并非日采收率越大对西藏拟溞种群增长越有利[14]。
3.3 西藏拟溞作为活生物饵料的应用前景
西藏拟溞具有适合北方海水鱼虾蟹类活生物饵料对象的培养条件,西藏拟溞生长的温幅为12~18℃,最适温度为16℃,盐幅为2~35,最适盐度为16~20,最适 pH为6~8,耗氧率仅为0.86~16 μg/(ind.·d)[5,15-17]。西藏拟溞富含较高营养价值,其不饱和脂肪酸 (UFA)的含量高达71.58%,已有的鱼类对氨基酸营养生理要求的研究表明,鱼类对蛋氨酸的需求量为1.8% ~4.0%,而西藏拟溞蛋氨酸含量可达3.64%,国内外大量研究表明,决定饵料生物营养价值的最主要因素是高不饱和脂肪酸 (HUFA),如 DHA、EPA的含量,而轮虫、卤虫、蒙古裸腹溞、西藏拟溞等生物饵料均缺乏DHA,由于这些生物饵料体内营养成分明显受处理方式及食物的影响,因此,可对西藏拟溞进行营养强化,再加上西藏拟溞所含其他必需氨基酸,使其有望成为北方寒冷季节海水养殖业优质蛋白源的活饵料[3,18-25]。
本试验根据霍元子等[13]在海水中大量培养西藏拟溞研究方法的基础上,进一步优化培养环境,结果得到较高的种群密度及日产量,但由于西藏拟溞的生命周期较长,在实际培养应用中,要想短时间内获得高产,首先要保证引种数量,在对培养技术优化完善的基础上,进一步提高日产量。本试验中得出最佳引种数量为1250 ind./L、日采收率为20%时种群密度最大,培育周期为33 d,在进行室外大规模养殖鱼虾蟹类时,应当尽早培养西藏拟溞种溞,对于北方鱼苗、虾苗养殖池可提前注水施肥,待苗种下塘时,西藏拟溞生物量达到峰值,即可被苗种直接利用,由于西藏拟溞个体较桡足类大,在消毒彻底,完全去除轮虫、原生动物等敌害生物条件下,可使其长期成为优势种群。今后应对西藏拟溞培养技术进行更深入地研究,使其更快地在海水育苗生产中得到应用。
[1]赵文,王巧晗,郑绵平,等.西藏拟溞生物学的初步研究[J].大连水产学院学报,2002,17(3):209-214.
[2]赵文,霍元子,高敬.西藏拟溞营养成分的分析与评价[J].中国水产科学,2006,13(3):446-451.
[3]赵文,王巧晗.西藏拟溞形态构造的再描述[J].大连水产学院学报,2005,20(3):165-173.
[4]蒋燮治,堵南山.中国动物志淡水枝角类[M].北京:科学出版社,1979:122-124.
[5]赵文,何志辉,殷守仁.盐水枝角类的生物学及海水培养利用[M].北京:科学出版社,2008.
[6]赵文,张鹏,霍元子,等.西藏拟溞的染色体核型研究[J].大连水产学院学报,2004,19(3):167-170.
[7]赵文,张琳,霍元子.温度、盐度和体长对西藏拟溞(Daphniopsis tibetana)耗氧率的影响[J].生态学报,2005,25(7):1149-1953.
[8]王巧晗.温度和盐度对西藏拟溞Daphniopsis tibetana存活、生长、发育和生殖的影响[D].大连:大连水产学院,2004:1-82.
[9]孙儒泳.动物生态学原理[M].北京:北京师范大学出版社,1988:294-295.
[10]Fukusho K.Review of the research status of zooplankton production in Japan[C]//Fulks W,Main M L.Rotifer and microalgae culture system,Honolulu:Proceedings of a U.S.-Asia workshop,1991:55-60.
[11]李多慧.三种桡足类实验种群动态及生产量的研究[D].大连:大连海洋大学,2010.
[12]何志辉,王岩,崔红,等.海水中大量培养蒙古裸腹溞的研究[J].水产学报,1998,22(增刊):17-23.
[13]霍元子,赵文,梁淼.海水中大量培养西藏拟溞及作为红鳍东方鲀鱼苗活饵料的研究[J].大连水产学院学报,2006,21(4):325-330.
[14]张登沥,周洪琪.饵料和日采收率对轮虫生长繁殖的影响[J].上海水产大学学报,2003,12(1):1-5.
[15]赵文,霍元子,薛东宁.碱度和pH对西藏拟溞存活、生长和生殖的影响[J].水生生物学报,2007,31(3):332-338.
[16]Korpelainen H.The effects of temperature and photoperiod on life history parameters of Daphniopsis tibetana[J].Freshwater Biology,1986,16:615-620.
[17]赵文,毕进红,韩婷婷,等.西藏拟溞遗传多样性的初步研究[J].大连海洋大学学报,2011,26(2):187-189.
[18]卢敏德,姚健敏,张纪顺,等.几种东方鲀营养成分的分析[J].水生生物学报,2011,26(2):108-113.
[19]Nanton D A,Castell J D.The effects of dietary fatty acids on the fatty acid composition of the harpacticoid copepod,Tisbe sp.,for use as a live food for marine fish larvae[J].Aquaculture,1998,163(3/4):251-261.
[20]刘镜格.海水仔稚鱼早期阶段氨基酸的营养生理研究进展[J].海洋水产研究,2003,24(1):75-79.
[21]荻野珍吉.鱼类的营养和饲料[M].北京:海洋出版社,1987:158-224.
[22]Reitan J I,Rainuzzo J R,Ynguar O.Effect of nutrient limitation on fatty acid and lipid content of marine microalgae[J].J Phycol,1994,30(6):972-979.
[23]童圣英,林成辉,王雪涛,等.蒙古裸腹溞营养成分分析与评价[J].大连水产学院学报,1988,12(3/4):29-33.
[24]何志辉,姜宏,姜志强,等.蒙古裸腹溞作为海水鱼苗活饵料的试验[J].大连水产学院学报,1997,21(4):415-421.
[25]童圣英,姜宏,陈炜.不同喂养条件下蒙古裸腹溞脂肪酸组成比较[J].中国水产科学,1998,5(3):58-62.

