施氏鲟胚胎发育阶段可溶性蛋白、性激素含量和免疫相关指标的变化
席庆凯,张颖,刘晓勇,潘鹏,孙大江
(1.上海海洋大学水产与生命学院,上海201306;2.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨150070;3.中国水产科学研究院,北京100141)
施氏鲟Acipenser schrenckii隶属于鲟形目Acipenseriformes、鲟科 Acipenseridae、鲟属 Acipenser,在黑龙江、乌苏里江和松花江等地均有分布[1],目前已成为中国主要的鲟鱼养殖种类[2-3]。近年来,中国鲟鱼苗种孵化率降低,品质衰退日益成为苗种培育的制约因素。由于养殖环境的恶化、品质衰退等原因,施氏鲟胚胎发育阶段死亡率较高,造成的损失较大。众多研究表明:可溶性蛋白、性激素水平、非特异性免疫机制对维持幼鱼正常发育,提高成活率和苗种质量等均具有重要的作用[4-10]。关于施氏鲟胚胎发育过程中可溶性蛋白、性激素水平和免疫相关指标的研究目前尚未见报道。本研究中,采用生物化学方法对施氏鲟胚胎发育过程中可溶性蛋白浓度、性激素水平和抗氧化酶活性等相关免疫指标进行了研究,旨在探讨施氏鲟胚胎发育与可溶性蛋白、性激素和抗氧化酶等免疫相关指标之间的关系,为提高其孵化率及苗种质量提供基础数据,进而为中国鲟鱼养殖产业的发展提供基础资料。
1 材料与方法
1.1 材料
施氏鲟各发育时期的胚胎取自中国水产科学研究院鲟鱼繁育技术工程中心,为全人工繁殖受精卵,在孵化车间内常规孵化,孵化水温为16~17℃,溶氧>6.0 mg/L。孵化期内用解剖镜观察胚胎的形态变化,每2 h观察一次,在卵裂期、卵黄栓期、神经胚期、视泡期、心搏期、孵出前期、孵出期等7个发育时期取样 (取3对亲本的受精卵,每对亲本10 g左右)。用滤纸吸干其水分后,放入5 mL的采样管中,于液氮罐中保存备用。
1.2 方法
1.2.1 样品的制备 取不同发育时期的施氏鲟胚胎样品,设3个平行,分别称重 (约1.5 g,精确到0.01 g),分别加入3倍体积的PBS缓冲液,冰浴匀浆5 min,4℃下以3000 r/min离心10 min,取上清液分装,于超低温冰箱 (-80℃)中保存,用于可溶性蛋白浓度、免疫酶活性等相关指标的测定。
1.2.2 可溶性蛋白浓度的测定 采用南京建成生物工程研究所的考马斯亮蓝试剂盒测定施氏鲟胚胎的可溶性蛋白浓度。
1.2.3 性激素的测定 采用甲醇提取法[11]提取胚胎17β-雌二醇 (E2)和雄激素睾酮 (T),使用BECKMAN ACESSⅡ放免仪及BECKMAN ACESSⅡE2和T试剂盒进行测定。
1.2.4 酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、过氧化氢酶 (CAT)、超氧化物歧化酶(SOD)酶活性和还原型谷胱甘肽 (GSH)、过氧化反应产物丙二醛 (MDA)含量的测定 采用南京建成生物工程研究所的试剂盒,参照各种酶活检测试剂盒的操作进行酶活性测定。
1.3 数据分析
试验数据以平均值±标准差 (mean±S.D.)表示。采用 SPSS 18.0软件进行单因素方差分析(ANOVA),采用Duncan法进行多重比较分析,显著性水平设为0.05。
2 结果与分析
2.1 不同发育时期施氏鲟胚胎的可溶性蛋白浓度
施氏鲟胚胎发育过程中,可溶性蛋白浓度的变化规律见图1。从图1可见:整个胚胎发育过程中,不同发育时期的可溶性蛋白浓度变化较大;视泡期和孵出前期胚胎的可溶性蛋白浓度较高,在视泡期达到最高值,为5.20 mg/mL,均显著高于其他发育时期 (P<0.05);卵黄栓期和心搏期胚胎的可溶性蛋白浓度较低,且显著低于其他发育时期(P<0.05),卵黄栓期达到最低值,为 2.62 mg/mL;孵出期蛋白浓度比孵出前期略有降低(P>0.05),为 4.10 mg/mL。
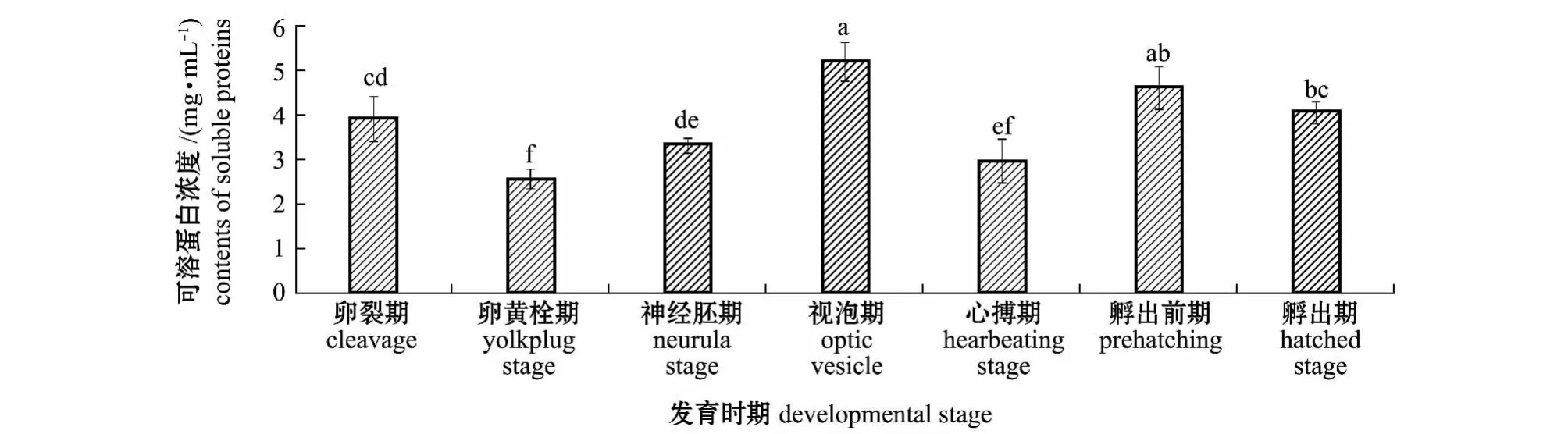
图1 不同发育时期施氏鲟胚胎可溶性蛋白浓度的变化Fig.1 Contents of soluble proteins during embryonic development of Amur sturgeon Acipenser schrenckii
2.2 不同发育时期施氏鲟胚胎的非特异性免疫指标
从表1可见:胚胎发育各时期,ACP活性均高于AKP活性;卵黄栓期ACP活性 (34.66 U/g)较卵裂期 (47.75 U/g)显著降低 (P<0.05),孵出前期、孵出期ACP活性又显著升高 (P<0.05);与ACP相比,AKP活性变化较小,由卵裂期到心搏期,AKP活性逐渐降低,孵出前期较心搏期又显著升高 (P<0.05)。总体来说,ACP活性均随胚胎的发育先降低后上升,且孵出期仔鱼的ACP活性显著高于卵裂期 (P<0.05),而孵出期仔鱼的AKP活性则显著低于卵裂期 (P<0.05)。
从表1可见:胚胎发育过程中,CAT和SOD活性的变化规律有所不同,CAT活性除在孵出前期略有降低外,总体呈逐渐升高的趋势,由卵裂期的1.46 U/mg逐渐升高至孵出期的 2.57 U/mg;SOD活性则由卵裂期的最高值 (3.19 U/mg)显著降低为心搏期的最低值 (1.74 U/mg)(P<0.05),随后在孵出前期略升高,至孵出期SOD活性为2.12 U/mg。
从表1还可见:GSH含量在胚胎发育阶段呈先缓慢降低后急剧升高的趋势,心搏期GSH含量最低,为1.47 μmol/g,孵出期GSH含量最高,为3.52 μmol/g;MDA含量在胚胎发育阶段的变化趋势为先升高后降低又升高,神经胚期含量最高,为0.17 nmol/mg,心搏期含量最低,为0.07 nmol/mg,孵出前期至孵出期又显著增加 (P<0.05),孵出期 MDA 含量达 0.16 nmol/mg。

表1 不同发育时期施氏鲟胚胎ACP、AKP、CAT、SOD活性及GSH、MDA含量的变化Tab.1 Changes in ACP,AKP,CAT,and SOD activitise and GSH and MDA contents during embryonic development of Amur sturgeon Acipenser schrenckii
2.3 不同发育时期施氏鲟胚胎的性激素水平
从图2可见:整个胚胎发育期间,施氏鲟胚胎的T含量呈降低趋势,而在孵出前期又显著升高形成峰值 (260 pg/g)后迅速降低 (P<0.05),至孵出期降低至120 pg/g;与 T含量变化不同,17β-E2含量随胚胎的发育在心搏期逐渐降低至44.38 pg/g,但均无显著性变化 (P>0.05),但至孵出前期17β-E2含量又显著升高 (P<0.05),达最高峰值498.52 pg/g,之后又显著降低至孵出期的 58.42 pg/g(P<0.05)。

图2 不同发育时期施氏鲟胚胎雌二醇、睾酮含量的变化Fig.2 Changes in 17β-E2and T levels during embryonic development of Amur sturgeon Acipenser schrenckii
3 讨论
3.1 胚胎发育过程中可溶性蛋白浓度的变化
胚胎发育期是鱼类个体发育的重要阶段,此阶段胚胎的形态结构和功能均存在显著变化[12-13]。可溶性蛋白作为鱼类胚胎发育的重要物质基础,可以作为酶、调控蛋白、信号蛋白和运输蛋白等参与个体组织构建、机体新陈代谢等活动[8-10,14-16]。
本研究中,施氏鲟胚胎期的可溶性蛋白浓度在视泡期、孵出前期和孵出期较高。施氏鲟胚胎期可溶性蛋白浓度呈先升高后降低再升高的趋势,这与河川沙塘鳢[14]和长蛸[8]胚胎期可溶性蛋白浓度呈先升高后降低的变化趋势不同,差异体现在施氏鲟胚胎从卵黄栓期到视泡期可溶性蛋白浓度有一上升的过程。本研究中通过观察发现,卵黄栓期到视泡期历时16 h,主要为神经板等神经系统的发育,外观总体变化不大,推测可溶性蛋白消耗低于卵黄蛋白分解为可溶性蛋白的速度,因此,可溶性蛋白总量呈上升趋势。而视泡期到心搏期历时47 h,期间形成大量的器官原基,如眼原基、咽弧原基、脑室、心脏原基、尾芽、嗅板、听泡等结构[17],并在后期出现肌肉效应,这些变化均需要消耗大量的可溶性蛋白来提供物质基础和能量[8,14],因此,这一阶段可溶性蛋白浓度有较大幅度下降。由于心搏期开始出现心跳,血液循环系统初步形成,使蛋白的分解转运效率显著提高并远大于消耗速度,所以形成心搏期至孵出期可溶性蛋白浓度的升高。
3.2 胚胎发育过程中免疫相关酶的变化
胚胎发育过程中,活跃的细胞代谢活动会产生大量的活性氧,可引起细胞内氧化代谢产物的增加,产生细胞毒性,导致胚胎发育阻滞或延迟[4-5]。鱼类的抗氧化酶系和非酶抗氧化小分子对维持胚胎期发育过程中产生的过氧化产物水平具有重要的作用[5-6,18]。
ACP、AKP是两种重要的机体功能调节酶,大量研究表明,其活力指标与细胞免疫、体液免疫活动密切相关,反映了机体的防御能力[19]。本研究中,自卵黄栓期之后ACP活性逐渐升高,心搏期后增加尤为明显,在孵出期显著升高,这与贻贝早期发育过程中的ACP活力随胚胎的发育逐渐升高[20-21]的状况一致,说明ACP在破膜时要发挥重要作用。这种趋势的形成,推测原因可能是与心搏期后胚胎血液循环系统开始形成,自体产生ACP有关。有研究表明,溶酶体酶主要来源于血淋巴和血细胞,血细胞吞噬过程中会释放出 ACP。与ACP相比,AKP活性较低且有所下降,也与对贻贝的研究结果一致。这可能与施氏鲟发育早期时肝脏与骨骼系统不完善、骨化作用较弱有关。ACP与AKP活性的差异,说明施氏鲟在胚胎发育时期ACP要比AKP发挥更重要的作用。
生物体在长期的进化过程中形成了一套完整的抗氧化系统来清除体内多余的活性氧,抗氧化系统包括非酶类抗氧化剂和酶类抗氧化剂,CAT、SOD均属于酶类抗氧化剂,有研究表明,这两种酶的活性与鱼体细胞免疫防御能力密切相关。通过对幼鱼期施氏鲟抗氧化能力的研究表明,SOD、CAT能有效地对抗机体的氧化损伤[13]。本研究中,SOD活性在施氏鲟胚胎发育阶段显著降低,这与对金鱼胚胎的研究结果一致[6],推测原因可能是胚胎时期自身合成SOD能力较弱,母源性SOD随着氧化损伤的加重而逐渐消耗所致。与SOD不同,CAT活性变化呈明显升高的趋势,这说明在胚胎发育过程中受到过氧化氢损伤,胚胎产生CAT分解过氧化氢,缓解其造成的损伤。Rudneva[22]研究发现,CAT活性增强与其应对活性氧对机体造成的损伤有关。
GSH属于抗氧化系统中的非酶类抗氧化分子,具有抗氧化和解毒功能,通过参与氧化还原反应,清除自由基[23]。本研究中,GSH含量在心搏期前下降,心搏期后显著升高,推测可能是发育初期受精卵合成GSH的能力较弱,而母源性GSH逐渐消耗,心搏期后血液循环系统形成,自身具备合成GSH能力所致。还有一种可能即观察发现,胚胎在神经胚期与心搏期死亡率较高,而心搏期之后死亡率变低,这说明胚胎在心搏期前受到的损伤较大,部分胚胎处于胁迫状态,故GSH消耗较大。
过氧化反应产物MDA的含量可反映机体过氧化的程度,间接地反映出组织细胞受自由基损伤的严重程度[24]。本研究中发现,神经胚期MDA含量有一峰值,这与神经胚期胚胎死亡率较高的现象相一致,印证了胚胎在神经胚期受过氧化损伤较严重的猜测。心搏期后MDA含量又显著升高,与丰程程等[25]及 Díaz等[13]的研究结果一致。说明随着发育时间的延长,胚胎所受的氧化损伤逐渐加重。这也解释了生产中施氏鲟胚胎孵化时间越长死亡率越高的现象。
综合分析,ACP、AKP、SOD活性和GSH含量在施氏鲟胚胎发育初期均有所降低,表明机体受到了一定的氧化损伤,间接说明了胚胎发育初期体内存在母源性的免疫相关酶。胚胎发育中ACP、CAT活性和GSH含量都有升高的趋势,说明胚胎在免疫等各组织器官发育完全之前就能够通过自身合成而具备一定的免疫能力。MDA含量在胚胎发育后期明显增加,说明胚胎自身的抗氧化能力依然不足以抵消过氧化损伤,因此,在生产实践中要细心管理,努力降低外界环境的应激,以提高施氏鲟出苗率。
3.3 胚胎发育过程中性激素水平的变化
研究表明,鱼类排卵前卵母细胞的双层滤泡膜产生性类固醇激素,以供其在胚胎发育过程中进行生理代谢[26]以及胚后发育。根据学者对虹鳟[27-28]、罗非鱼[12]、银鲑[29]、中华鲟[30]和斑马鱼[31]等胚胎期性激素变化水平的研究结果,性激素在鱼类胚胎发育过程中具有重要的生物学功能。本研究中,施氏鲟胚胎期T含量在孵出期较卵裂期显著降低,与中华鲟、虹鳟、罗非鱼等硬骨鱼类胚胎期性类固醇激素的变化规律基本相同。施氏鲟胚胎期T和17β-E2含量在心搏期前呈逐渐下降趋势,这与罗非鱼[12]、虹鳟[27-28]鱼卵刚受精后的性类固醇激素含量很高、发育期间逐渐降低一致。原因是母源性类固醇激素在发育过程中不断代谢,使这些激素水平下降。
与以往研究不同的是,在本研究中孵出前期17β-E2和T含量均出现浓度高峰,而虹鳟、罗非鱼是在仔鱼出膜后才逐渐上升,施氏鲟提前了至少一个时期,这与母源性激素在胚胎期逐渐消耗的猜测不符,与中华鲟17β-E2水平在一定范围内波动[30]也不同。施氏鲟17β-E2和T含量高峰出现的原因尚无类似先例可以参照,可能的原因是在胚胎发育后期胚胎自身已经可以合成类固醇激素。吴湘香等[30]对中华鲟早期类固醇激素的研究中提到类固醇合成的时期有争议,一般认为,类固醇激素的合成要在鱼类性别分化完成后[26],但也有学者认为,性腺分化过程存在性类固醇激素的诱导作用[32]。施氏鲟与中华鲟都为性腺分化时间较晚的晚成熟鱼类,有研究表明,施氏鲟组织学性腺分化起始于6月龄[3],因此,本研究中孵出前期17β-E2和T水平升高的原因归结为自身合成性类固醇激素,这表明施氏鲟在性别分化之前即可自身合成性类固醇激素。孵出前期为个体由胚胎期向仔鱼期转化的重要阶段,而性类固醇激素在多种生理功能、多种器官发育中具有的重要调控功能[25]也印证了孵出前期17β-E2和T高水平的结果。
综上所述,施氏鲟在胚胎发育时期可溶性蛋白浓度在心搏期到孵出前期这一阶段存在一个上升的趋势,且在心搏期均处于较低水平,这与ACP活性和GSH、17β-E2、T含量的变化规律一致,表明此时期这几项指标存在某种必然的联系,也间接证明了孵出前期这一阶段的重要性。ACP、CAT活性和GSH含量在整个发育过程中增加,表明其是胚胎发育阶段的主要免疫因子,发挥的作用大于AKP、SOD、MDA含量的变化,与胚胎在各时期的死亡率存在一定关系。胚胎发育是鱼类生长发育最脆弱的阶段,如何满足其蛋白需求,提高胚胎的免疫能力,维持适宜的性激素水平,是提高施氏鲟苗种孵化率及苗种品质的关键问题。因此,进一步研究胚胎时期的营养需求与免疫能力的关系,减少环境引起的应激因素,均有助于施氏鲟苗种的培育,从而促进其养殖产业的健康发展。
[1]孙大江,曲秋芝,王丙乾,等.施氏鲟不同年龄性腺发育与性类固醇激素浓度关系[J].中国水产科学,2004,11(4):307-312.
[2]孙大江,曲秋芝,张颖,等.中国的鲟鱼养殖[J].水产学杂志,2011,24(4):68-70.
[3]张颖,孙慧武,刘晓勇,等.施氏鲟的性腺分化及养殖水温对其性腺分化的影响[J].中国水产科学,2012,19(6):1008-1017.
[4]庄利利,胡德宝,蔡丽娟,等.哺乳动物胚胎的活性氧来源及其抗氧化机制[J].中国畜牧兽医,2013,40(3):173-176.
[5]杨维维,刘文斌,沈美芳,等.海带粉对克氏原螯虾生长、非特异性免疫和肝胰脏抗氧化能力的影响[J].大连海洋大学学报,2014,29(1):40-44.
[6]孔祥会,王书平,江红霞,等.金鱼胚胎发育过程中免疫相关酶活性及丙二醛含量的变化[J].中国水产科学,2011,18(6):1293-1298.
[7]Ciulei I.Phyothemical and pharmacological research on anthocyanin for obtaining new natural drugs[J].An R Acad Farm,1990,56(4):531-537.
[8]詹萍萍,王春琳,张晓梅,等.长蛸胚胎发育过程中可溶性蛋白含量及组成变化[J].海洋学研究,2010,28(4):65-69.
[9]王晓燕,常亚青,丁君,等.降温对刺参免疫酶、可溶性蛋白及可溶性糖影响的初步研究[J].农学学报,2012,2(4):44-49.
[10]孔祥会,张红绪,王桂忠,等.锯缘青蟹可溶性蛋白与可溶性糖的季节变化[J].河南师范大学学报,2008,36(1):99-102.
[11]宫玮.鸭胚蛋中激素检测方法的研究[D].泰安:山东农业大学,2007.
[12]Hines G A,Boots L R,Wibbels T,et al.Steroid levels and steroid metabolism in relation to early gonadal development in the tilapia Oreochromis niloticus(Teleostei Cyprinoidei)[J].Gen Comp Endocrino,1999,114(2):235-248.
[13]Díaz M E,Furné M,Trenzado C E,et al.Antioxidant defences in the first life phases of the sturgeon Acipenser naccarii[J].Aquaculture,2010,307(1/2):123-129.
[14]胡先成,罗颖,赵云龙,等.河川沙塘鳢胚胎发育过程中可溶性蛋白组成及含量的变化[J].淡水渔业,2008,38(1):20-22.
[15]姚俊杰,胡先成,赵云龙,等.罗氏沼虾胚胎发育过程中蛋白质含量及氨基酸的组成[J].上海师范大学学报:自然科学版,2004(S):26-32
[16]何登菊,姚俊杰,赵云龙,等.瓯江彩鲤胚胎发育过程中脂蛋白及碳水化合物水平的变化[J].动物学杂志,2011,46(2):102-107.
[17]刘洪柏,宋苏祥,孙大江,等.施氏鲟胚胎及胚后发育研究[J].中国水产科学,2000,7(3):5-10.
[18]黄勇,缪彪.超氧化物歧化酶在斑马鱼早期胚胎中的表达特点[J].陕西理工学院学报,2008,24(3):90-94.
[19]孙红梅,黄权,丛波.饥饿对黄颡鱼血液中几种免疫相关因子的影响[J].大连水产学院学报,2006,21(4):307-310.
[20]孙虎山,王宜艳,梁建光,等.贻贝(Mytilus edulis)发育早期酸性和碱性磷酸酶活性[J].海洋与湖沼,2008,39(1):42-48.
[21]Sarosiek B,Wysocka J,Wysocki P,et al.Characteristics of acid phosphatase from Russian sturgeon(Acipenser gueldenstaedtii)spermatozoa[J].J Appl Ichthyol,2006,22(S1):375-379.
[22]Rudneva I I.Antioxidant system of Black Sea animals in early development[J].Comp Biochem Physiol,1999,122(2):265-271.
[23]柳海星.GSH和过氧化氢对小鼠早期胚胎体外发育的影响[J].延边大学农学学报,2010,32(4):281-284.
[24]鲁疆,王占洋,袁玉婷,等.氯化镉对斑马鱼胚胎的发育毒性[J].生态毒理学报,2013,8(3):381-383.
[25]丰程程,张颖,张永泉,等.哲罗鱼胚胎至仔稚幼鱼期主要免疫指标和抗氧化酶的活性变化[J].淡水渔业,2013,43(6):35-38
[26]林浩然.鱼类生理学[M].广州:广东高等教育出版社,1999:190-196.
[27]Yeoh C G,Schreck C B,Fitzpatrick M S,et al.In vivo steroid metabolism in embryonic and newly hatched steelhead trout(Oncorhynchus mykiss)[J].Gen Comp Endocrino,1996,102(2):197-209.
[28]Feist G,Schreck C B.Brain-pituitary-gonadal axis during early development and sexual differentiation in the rainbow trout,Oncorhynchus mykiss[J].Gen Comp Endocrinol,1996,102(3):394-409.
[29]Feist G,Schreck C B,Fitzpatrick M S,et al.Sex steroid profiles of coho salmon(Oncorhynchus kisutch)during early development and sexual differentiation[J].Gen Comp Endocrinol,1990,80(2):299-313.
[30]吴湘香,陈细华,刘鉴毅,等.中华鲟早期发育中17β-雌二醇和睾酮水平变化的初步观察[J].淡水渔业,2007,37(2):3-7.
[31]Hao R X,Mail M B,Singh A V,et al.Identification of estrogen target genes during zebrafish embryonic development through transcriptomic analysis[J].PLoS One,2013,8(11):1-18.
[32]Nakamura M,Bhandari R K,Higa M.The role estrogens play in sex differentiation and sex changes of fish[J].Fish Physiology and Biochemistry,2003,28(1):113-117.

