EPSPS基因的克隆及油用亚麻表达载体的构建
张瑜,党占海,张建平,李闻娟,宋军生,陈芳,张琼
(1.甘肃农业大学农学院,甘肃 兰州 730070;2.甘肃省农业科学院,甘肃 兰州 7300070)
EPSPS基因的克隆及油用亚麻表达载体的构建
张瑜1,党占海2,张建平2,李闻娟2,宋军生1,陈芳1,张琼1
(1.甘肃农业大学农学院,甘肃 兰州730070;2.甘肃省农业科学院,甘肃 兰州7300070)
摘要:以抗草甘膦油菜基因组DNA为模板,PCR扩增抗草甘膦油菜的5-烯醇式丙酮酸莽草酸-3-磷酸合成酶(EPSPS)基因,构建植物表达载体pBI121-EPSPS,并导入农杆菌进行检测.结果表明:扩增获得EPSPS基因全长1 377 bp,共编码459个氨基酸.测序结果表明,其与美国Monsanto公司获得的专利(US5633435)中已知的CDS序列完全一致,表明成功构建了EPSPS植物表达载体,并将其导入农杆菌菌株LBA4404中.
关键词:油用亚麻;抗草甘膦;EPSPS基因;表达载体
Cloning ofEPSPSgene and construction oil flax
油用亚麻(Linumusitatissimum)俗称胡麻,是我国西北及华北地区主要的油料作物和重要的大田经济作物[1-2].杂草危害是影响油用亚麻获取高产优质的主要因素之一,化学除草是其主要的除草手段[3-4].草甘膦是一种内吸传导式广谱灭生性除草剂,具有高效、低毒、无残留等特点,是目前应用最为广泛的除草剂品种之一[5],但因其所具有的非选择性,应用中在消除杂草的同时也使农作物受害,大大地限制了草甘膦的应用范围[6].因此,利用基因工程原理培育抗草甘膦油用亚麻品种成为最经济、方便和安全的途径,并且抗草甘膦基因还可作为其它基因的选择标记基因,利于筛选其他基因[7].
1983年Monsanto公司与美国华盛顿大学的科学家首次分离出高度耐草甘膦的土壤细菌Agrobacteriumtumefaciens菌系CP4,其EPSPS(5-烯醇式丙酮莽草酸-3-磷酸合成酶)与植物体内的EPSPS比较,对草甘膦的抑制作用不敏感[8].Jordan等[9]利用农杆菌首次获得转基因亚麻.在国内,王玉富等[10]以亚麻幼苗的下胚轴为外植体,利用抗除草剂Basta的目的基因和Gus-INF基因,初步建立起了根癌农杆菌介导法的亚麻转基因系统.王毓美等[11]报道了亚麻遗传体系的建立和初步推断几丁质酶基因已经进入亚麻基因组中.康庆华等[12]利用农杆菌介导法进行亚麻‘黑亚11号’和‘黑亚9号’转抗除草剂Basta基因试验研究获得了转化的愈伤组织.李博等[13]利用薤白的EPSP基因对亚麻进行转化并检测到EPSP基因已整合到了亚麻基因组中.EPSPS基因作用机理比较清晰,本文拟利用特定的引物从抗草甘膦油菜中克隆EPSPS基因,并用于非抗除草剂作物油用亚麻的遗传转化,以期为油用亚麻抗草甘膦性状的遗传改良奠定基础.
1材料与方法
1.1试验材料
植物材料:抗草甘膦转基因油菜由美国Monsanto公司培育;非转基因油菜‘陇油7号’由甘肃省农业科学院作物所油菜课题组馈赠.
载体和菌株:pUCM-T质粒购自上海生工生物工程有限公司,pBI121表达质粒大肠杆菌DH5α,根癌农杆菌LBA4404均由甘肃省农业科学院作物所实验室保存.
PCR引物:利用 Primer Premier 5.0软件设计引物序列,引物均由上海生工生物有限公司合成.
主要试剂:限制性内切酶BamHⅠ和SmaⅠ,T4DNA连接酶,X-gal,IPTG,抗生素,DNA凝胶回收试剂盒.其它试剂均为分析纯.
1.2试验方法
1.2.1抗草甘膦转基因油菜基因组DNA的获得选取生长正常、生长状态一致的转基因油菜植株和非转基因油菜植株‘陇油7号’,采用浓度为500 mg/L的草甘膦对其上部叶片中部2 cm长的部位,正反面进行涂沫,连续涂沫3 d,1个星期后观察.利用CTAB法提取具有抗草甘膦的转基因油菜基因组DNA,通过紫外分光光度仪进行DNA纯度与浓度检测,琼脂糖凝胶电泳进行基因组DNA分子质量检测.
1.2.2EPSPS基因的扩增根据抗草甘膦(EPSPS)基因序列(美国Monsanto公司获得的专利:US5633435),应用Primer Premier 5.0软件分析.设计1对引物,并根据后续构建植物表达载体的需要,在上游引物一端加入1个BamHⅠ位点,在下游引物一端加入了SamⅠ位点,设计PCR引物如下:上游引物EPSPS1:5′-CCBamH ⅠATGGCTCACG G TGCAAGCAGC-3′,下游引物EPSPS2:5′-GCGCCCSam ⅠGGGGAGCTCATCATCAAGC-3′.以油菜基因组DNA为模板进行PCR扩增,PCR反应体系总体积为25.0 μL,包括10×buffer 2.5 μL,Mg2+2.5 μL,10 mmol/L dNTP 2.0 μL,2.0 μL(约500 ng),加ddH20至25.0 μL.PCR反应程序为:94 ℃预变性3 min、94 ℃变性45 s、56 ℃退火50 s、72 ℃延伸45 s,32个循环后72 ℃延伸3 min.PCR产物经1%琼脂糖凝胶电泳检测,并回收纯化.
1.2.3EPSPS基因的克隆与鉴定用T4DNA连接酶,将回收纯化的EPSPS基因片段与pUCm-T载体连接起来,采用热激法转入大肠杆菌DH5α感受态细胞中,用含有40 μg/mL X-gal、24 μg/mL IPTG、100 μg/mL Amp的LB固体培养基筛选克隆.
挑取白色阳性单菌落在含有100 μg/mL Amp的LB液体培养基中37 ℃,200 r/min培养10~12 h.对菌液PCR验证后呈阳性的菌液抽提质粒(小量碱裂解法),双酶切,电泳检测.将PCR鉴定和经抽提质粒双酶切(BamHⅠ和SmaⅠ)的阳性克隆质粒命名为T-EPSPS,并将其菌液送至上海生工生物有限公司测序.
DNA切胶回收,质粒的提取、酶切,电泳,大肠杆菌和农杆菌感受态制备、转化均参照第3版分子克隆实验指南[14].连接反应参照T4连接酶说明书.
1.2.4植物表达载体pBI121-EPSPS的构建提取测序正确的T-EPSPS载体质粒,用BamHⅠ和SmaⅠ双酶切质粒T-EPSPS,回收EPSPS的小片段,同样用BamHⅠ和SmaⅠ双酶切质粒pBI121,回收其大片段.用T4DNA连接酶将目的基因与载体以体积比约为2∶1的比例进行接连,再用热激法转入大肠杆菌DH5α.在含有50 μg/mL Kan LB培养基平板上筛选转化菌落.提取质粒用BamHⅠ和SmaⅠ双酶切鉴定,将重组质粒命名为pBI121-EPSPS.
1.2.5重组表达载体导入农杆菌用冻融法将重组表达载体pBI121-EPSES导入农杆菌感受态(LBA4404)细胞中,取100 mL菌液涂布于含50 μg/mL Kan和100 μg/mL利福平的YEB平板中28 ℃培养36 h左右,即可长出阳性克隆.挑取生长良好的单菌落在含有50 μg/mL Kan、100 μg/mL利福平的YEB液体培养基中28 ℃, 200 r/min培养过夜.菌液PCR验证,并用25%无菌甘油保存PCR阳性克隆菌液,贮存在-70 ℃.
2结果与分析
2.1抗草甘膦转基因油菜基因组DNA的获得
采用草甘膦对抗草甘膦转基因油菜及非转基油菜进行涂叶筛选,7 d后转基因油菜有65.53%正常生长,约三分之二的转基因油菜表现出草甘膦抗性性状,其余的则没有表现出草甘膦抗性并且随后枯萎死亡.这表明,在转基因油菜中草甘膦抗性性状可以世代相传,符合孟德尔遗传和施荣华等[15]的研究结果.非转基因油菜全部枯萎,最终死亡.选取抗性生长良好的转基因油菜的叶片采用CTAB法提取基因组DNA.
经紫外分光光度仪检测所提取DNAD260/D280= 1.95,达到PCR扩增对模板的纯度和浓度的要求.经1%琼脂糖凝胶电泳检测DNA(图1).
2.2EPSPS基因的扩增
以抗草甘膦转基因油菜基因组DNA为模版,用TaqDNA聚合酶PCR扩增EPSPS基因片段.将PCR产物进行凝胶电泳分析后,其扩增的目的片段约为1 377 bp(图2),与预期结果相符.
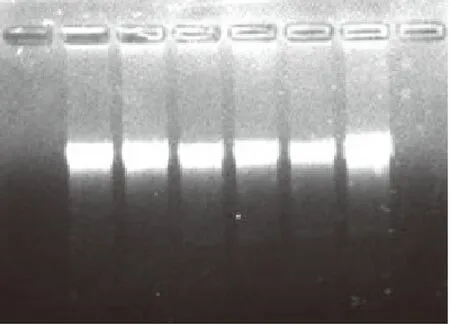
图1 抗草甘膦转基因油菜总DNA
2.3EPSPS基因TA克隆与鉴定
将回收后的EPSPS片段与pUCM-T相连接并转化大肠杆菌DH5α,经PCR检测均为阳性克隆(图3).提取质粒,经双酶切(BamHⅠ和SmaⅠ)后,得到约2 773 bp和1 377 bp的目的片段(图4).选取已验证菌液送至上海生工生物工程有限公司测序.测序结果表明,扩增结果与已获得专利的核苷酸序列完全一致,表明基因克隆正确.经完全双酶切(BamHⅠ和SmaⅠ)获得的目的基因片段,可用于植物表达载体的构建和转基因.
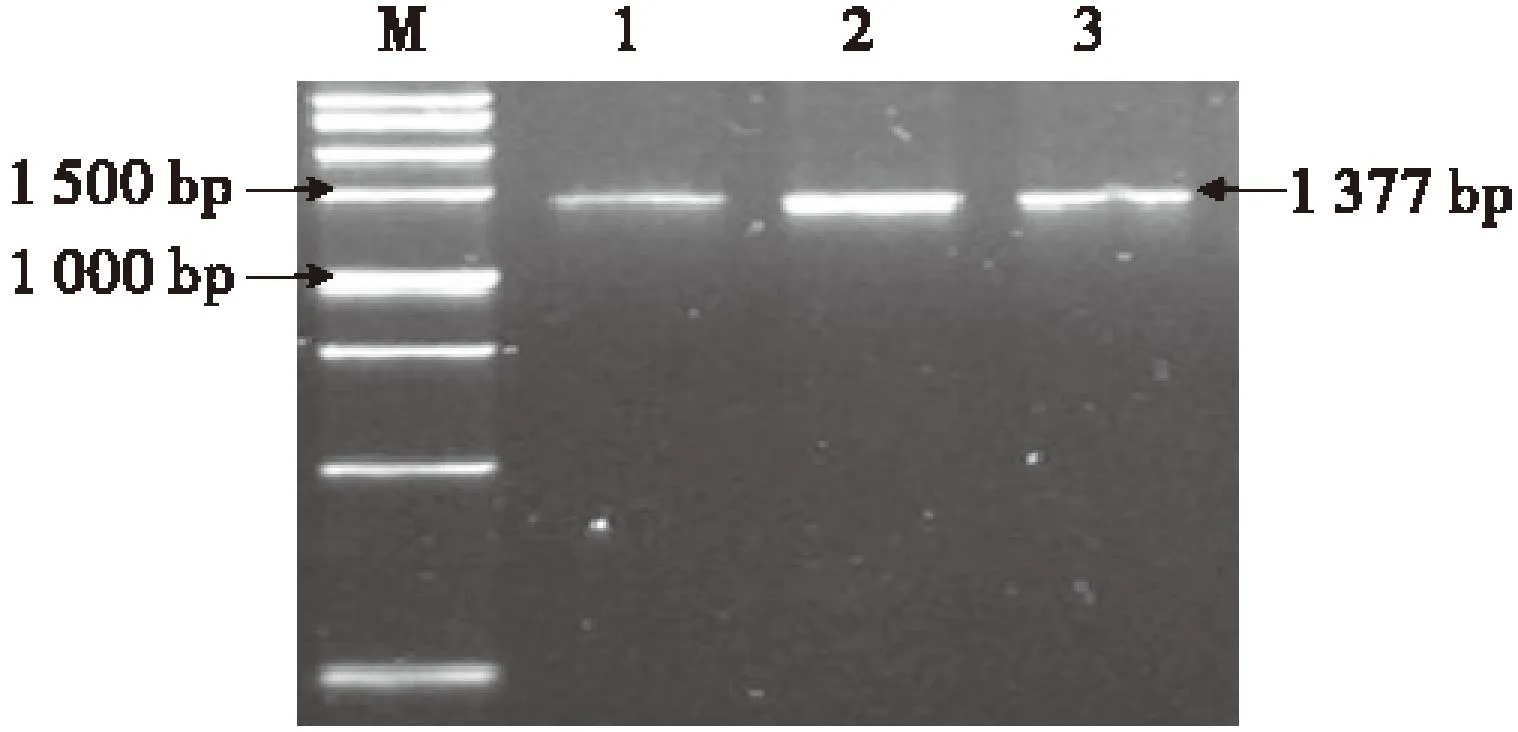
M:DNA Marker;1~3:PCR产物.
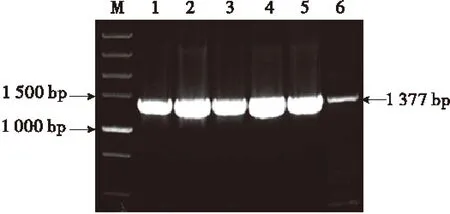
M:DNA Marker;1~6:PCR产物.
2.4植物表达载体pBI121-EPSPS的构建
将从T-EPSPS载体上切下的EPSPS目的基因片段和在植物表达载体上切下的大片段连接,并转入大肠杆菌DH5α中.菌液PCR验证,得到约为1 377 bp的片段(图5).并用BamHⅠ和SmaⅠ双酶切鉴定,得到约为14 571 bp和1 377 bp大小的片段(图6).从菌液PCR和酶切鉴定结果可知,说明该目的片段已成功插入pBI121中,即获得重组质粒pBI121-EPSPS,表达载体构建成功.

M:DNA Marker;1:T-EPSPS质粒双酶切(BamHⅠ和SmaⅠ)产物;2:T-EPSPS载体质粒.
图4T-EPSPS克隆载体质粒双酶切鉴定
Fig.4Results of T-EPSPS cloning vector plasmid by
restriction enzyme ideatification
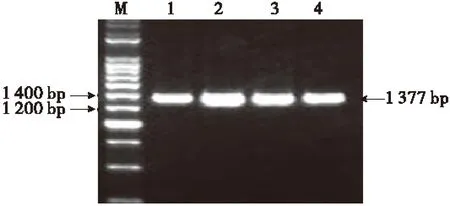
M:DNA Marker;1~4:PCR产物.
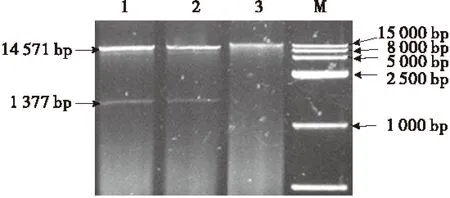
M:DNA Marker;1~2:pBI121-EPSPS质粒双酶切(BamHⅠ和SmaⅠ)产物;3:pBI121-EPSPS质粒.
图6pBI121-EPSPS载体质粒双酶切鉴定
Fig.6pBI121-EPSPS vector plasmid by restriction
eczyme identification
2.5重组表达载体导入农杆菌
将植物表达载体pBI121-EPSPS转化农杆菌LBA4404,挑选克隆,菌液PCR扩增,电泳结果表明获得1 377 bp的预期片段(图7),证明EPSPS基因存在,表明pBI121-EPSPS已成功导入根癌农杆菌中.
3讨论与结论
草甘膦(glyphosate)是目前使用最广泛的非选择性有机膦类除草剂,能有效抑制76种恶性杂草,它的作用机理是特异性地抑制植物和细菌中莽草酸羟基乙烯转移酶(EPSPS)的活性[16-17],当除草剂草甘膦与该酶结合时,阻断丁芳香族氨基酸的合成,造成芳香族氨基酸缺乏,从而导致植株死亡[18].其抗性基因EPSPS基因,植物细胞通过EPSPS的超常表达对一定剂量的草甘膦产生抗性,或者是植物细胞通过EPSPS的作用活性位点变化对草甘膦产生抗性[19-20].1984年CP4EPSPS基因插入植物基因组获得了表达,其后抗草甘膦作物迅速发展并商品化.目前国际上除抗草甘膦的大豆、玉米、油菜、棉花和苜蓿已商业化外,抗草甘膦的转基因小麦、甜菜和匍匐剪股颖(Creepingbentgrass,牧草)也已获得[8],而我国抗草甘膦转基因作物的研发相对滞后,赵福永等、王景雪等曾将aroAM12基因和Bt基因转入棉花和油菜,分别获得抗草甘膦和抗虫的转基因棉花和油菜[7].王玉富等[10]利用抗除草剂Basta的目的基因,初步建立起了根癌农杆菌介导法的亚麻转基因系统.康庆华等[12]利用农杆菌介导法进行纤用亚麻转抗除草剂Basta基因试验研究获得了转化的愈伤组织,以上研究都集中在将抗草丁膦Basta基因转化纤用亚麻方面,而有关抗草甘膦转基因在油用亚麻上的报道至今未见.鉴于以上研究结果,本文就针对油用亚麻构建了具有抗草甘膦的表达载体.
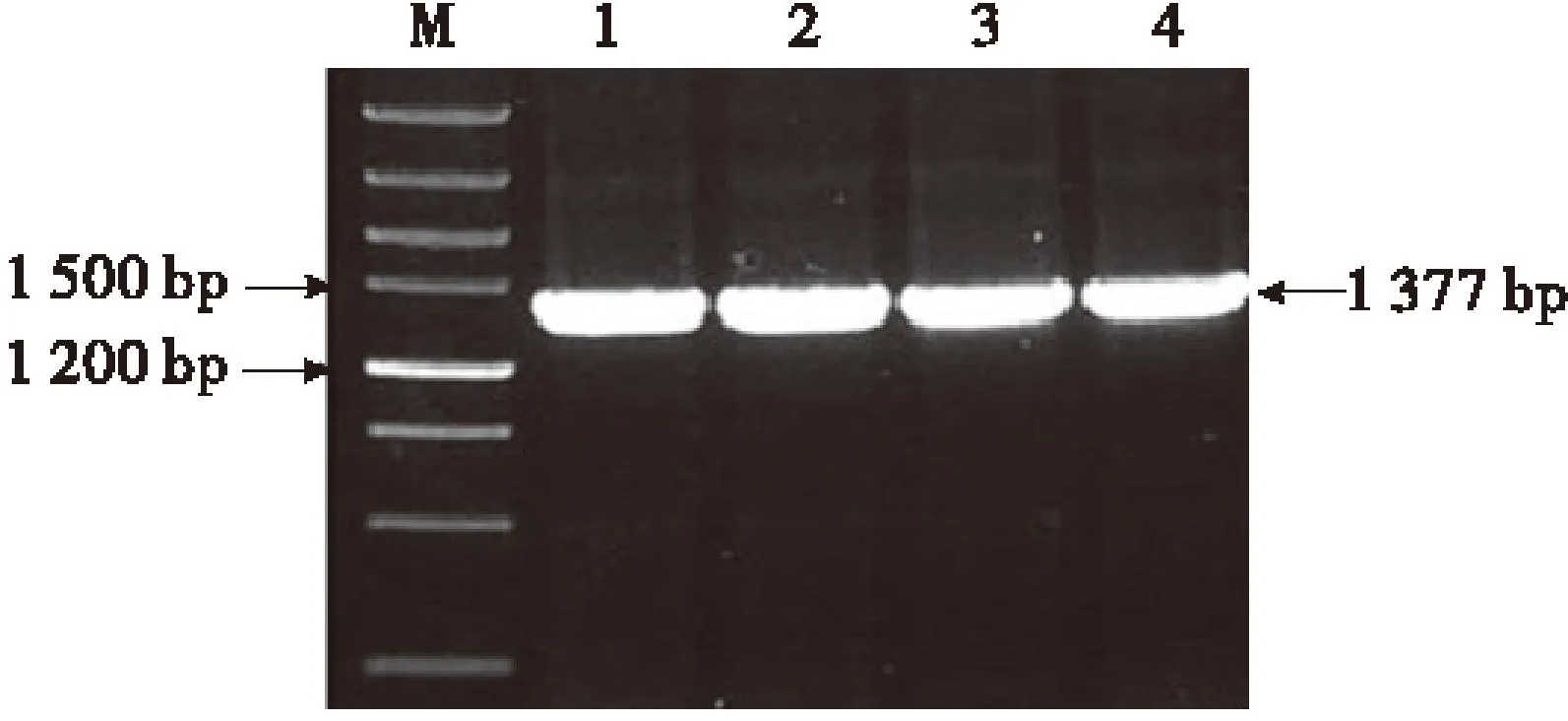
M:DNA Marker;1-4:农杆菌PCR产物.
本研究将EPSPS基因从抗草甘膦油菜基因组DNA中克隆出来,经测序,其与美国Monsanto公司获得的专利(US5633435)中已知的CDS序列完全一致.利用基因重组技术成功构建了由CaMV35S启动子调控的植物表达载体pBI121-EPSPS,CaMV35S启动子是广泛应用的组成型启动子,它在植物中表达效率很高[21],pBI121是近来用得较多的一种优良的植物表达载体,其所带的报告基因GUS含内含子,使得GUS能在真核细胞中起显色反应,起到筛选目的基因的作用[22].EPSPS基因不仅可以用于提高胡麻(油用亚麻)和其他单子叶植物抗除草剂,也可以作为筛选标记基因来验证该遗传转化体系,克服了抗生素筛选的局限性,为今后草甘膦筛选转基因亚麻提供了有效参考,并且有助于研究植物抗性的分子机制.本试验所构建了EPSPS植物表达载体,将其导入根癌农杆菌,为下一步转化油用亚麻和研究该基因的功能作准备.对油用亚麻优良品种进行遗传转化,为培育出适宜西北半干旱地区种植的高产、优质、抗除草剂亚麻新品种的做基础工作.
参考文献
[1]赵利,党占海,张建平,等.甘肃胡麻地方品种种质资源品质分析[J].中国油料作物学报,2006,28(3):282-286
[2]杨崇庆,党占海,张建平,等.油用亚麻杂交种产量及形状优势研究[J].甘肃农业大学学报,2009,44(4):73-76
[3]王玉富,康庆华,李希臣,等.亚麻抗除草剂转基因的分子检测[J].中国麻业科学,2008,30(1):13-16
[4]孟桂元,柏连阳,邬腊梅,等.不同除草剂对亚麻生长及杂草防治效果的影响[J].中国农学通报,2011,27(9):391-394
[5]陈梁鸿,王新望,张文俊,等.抗除草剂草甘膦EPSPS基因在小麦重的转化[J].遗传学报,1999,26(3):239-243
[6]王宏伟,梁业红,史振声,等.作物抗草甘膦转基因研究概况[J].作物杂志,2007,4:9-12
[7]王景雪,赵福永,徐培林,等.油菜转抗草甘膦、抗虫基因获得双抗植株[J].遗传学报,2005,32(12):1293-1300
[8]苏少泉.转基因抗草甘膦作物的新进展[J].现代农药,2009,8(6):1-4
[9]Jordan M C,Mc Hughen A.Glyphosate tolerant flax plants fromAgrobacteriummediatedgene transfer [J].Plant Cell Repoets,1988,7:281-284
[10]王玉富,周思君,刘燕,等.利用农杆菌介导法进行亚麻转基因培养基的研究[J].中国麻作,2000,22(1):14-16
[11]王毓美,李武兴,陈曦,等.几丁质酶基因转化亚麻、红豆草、骆驼刺的同工酶研究[J].西北植物报,2001,21(1):26-31
[12]康庆华.亚麻转基因试验中抗菌素效果的研究[J].中国麻业,2005,27(2):94-97
[13]李博,黄丽华,蒋向,等.薤白EPSP基因对亚麻的转化及检测[J].湖南农业大学学报:自然科学版,2011,36(1):12-16
[14]萨姆布鲁克 J,拉塞尔 D W.分子克降实验指南[M].3版.北京:科学出版社,2002
[15]施荣华,李学宝.外源基因在转基因油菜后代中的表达及遗传学分析[J].2000,34(2):208-212
[16]Carlisle S M,Trevors J.Glyphosate in the environment[J].Water Air and Soil Pollution,1988,39(3):409-420
[17]Alibhai M F,Stallings W C.Closing down on glyphosate inhibition with a new structure for drug discovery[J].Proceedings of the National Academy of Sciences of the United States of America,2001,98(6):2944-2946
[18]马向东,黄春华,周俊初.基因体外诱变[J].微生物学通报,2002,29(1):70-72
[19]Ganesh M,Kishore G M,Shah D M.Amino acid biosynthesis inhibitors as herbicides[J].Biochem,1988,57:627-663
[20]Zhou H,Arrowsmith J W.Glyphosate-tolerant CP4 andGOXgenes as selectable marker in wheat transfornation[J].Plant Cell Reports,1955,15:159-163
[21]Hauptman R M,Ozias A P,Vasil V,et al.Transient expression of electroporated DNA in monucotyledonous and dicotyledonous species[J].Plant Cell Rep,1987,6(4):6264-6272
[22]姬妍茹,赵军,刘伟伟.应用直接分化再生系统进行亚麻转基因技术的研究[J].生物技术通报,2008(1):128-132
(责任编辑李辛)
expression vector
ZHANG Yu1,DANG Zhan-hai2,ZHANG Jian-ping2,LI Wen-juan2,SONG Jun-sheng1,
CHEN Fang1,ZHANG Qiong1
(1.College of Agronomy,Gansu Agricultural University,Lanzhou 730070,China;2.Gansu Academy of
Agricultural Sciences,Lanzhou 730070,China)
Abstract:EPSPS gene was amplified from transgenic herbicide glyphosate resistant oil flax.The sequence was constructed into plant express vector pBI121-EPSPS,which was transferred into Agrobacterium tumefaciens.The results indicated that the full-length of the amplified EPSPS gene was 1 377 bp,which encoded 459 amino acids.The sequencing results showed the identical CDS sequence as the known one in Monsanto’s patent (US5633435).The plant expression vector of EPSPS was constructed successfully and transferred into A.tumefaciens LBA4404.
Key words:oil flax;EPSPS gene;glyphosate resistance;expression vector
收稿日期:2014-03-02;修回日期:2014-03-28
基金项目:国家胡麻产业技术体系项目(CARS-17-GW-02);国家自然科学基金项目(31260355).
通信作者:党占海,男,研究员,主要从事油用亚麻遗传育种研究.E-mail:dangzhh1955@yahoo.com.cn
中图分类号:Q 78
文献标志码:A
文章编号:1003-4315(2015)01-0053-05
第一作者:张瑜(1988-),男,硕士研究生,专业方向为作物遗传育种.E-mail:xiangjg@126.com

