L-脯氨酸在大孔强酸阳离子交换树脂上的吸附性能研究
曹稳根,徐程遥,董 增,王 志
宿州学院生物与食品工程学院药物生物技术研究所,安徽宿州,234000
L-脯氨酸在大孔强酸阳离子交换树脂上的吸附性能研究
曹稳根,徐程遥,董 增,王 志
宿州学院生物与食品工程学院药物生物技术研究所,安徽宿州,234000
研究了L-脯氨酸在D001大孔强酸性阳离子交换树脂的吸附性能,为其工业化生产提供科学实验依据。以吸附率和解吸率为考察指标,研究了不同实验条件对L-脯氨酸静态吸附和动态吸附与解吸附的影响。结果表明,D001大孔强酸性阳离子交换树脂对L-脯氨酸具有较好的吸附性能。静态吸附最佳条件:L-Pro溶液在浓度50 mg/mL、体积100 mL、pH6、25 ℃的条件下,静态吸附平衡时间为50 min,吸附率为83.12%,无机盐的存在导致吸附率迅速下降;动态吸附与解吸附的最佳条件为:L-Pro在上样液浓度50 mg/mL、体积50 mL、流速3 mL/min、pH6、25 ℃的条件下,吸附率为72.51%;氨水洗脱浓度1.5 mol/L、体积25 mL、流速3 mL/min时,解吸率为89.10%。
L-脯氨酸;大孔强酸性阳离子交换树脂;吸附;解吸附
L-脯氨酸(L-Proline,简称L-Pro)是含有亚氨基的中性氨基酸,广泛应用于医药和食品工业,还可作为农作物的增产剂和化学反应的催化剂[1-2]。目前工业上从蛋白质水解液或发酵液中提取分离L-Pro主要采用离子交换树脂法[3-5]。大孔强酸阳离子交换树脂是一类具有三维网状和物理大孔结构的功能聚合物[6],在L-精氨酸吸附分离研究中已有报道[7]。本文通过静态吸附和动态吸附与解吸附实验,研究了L-Pro在D001型大孔强酸阳离子交换树脂上吸附性能,旨在为大孔强酸阳离子交换树脂在L-Pro吸附分离上的应用提供科学依据,为L-Pro工业化生产过程的进一步优化创造条件。
1 材料与方法
1.1 材料和主要试剂
D001型大孔强酸性阳离子交换树脂(上海谷研试剂有限公司);酸性茚三酮溶液(称取1.25 g茚三酮溶于30 mL冰乙酸和20 mL 2 mol/L磷酸溶液中,70℃下加热搅拌溶解,冷却后置棕色试剂瓶中,4℃保存备用[8]);L-Pro标准品(纯度99%,美国sigma公司);其他试剂为分析纯,实验用水为纯水。
1.2 主要仪器
U3310型紫外分光光度计(日立Hitachi公司)、HZQ-X300 恒温振荡器(上海恒科技有限公司)、PHS-3CT型精密酸度pH计(上海精贤科技有限公司)。
1.3 离子交换剂的预处理
先将D001型大孔强酸性树脂用足量乙醇浸泡,振荡24 h后纯水洗至无醇味;接着用2 mol/L HCl浸泡24 h后,纯水反复漂洗至中性;再用2 mol/L NaOH浸泡24 h后,纯水反复漂洗到中性。最后再用2 mol/L HCl浸泡24 h后,用纯水反复漂洗至中性,抽滤烘干后备用[9]。
1.4 标准曲线的绘制
精密量取1、2、3、4、5、6 mL浓度为100 mg/L的L-Pro溶液分别置于10 mL的容量瓶中,纯水定容后即得到浓度依次为10、20、30、40、50、60 mg/L的L-Pro标准溶液。接着分别移取上述不同浓度的L-Pro标准溶液2 mL于6支比色管中,依次加入2 mL酸性茚三酮溶液和2 mL冰醋酸,摇匀后沸水浴加热40 min,冷却后纯水定容至10 mL[8]。以纯水为参比,于波长515 nm测定吸光度值,以L-Pro溶液浓度C(mg/L)为横坐标,吸光度值A为纵坐标,得标准曲线回归方程为:y=0.0769x+0.0619,r=0.999 7。结果表明,L-Pro溶液浓度在2~12 mg/L范围内与其吸光度值有良好的线性关系。
1.5 静态吸附实验
准确称取一定量的处理过的大孔树脂置于150 mL锥形瓶中,加入一定浓度和体积的L-Pro溶液进行振荡吸附,每隔一定时间后移取2 mL溶液来测定L-Pro溶液吸附后的浓度。按下列公式分别计算L-Pro的吸附率、吸附量、解吸率和解吸量。
吸附率E=[(C0-C)/C0]×100%
(1)
吸附量q=[(C0-C)V0]/m
(2)
解析率E′=(C1×V1)/(C0-C)×V×100%
(3)
解析量q′=E′×q
(4)
式中:q为树脂的吸附量,mg/g;E为吸附率,%;C0为L-pro溶液的初始浓度,mg/L;C为吸附后L-Pro的浓度,mg/L;V0为原始溶液的体积,mL;q′为树脂的吸附量,mg/g;E′为解吸率,%;C1为L-Pro溶液的洗脱后浓度,mg/L;V1为解吸液体积,mL;V为上样液体积,mL;m为处理的树脂质量,g。
1.5.1 吸附速率曲线的绘制
移取L-Pro溶液100 mL置于含有1 g处理过D001型大孔树脂的锥形瓶中,以170 r/min的转速振荡吸附并开始计时,每隔一定时间移取2 mL,按1.4的方法计算L-Pro溶液的浓度,再根据公式计算L-Pro的吸附率。以时间(min)为横坐标,吸附率(%)为纵坐标,绘制吸附速率曲线。
1.5.2 L-Pro浓度的影响
将浓度依次为10、20、30、40、50、60 mg/L的L-Pro溶液100 mL分别置于含有1 g处理过D001型大孔树脂的6个锥形瓶内。以170 r/min的转速恒温振荡2 h后分别移取2 mL按1.4的方法计算L-Pro溶液的浓度,再根据公式计算L-Pro的吸附率和吸附量。
1.5.3 pH值的影响
将pH为4、5、6、7、8,浓度为50 mg/L的L-Pro溶液100 mL分别置于含有1 g处理过D001型大孔树脂的5个锥形瓶中。按上述同样方法,计算L-Pro的吸附率。
1.5.4 温度的影响
将浓度为50 mg/L、pH6的L-Pro溶液100 mL分别置于含有1 g处理过D001型大孔树脂的5个锥形瓶中。在20、25、30、35、40 ℃条件下恒温振荡2 h,再按上述同样方法,计算L-Pro的吸附率。
1.5.5 无机盐浓度的影响
将含NaCl或NH4Cl浓度依次为0、0.2、0.4、0.6、0.8、1.0 mol/L的浓度为50 mg/L、pH为6的L-Pro溶液100 mL分别置于已装入1 g处理过D001型大孔树脂的6个锥形瓶中。25℃条件下恒温振荡2 h,再按上述同样方法,计算L-Pro的吸附率。
1.6 动态吸附与解吸附实验
1.6.1 上液流速的影响
准确称取处理过的D001型大孔强酸性阳离子交换树脂1 g,湿法装入5根树脂柱中,再分别以1、2、3、4、5 mL/min的上样速度加入pH为6、浓度为50 mg/L的L-Pro溶液50 mL进行动态吸附,收集流出液。各取2 mL按1.4的方法操作,测定样液吸附后的浓度,计算吸附率。
1.6.2 上样液用量的影响
准确称取处理过的D001型大孔强酸性阳离子交换树脂1 g,湿法装入5根树脂柱中,再分别加入流速为3 mL/min、pH为6、浓度为50 mg/L的L-Pro溶液35、40、45、50、55 mL进行动态吸附,收集流出液。各取2 mL按1.4的方法操作,测定样液吸附后的浓度,计算吸附率和吸附量。
1.6.3 不同氨水浓度对动态吸附的影响
准确称取处理过的D001型大孔强酸性阳离子交换树脂1 g,湿法装入5根树脂柱中,再分别加入流速为3 mL/min、pH为6、浓度为50 mg/L的L-Pro溶液50 mL进行动态吸附,收集流出液。各取2 mL按1.4的方法操作,测定样液吸附后的浓度,计算吸附量。然后再分别用浓度为0.5、1.0、1.5、2.0、2.5 mol/L的氨水25 mL以流速为3 mL/min进行洗脱,收集洗脱液。各取2 mL按1.4的方法操作,测定样液洗脱后的浓度,再按1.5公式计算解吸量和解吸率。
1.6.4 氨水流速对动态吸附的影响
准确称取处理过的D001型大孔强酸性阳离子交换树脂1 g,湿法装入5根树脂柱中,再分别加入流速为3 mL/min、pH为6、浓度为50 mg/L的L-Pro溶液50 mL进行动态吸附,收集流出液。各取2 mL按1.4的方法操作,测定样液吸附后的浓度,计算吸附量。然后再用浓度为1.5 mol/L的氨水25 mL以1.0、2.0、3.0、4.0、5.0 mL/min的洗脱速度进行洗脱,收集洗脱液。各取2 mL按1.4的方法操作,测定样液洗脱后的浓度,再按1.5公式计算解吸量和解吸率。
2 结果与分析
2.1 静态吸附实验
2.1.1 吸附速率曲线的绘制
L-Pro溶液的吸附速率曲线见图1。由图1可知,D001大孔强酸性阳离子交换树脂对L-Pro的吸附很慢,50 min后才达到吸附平衡,此时的吸附率为83.12%。
2.2.2 L-Pro浓度的影响
从图2可以看出,随着L-Pro溶液浓度的升高,D001大孔树脂对L-Pro的静态吸附量也随之增加。但在L-Pro溶液浓度为50 mg/mL,吸附率为83.12%,吸附率最大,而在L-Pro溶液浓度为60 mg/mL,吸附率为75.85%出现下降。因此,从吸附率和吸附量综合考虑,最适的L-Pro溶液浓度应为50 mg/mL。
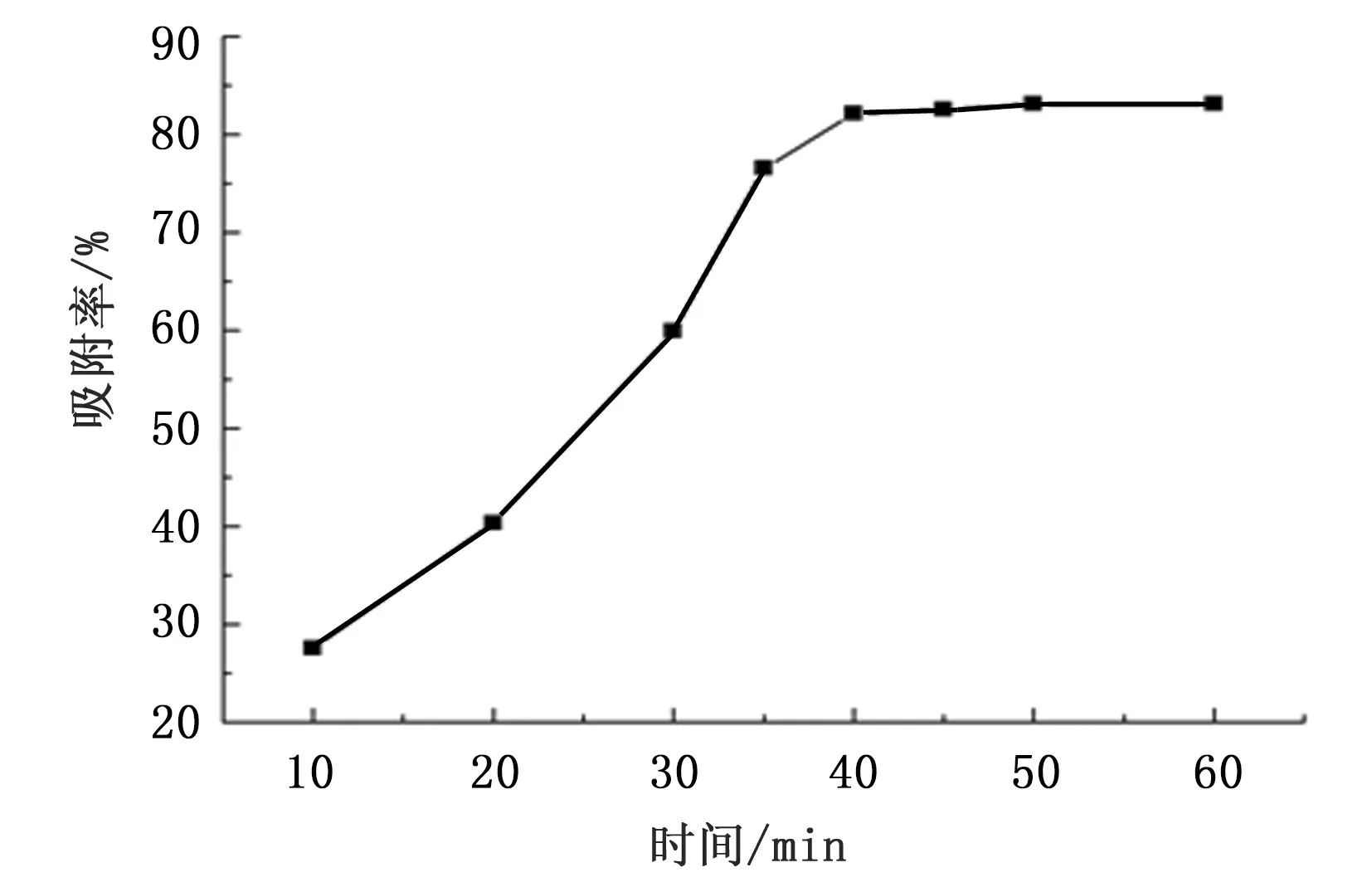
图1 L-Pro吸附速率曲线
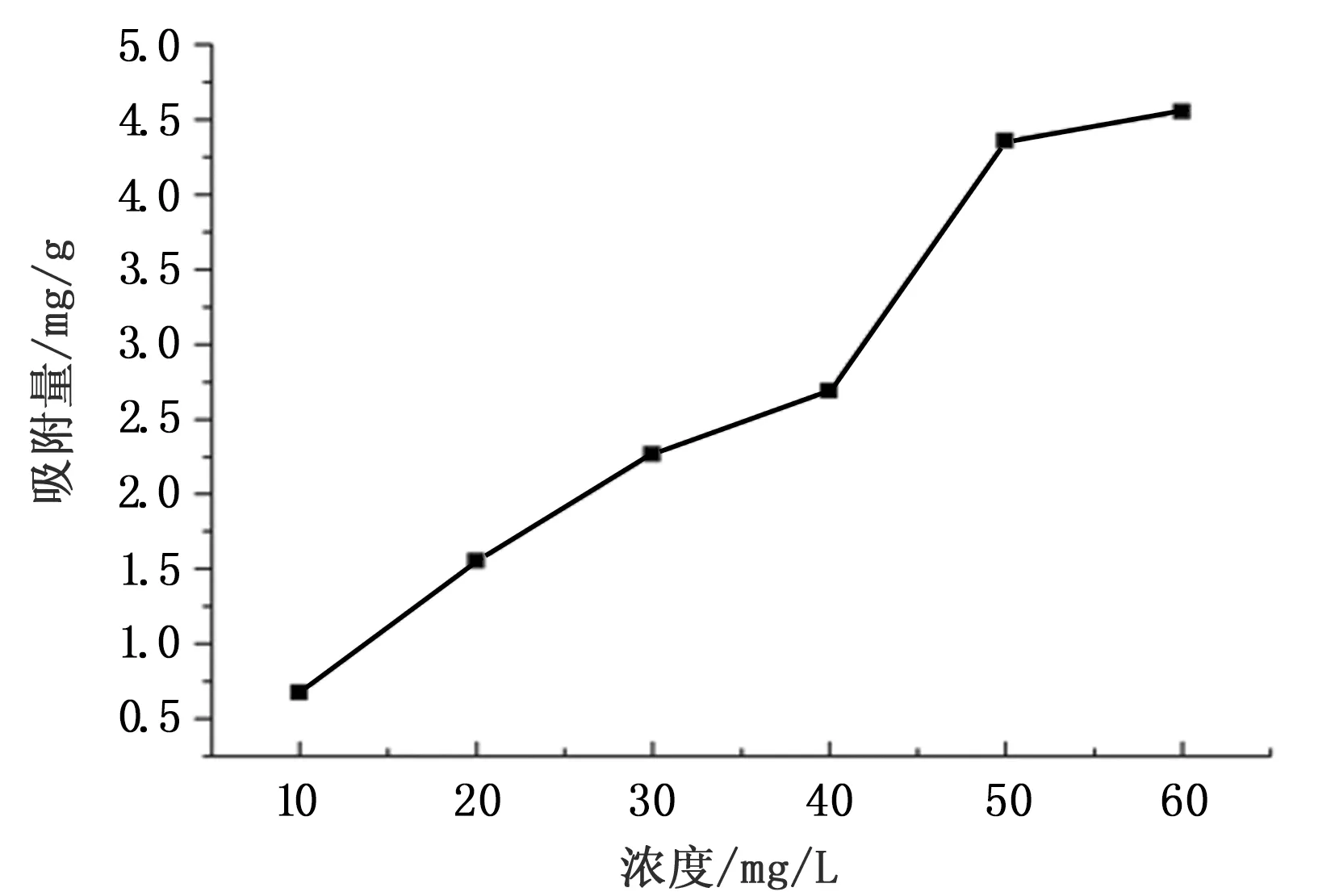
图2 L-Pro浓度的影响
2.2.3 pH值的影响
从图3可以看出,随pH值的增大,L-Pro吸附率也随之增大,当pH等于6时,L-Pro吸附率最大。但当pH大于6时,吸附率反而降低。这是因为L-Pro为两性电解质,在不同的pH环境中以不同的离子形式存在。当pH降低时,L-Pro的阳离子形式数量增加,被交换到树脂的数量也增加,而此时氢离子浓度升高又产生了竞争性吸附,故吸附率又降低。
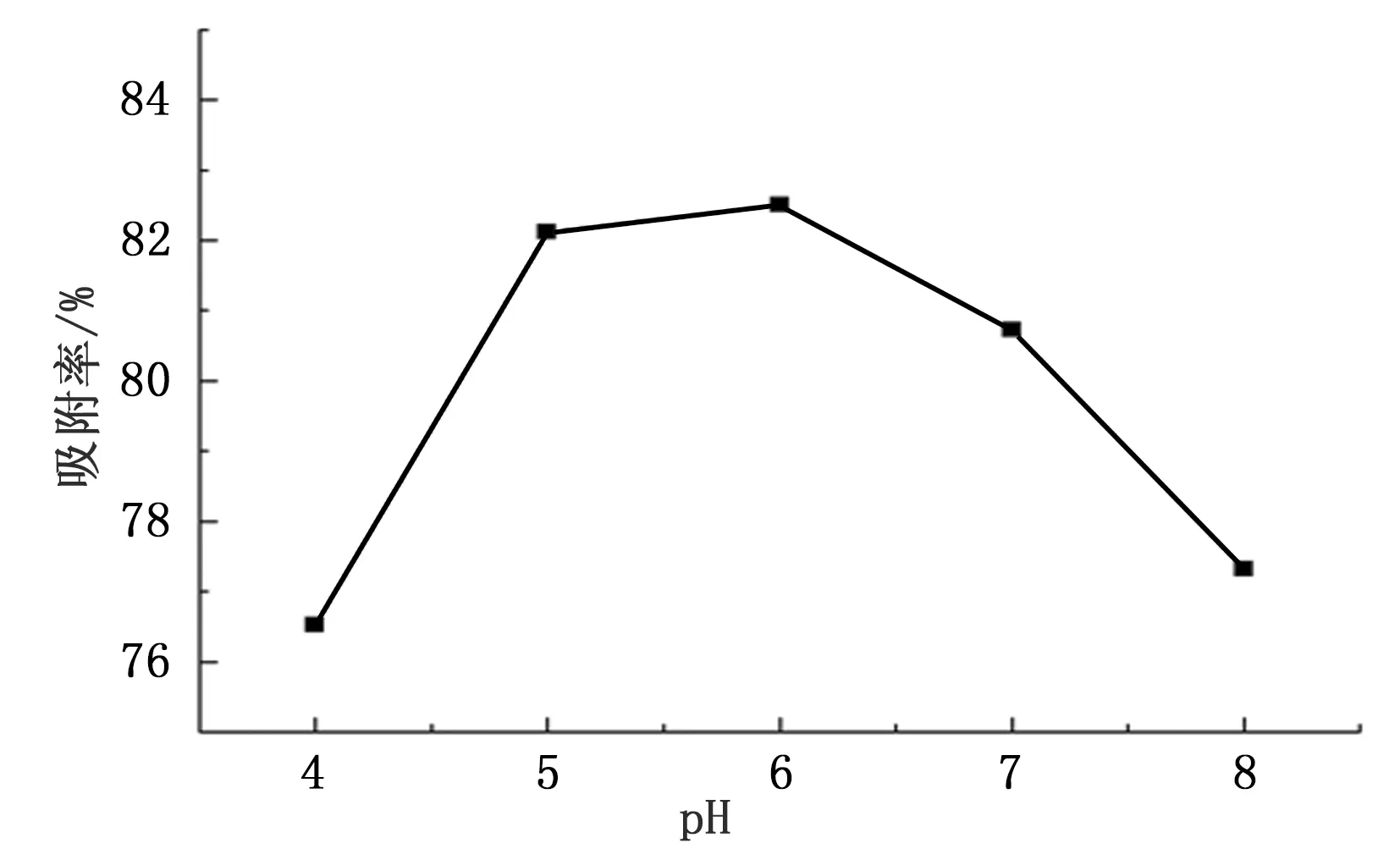
图3 pH值的影响
2.2.4 温度的影响
L-Pro在水溶液中的离子交换吸附是吸附与解吸附同时存在的,从图4可见,随着温度的升高,吸附率逐渐降低,说明此吸附是一个放热过程。由于温度升高不利于吸附,从节能和经济角度考虑,D001型大孔树脂的吸附实验可以在室温下进行,以25℃为佳。
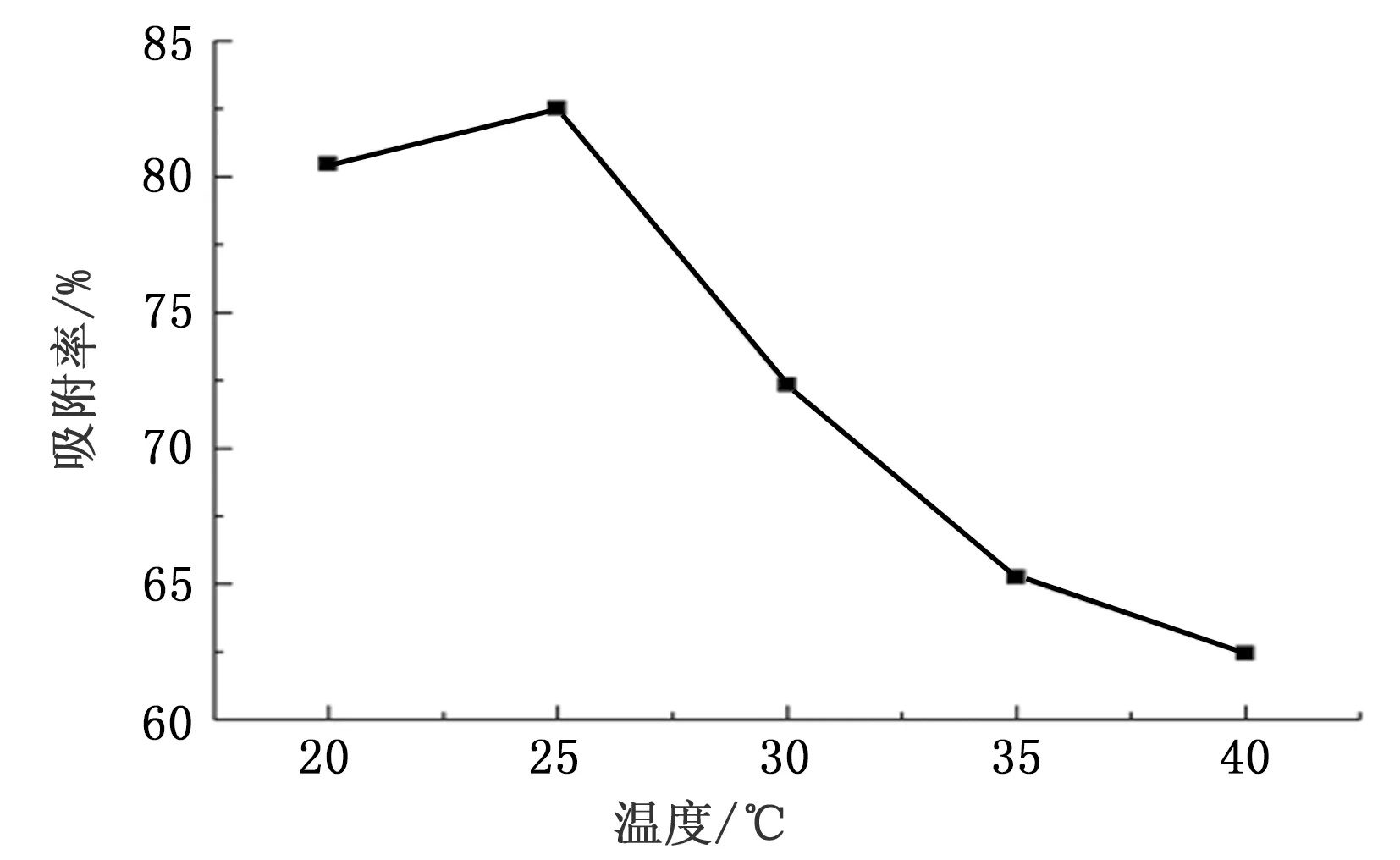
图4 温度的影响
2.2.5 无机盐浓度的影响
图5为不同NaCl或NH4Cl浓度下的吸附率。由图可见,随着盐浓度的增大,L-Pro的吸附率下降明显,其中NaCl的影响略大于NH4Cl。由于Na+或NH4+的存在,形成了L-Pro与无机盐阳离子的竞争吸附,使得L-Pro的吸附率降低。而NaCl浓度对大孔树脂吸附的影响略大于NH4Cl浓度,这是因为NH4Cl是强酸弱碱盐,其水溶液呈酸性,有利于茚三酮的显色反应。因此,在工业生产上,应除去大部分的无机盐,尽量减少溶液中阳离子的竞争吸附。
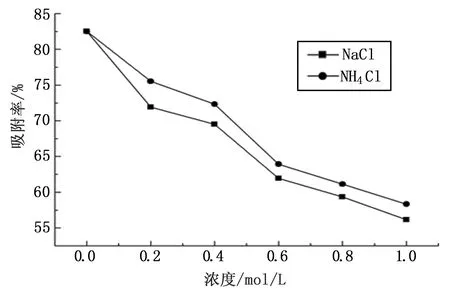
图5 无机盐浓度的影响
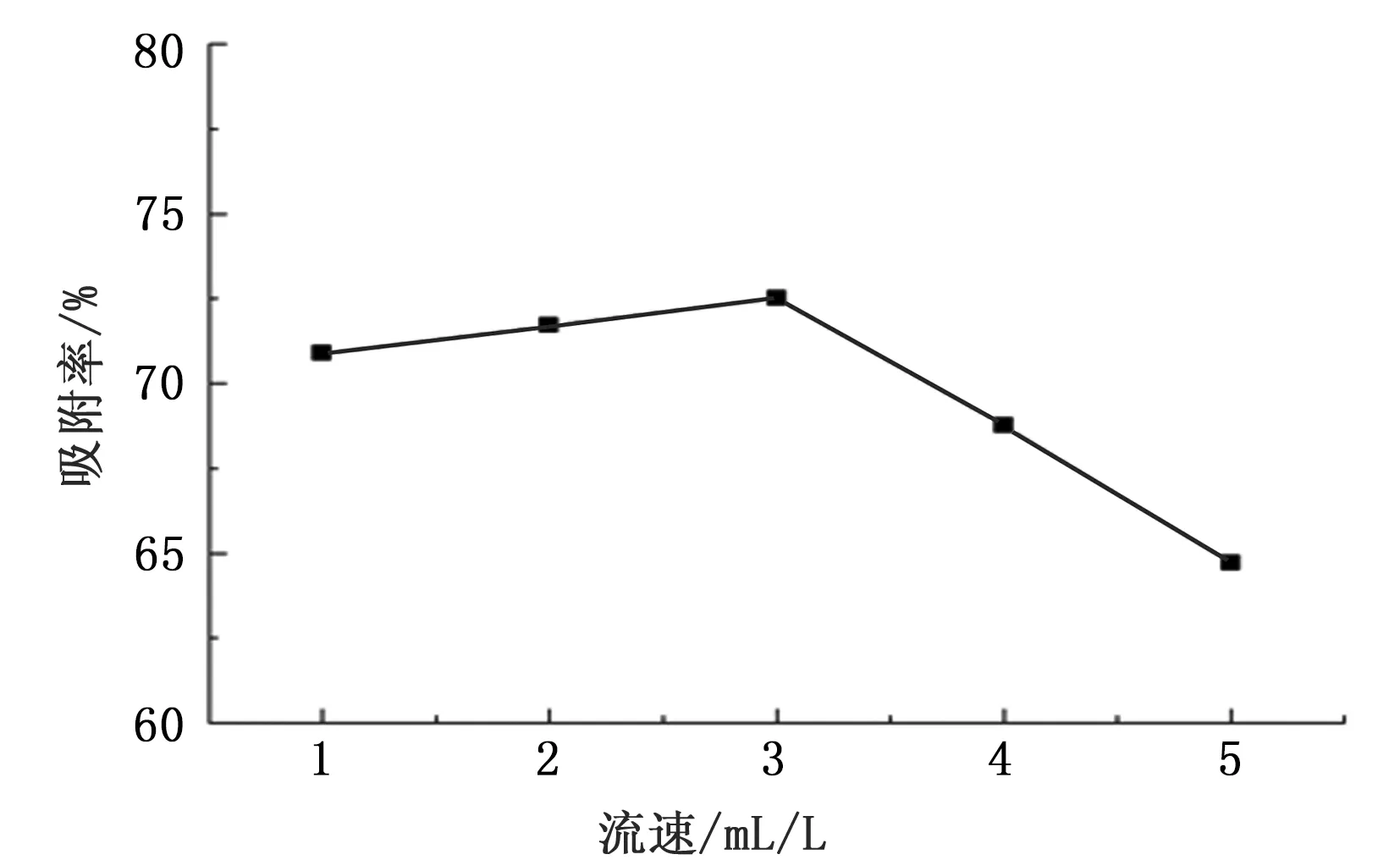
图6 上样液流速的影响
2.2 动态吸附与解吸
2.2.1 上样液流速的影响
图6为上样液流速对L-Pro溶液动态吸附性能的影响。可以看出,当流速低于3 mL/min时,动态吸附率差别不大,说明在低流速条件下L-Pro吸附能够更加充分。当流速大于3 mL/min时,说明流速过快不利于L-Pro充分吸附,导致吸附率下降,较适宜的速度为3 mL/min。
2.2.2 上样液用量的影响
从图7中可见,当L-Pro的用量增加时,L-Pro的吸附率也逐渐增加。这是由于吸附质在大孔树脂上的扩散受L-Pro溶液的体积影响,体积太小,树脂没有达到最大吸附平衡,所以大孔树脂的吸附量就会降低。因此,L-Pro上样液用量应为50 mL。
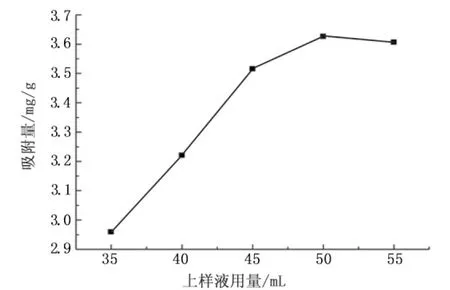
图7 上样液用量的影响
2.2.3 不同氨水浓度对动态解吸的影响
随着氨水浓度增大,解吸率也逐渐增大,但当氨水浓度高于1.5 mol/L时,解吸率又逐渐下降(图8)。这是因为氨水洗脱液的浓度过高,洗脱能力会变强,吸附在树脂上的杂质也会被洗脱下来,导致收集的流出液的体积就会加大,所以应该选择1.5 mol/L的氨水浓度较好。
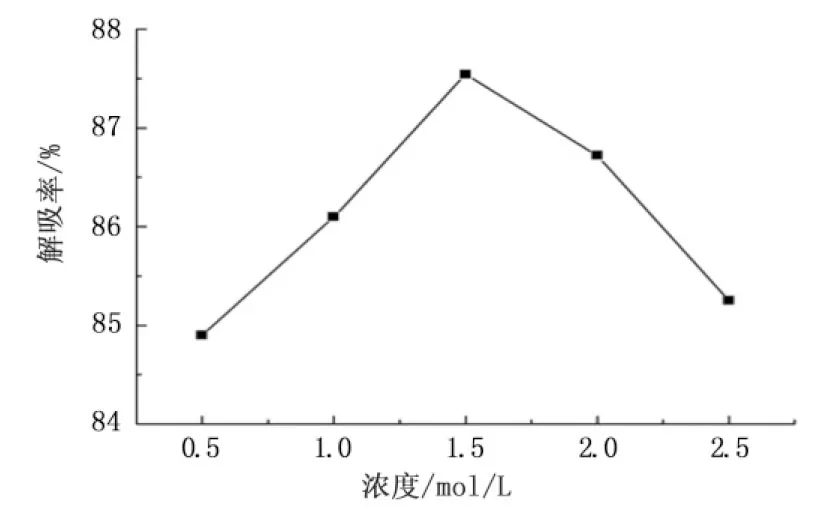
图8 氨水浓度对动态解吸的影响
2.2.4 不同氨水流速对动态解吸的影响
从图9可以得出,当流速低于3 mL/min时,解吸率差别不大,说明在低流速条件下L-Pro具有较好的洗脱效果。当流速大于3 mL/min时,说明流速过快易发生泄漏现象,导致解吸率降低。因此,洗脱剂的适宜流速应为3 mL/min。
3 结 论
实验结果表明,D001大孔强酸性阳离子交换树脂对L-Pro具有较好的吸附性能。静态吸附最佳条件:25℃时,在L-Pro溶液浓度为50 mg/mL、 体积为100 mL、 pH为6的条件下,静态吸附平衡时间为50 min,吸附率为83.12%,无机盐的存在导致吸附率迅速下降;动态吸附与解吸附的最佳条件为: 25℃时,在L-Pro上样液浓度50 mg/mL、体积为50 mL、流速为3 mL/min、 pH为6的条件下,吸附率为72.51%;氨水洗脱浓度为1.5 mol/L、体积为25 mL、流速为3 mL/min的条件下,解吸率为89.10%。
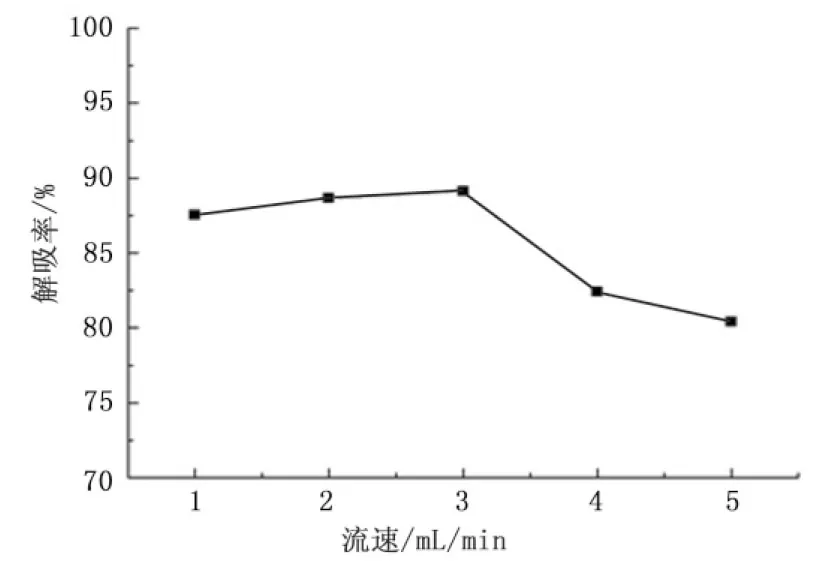
图9 氨水流速对动态解吸的影响
[1]李鑫,李伟,曾庆轩,等.L-脯氨酸在离子交换纤维上的吸附性能研究[J].安徽农业科学,2008,36(10):3961-3963
[2]缪正兴,张仲明,李宝忠.L-脯氨酸的生产及其应用[J].发酵科技通讯,2004,33(2):21-22
[3]彭阳峰,陈迎,蔡水洪.离子交换法从醋酸溶液中提取脯氨酸的研究[J].离子交换与吸附,2000,17(6):538-542
[4]白云峰,丁玉张,海燕.氨基酸分离纯化的研究进展[J]食品研究与开发,2007,28(2):175-178
[5]Wei Luo,Hao Chen,Limei Fan,et al.Adsorption behavior of L-tryptophan on ion exchange resin[J]. Korean Journal of Chemical Engineering,2011,28(5):1272-1279
[6]郭琰辉,虞常波.干态大孔强酸树脂孔结构影响因素研究[J].浙江化工,2015,46(2):28-30
[7]甘林火,翁连进,韩媛媛,等.3种离子交换材料吸附L-精氨酸的研究[J].食品与发酵工业,2005,31(61):1-4
[8]李绍军,龚月桦,王俊儒,梁宗锁.关于茚三酮法测定脯氨酸中脯氨酸与茚三酮反应之探讨[J].植物生理学通讯,2005,41(3):365-368
[9]甘林火,翁连进.胱氨酸母液中L-精氨酸提取工艺研究[J].食品添加剂,2005,26(3):157-159
(责任编辑:汪材印)
2015-07-10
国家级大学生创新创业训练项目(教高司函[2013]8号)。
曹稳根(1964-),安徽东至人,硕士,教授,主要从事生化分析及天然产物研究。
Q517
:A
:1673-2006(2015)12-0107-04
10.3969/j.issn.1673-2006.2015.12.029

