牛血清白蛋白和溶菌酶混合溶液的泡沫性能与其浓度的关系
寇倩云,吴兆亮,胡楠
(河北工业大学化工学院,天津 300130)
牛血清白蛋白和溶菌酶混合溶液的泡沫性能与其浓度的关系
寇倩云,吴兆亮,胡楠
(河北工业大学化工学院,天津 300130)
生物表面活性物质的浓度对其溶液的泡沫性能有很大的影响。泡沫性能包括起泡性和泡沫稳定性。本文以初始泡沫高度和泡沫半衰期分别表征了起泡性和泡沫稳定性。首先利用Szyszkowski扩展方程和Rosen的经验模型,导出了低于临界胶束浓度(CMC)时,两种表面活性物质混合溶液的初始泡沫高度与其各自浓度的关系式;然后根据泡沫相中溶液的重力势能和表面能随气泡破裂而减小的规律,建立了低于CMC时两种表面活性物质混合溶液的泡沫半衰期与其各自浓度的关系式;最后用牛血清白蛋白(BSA)和溶菌酶(LZM)作为实验物系考察了这两种关系式的准确性。结果表明这两种关系式能准确预测BSA和LZM混合溶液的泡沫性能。在BSA和LZM混合溶液中,BSA能显著影响溶液的泡沫性能,而LZM对溶液泡沫性能的影响小。
泡沫;稳定性;起泡性;表面张力;表面活性物质;泡沫性能
引 言
在生物技术的产品生产和使用过程中,存在的各种生物表面活性物质会产生泡沫,因此有必要研究溶液中多组分的生物表面活性物质的泡沫性能。泡沫性能包括起泡性和泡沫稳定性,影响泡沫性能的因素有很多[1-4],其中表面活性物质的浓度对泡沫性能的影响至关重要。表面活性物质的浓度首先影响其溶液的表面张力,进而影响其泡沫性能。表面活性物质的浓度对溶液表面张力的影响已有大量的研究[5-9],一些学者研究了单一表面活性物质溶液的表面张力随其浓度的变化规律[5,8-9]。在这些研究中,Szyszkowski确定了表面活性物质浓度与其溶液表面张力的关系式(式(1)),并被许多学者所引用[5,10-15]。Butler[6]将Szyszkowski方程扩展到了两种表面活性物质混合溶液的表面张力随表面活性物质各自浓度的变化,确定了两种表面活性物质各自浓度与其混合溶液的表面张力的关系式(式(2))。
溶液表面张力对泡沫性能的影响也有大量研究[16],一些学者研究了溶液表面张力对起泡性的影响[16]。其中Rosen等[16]以初始泡沫高度表征溶液起泡性,确定了初始泡沫高度与溶液的表面张力的倒数呈线性关系。通过Butler[6]的Szyszkowski扩展方程(式(2))进而可以确定两种表面活性物质各自浓度与其混合溶液初始泡沫高度的关系式。一些学者对表面活性物质溶液的泡沫稳定性进行研究[5,17]。Samanta等[5]和Eisner等[17]都以泡沫高度随时间减小的规律来表征泡沫稳定性。在泡沫高度随时间减小过程中,泡沫半衰期是一个重要参数,是指泡沫高度降低到初始高度的一半所用的时间。浓度对泡沫半衰期的影响很大。Samanta等[5]没有确定泡沫高度随时间减小的关系式,因此不能通过他们的研究结果确定泡沫半衰期与表面活性物质浓度的关系式。Eisner等[17]虽然确定了表面活性物质溶液的泡沫高度随时间减小的关系式,但是由于其关系式中并没有涉及到表面活性物质的浓度,从而也不能通过他们的研究结果确定泡沫半衰期与表面活性物质浓度的关系式。目前,还没有文献报道初始泡沫高度和泡沫半衰期与表面活性物质浓度的关系式。其中,初始泡沫高度与表面活性物质浓度的关系式可以根据Rosen等[16]的结论和Butler[6]的Szyszkowski扩展方程(式(2))确定;而确定泡沫半衰期与表面活性物质浓度的关系式关键在于确定泡沫半衰期与溶液表面张力的关系式。
本实验旨在研究生物表面活性物质的泡沫性能与其浓度的关系,建立一种新的关联式。考虑到过程中往往存在两种或两种以上生物表面活性物质的混合物,因此,本文以初始泡沫高度和泡沫半衰期分别表征溶液的起泡性和泡沫稳定性。首先利用Szyszkowski扩展方程[6]和Rosen的经验方程[16](式(2)和式(3)),导出了两种表面活性物质混合溶液的初始泡沫高度与其各自浓度的关系式;然后根据泡沫相中溶液的重力势能和表面能都随气泡的破裂而减小的规律,建立了两种表面活性物质混合溶液的泡沫半衰期与其各自浓度的关系式;最后,用牛血清白蛋白(BSA)和溶菌酶(LZM)作为实验物系考察了这两种关系式的准确性。
使用BSA和LZM作为模拟物系的原因是:BSA和LZM经常用于生物表面活性物质的泡沫性能研究[8,18-22],并且它们既可以代表生物技术生产过程中的蛋白质和酶,也可以代表具有较强和较弱表面活性的生物表面活性物质[23-25]。
1 原理
1.1 表面张力和表面活性物质浓度的关系
含有单一表面活性物质的溶液的表面张力和其浓度的关系可用Szyszkowski方程[5]来表征

式中,0γ和γ分别为纯溶剂的表面张力和溶液的表面张力,N·m−1;R为理想气体常数,取8.314 J·mol−1·K−1;T为温度,K;ω为表面活性物质在表面的极限偏摩尔面积,m2·mol−1;k为表面活性物质的吸附系数,L·mol−1;c为表面活性物质的浓度,mol·L−1。Butler[6]将Szyszkowski方程扩展,确定了两种表面活性物质各自浓度与其混合溶液的表面张力的关系式。

式中,下角标1和2分别代表两种不同的表面活性物质。常数ω1,ω2,k1和k2可利用式(1)拟合单一表面活性物质溶液的表面张力随其浓度的变化求得。
式(1)和式(2)的适用范围为表面活性物质的浓度小于其临界胶束浓度(CMC)值。而Samanta等[5]的研究表明,当溶液中表面活性物质的浓度大于CMC值时,溶液的表面张力、起泡性和泡沫稳定性都趋于稳定,不再随着浓度而发生显著变化,因此本研究旨在确定浓度小于CMC的表面活性物质溶液的初始泡沫高度和泡沫半衰期分别与表面活性物质各自浓度的关系。
1.2 初始泡沫高度和表面活性物质浓度的关系
Rosen等[16]确定了表面活性物质溶液的初始泡沫高度与其表面张力的倒数呈线性关系。

其中,Hf为溶液的初始泡沫高度,m;m和n均为常数。
根据式(2)和式(3)可以确定两种表面活性物质各自浓度和其混合溶液的初始泡沫高度的关系式。

式中的常数m和n可利用式(3)对溶液初始泡沫高度和其表面张力的倒数进行线性拟合来确定。
1.3 泡沫半衰期和表面活性物质浓度的关系
图1为确定泡沫半衰期和表面活性物质浓度关系示意图。圆柱塔内装有一定体积的表面活性物质溶液,从塔底向溶液中通入一定量的气体。停止通气时溶液的泡沫高度为Hf,随后泡沫高度随时间逐渐减小,直到泡沫完全消泡。图1(a)为停止通气后某一时刻的泡沫体系,其泡沫高度为H,液相高度为l0。图1(b)为泡沫完全消泡的状态,其液相高度为l。
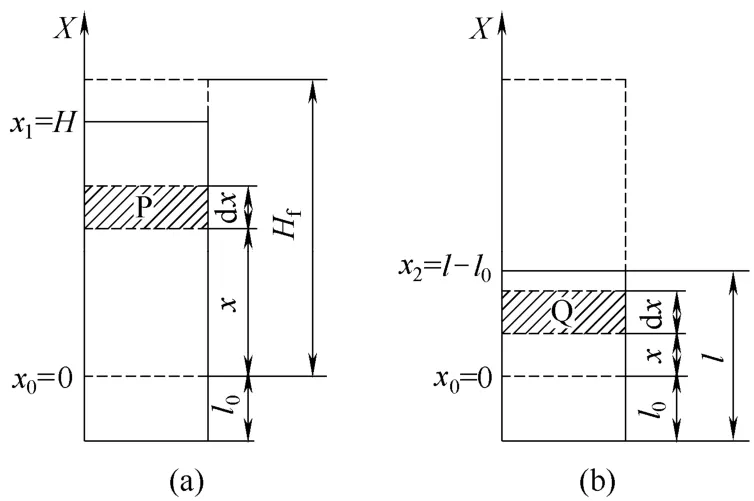
图1 确定泡沫半衰期和表面活性物质浓度关系示意Fig.1 Schematic diagram of determining relational expression between half-time of foam and surface active material concentration
在泡沫消泡过程中,气泡破裂不仅导致泡沫体系的表面能减小,还导致泡沫高度降低,使溶液的重力势能减小。假设:(1)排液作用对泡沫高度没有影响;(2)泡沫高度的减小只与气泡破裂有关。如果已知溶液重力势能的减小(ΔE)与持液率呈正比,表面能的减小(ΔEs)与持气率呈正比,与气泡直径呈反比,那么从停止通气的任意时刻至完全消泡的过程中,溶液重力势能的减小与表面能的减小存在如式(5)所示的关系
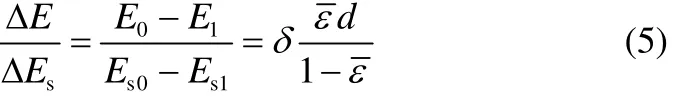
式中,E0和Es0分别为图1(a)泡沫相中溶液的重力势能和表面能,J;E1和Es1分别为图1(b)中泡沫完全消泡时溶液的重力势能和表面能,J;为平均持液率;d为气泡直径,m;δ为比例常数。
设定图1(a)中的泡沫相和液相的界面为零势能面,即x0=0处。并且设定图1(b)的零势能面与图1(a)中的相等。在图1(a)中选取泡沫相任意一小部分区域P。则这部分溶液的重力势能dE0见式(6)

式中,ρ为溶液密度,g·L−1;π=3.14;r为塔的内半径,m;g为重力加速度,N·kg−1;dx为P区域的高度,m;x为P区域距离零势能面的高度,m。
设dA为P区域气泡总表面积,m2,则P区域的表面能dEs0为式(7)

dA与平均持液率的关系可由式(8)表示
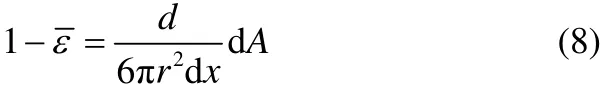
Eisner等[17]确定了气泡直径d与消泡时间满足关系式
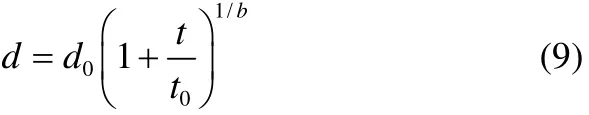
式中,d0为初始泡沫高度时塔中气泡的平均直径,m;t0为气泡从直径为0增大到d0所用的时间,s;t为泡沫消泡的时间,s;b为直径增长速率因子;d0,t0和b均为常数。假设起泡过程中,忽略溶液排液作用,则d0的值只与分布器孔径和气速有关(在泡沫性能实验中,应保持分布器孔径和气速恒定)。
将式(8)和式(9)代入式(7)中可求得dEs0。
图1(b)中,在零势能面以上的液相部分选取一小部分高为dx的区域Q。则Q区域的溶液的重力势能dE1为式(10)。

图1(b)中溶液液面的表面能Es1可由式(11)求得

对式(6)和式(7)积分,积分下限为零,积分上线为H。对式(10)进行积分,积分下线为零,上线为l−l0(因为,所以。将积分结果以及式(11)代入到式(5)中并且整理得到泡沫高度,表面张力和消泡时间的关系见式(12)。
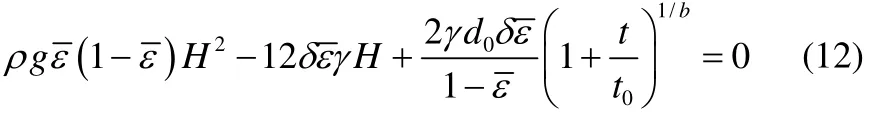
通过式(12)可以确定泡沫半衰期t1/2与表面张力的关系式
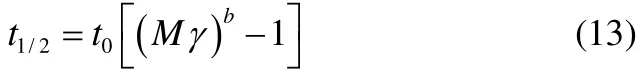
将式(2)带入式(13)中,可以求得两种表面活性物质各自浓度和其溶液的泡沫半衰期之间的关系,见式(14)。

2 实验部分
2.1 实验材料
牛血清白蛋白(BSA)和溶菌酶(LZM)(>98%)购买于天津鼎国生物技术有限责任公司。实验过程使用超纯水,电阻率为18.2 mΩ·cm。
2.2 表面张力测量
用JYW-200B自动界面张力仪(承德试验机责任有限公司)在30℃下测量BSA溶液和LZM溶液以及它们混合溶液的表面张力。
2.3 初始泡沫高度和泡沫半衰期测量
用FDA-100泡沫分析仪(大昌华嘉商业(中国)有限公司)测量BSA溶液和LZM溶液以及它们混合溶液的泡沫高度。设定气速为0.3 L·min−1,通气时间为20 s。实验过程中溶液的体积为50 ml,温度为30℃,控制环境湿度为45%。停止通气时泡沫的高度为初始泡沫高度;从停止通气开始,记录泡沫高度降低为初始高度一半时的时间,即为泡沫半衰期。
3 结果和讨论
3.1 表面张力
分别测量了不同浓度的BSA溶液和LZM溶液的表面张力,实验结果见图2。

图2 BSA溶液和LZM溶液的表面张力随它们浓度的变化曲线Fig.2 Surface tension of BSA and LZM solutions varying with their concentration
由图2可知,BSA和LZM的CMC值分别为9.0×10−7mol·L−1和7.09×10−5mol·L−1,BSA的CMC值明显小于LZM的CMC值。当浓度超过CMC值,BSA的表面张力稳定在5.32×10−2N·m−1,小于LZM的表面张力5.71×10−2N·m−1。由此可知BSA浓度对溶液表面张力变化的影响显著大于LZM浓度对溶液表面张力变化的影响,BSA的表面活性大于LZM的表面活性。
利用式(1)对BSA溶液和LZM溶液的表面张力随其浓度的变化进行拟合。图2中的实线和虚线分别为它们的拟合曲线。将拟合得到的式(1)的常数列于表1中。
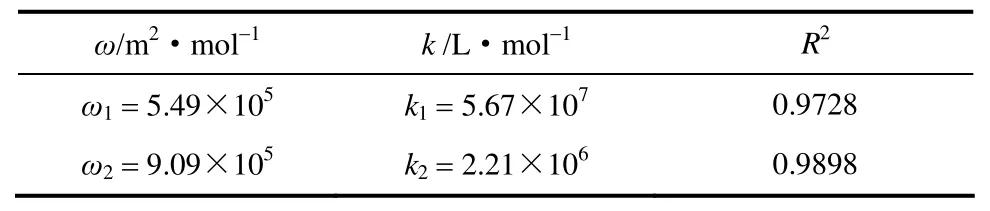
表1 BSA溶液和LZM溶液的表面张力拟合常数Table 1 Fitting constants of surface tension of BSA and LZM solutions
由表1可知BSA溶液和LZM溶液的表面张力随它们浓度的变化可用式(1)很好地拟合。表1中ω1小于ω2,说明当吸附达到饱和时,单位摩尔的BSA分子在气泡表面所占面积小于单位摩尔的LZM分子所占的面积,也即,吸附到气泡表面的BSA分子之间的间距小于LZM分子之间的间距。这与BSA和LZM分子的结构有关。而k1大于k2,说明BSA分子的吸附速率大于LZM的吸附速率,也即,在溶液中加入少量的BSA能使溶液的表面张力迅速降低。
将表1中的常数代入式(2),可以确定BSA和LZM各自浓度与他们混合溶液的表面张力的关系,见式(15)。

式中,30℃时,水的表面张力0γ为0.07118 N·m−1。
用式(15)计算不同浓度的BSA和LZM混合溶液的表面张力并将其与实验值进行相对误差分析可知,两者的相对误差都在5%以内。因此,通过式(15)可以准确预测不同浓度的BSA和LZM混合溶液的表面张力。
图3为BSA和LZM混合溶液的表面张力随它们各自浓度的变化曲面。
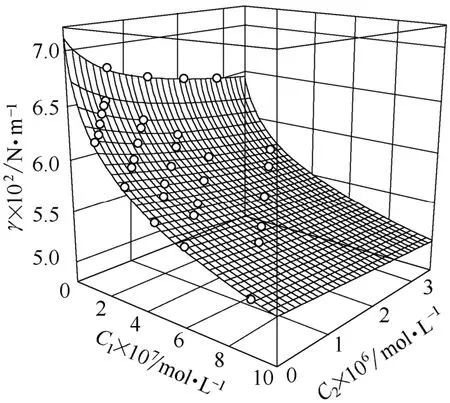
图3 BSA和LZM混合溶液的表面张力随它们浓度的变化曲面Fig.3 Surface tension of solution with BSA and LZM varying with their concentration
3.2 初始泡沫高度
测量了不同浓度的BSA和LZM混合溶液的初始泡沫高度和表面张力。图4为BSA和LZM混合溶液的初始泡沫高度随其表面张力的倒数的变化曲线。
由图4可知,BSA和LZM混合溶液的初始泡沫高度随其表面张力的倒数的增大而线性增大。利用式(3)对图4中的实验数据进行线性拟合,图中的实线为拟合曲线。通过拟合可以确定BSA和LZM混合溶液的初始泡沫高度和表面张力的关系

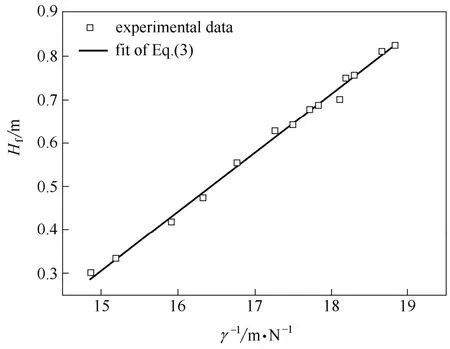
图4 BSA和LZM混合溶液的初始泡沫高度随其表面张力的倒数的变化曲线Fig.4 Initial foam height of solution with BSA and LZM varying with its reciprocal surface tension
式中,R2=0.9940。
通过式(15)和式(16)可以确定BSA和LZM混合溶液的初始泡沫高度和它们各自浓度的关系,见式(17)
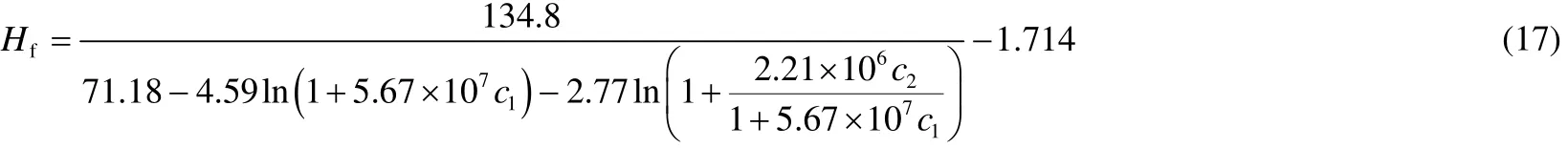
式(17)表明溶液中加入少量BSA可以使溶液的初始泡沫高度显著增加;而LZM的加入虽然使溶液的初始泡沫高度增加,但并不显著。也就是说,BSA和LZM混合溶液的起泡性主要由BSA贡献,这是因为溶液的起泡性依赖于蛋白质分子是否能快速吸附到气泡表面[8]。BSA分子较大的疏水性使其能快速吸附到气泡表面[8],并且由表1的结论可知,相对于LZM分子来说,BSA分子吸附到气泡表面的速率大于LZM的速率。
图5为BSA和LZM混合溶液的初始泡沫高度随它们各自浓度的变化曲面。
3.3 泡沫半衰期
测量不同浓度的BSA和LZM混合溶液的泡沫半衰期和表面张力。图6为BSA和LZM混合溶液的泡沫半衰期随其表面张力的变化曲线。
由图6可以看出,BSA和LZM混合溶液的泡沫半衰期随其表面张力的增大而逐渐减小。利用式(13)对图6中的实验数据进行拟合。图6中的实线为拟合曲线。通过拟合可以确定BSA和LZM混合溶液的泡沫半衰期和表面张力的关系
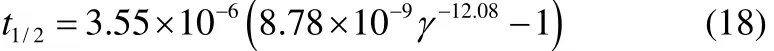
式中,R2=0.9820。
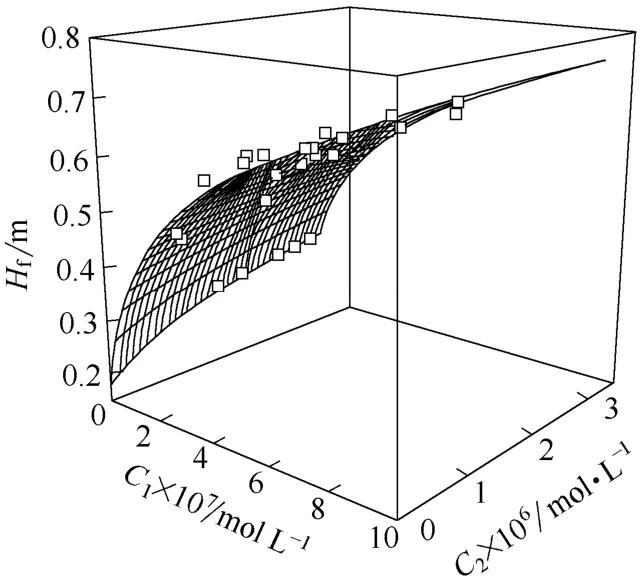
图5 BSA和LZM混合溶液的初始泡沫高度随它们浓度的变化曲面Fig.5 Initial foam height of solution with BSA and LZM varying with their concentration

图6 BSA和LZM混合溶液的泡沫半衰期随其表面张力的变化曲线Fig.6 Half-time of foam of the solution with BSA and LZM varying with its surface tension
由拟合的相关系数可知,式(13)可以很好地描述BSA和LZM混合溶液的泡沫半衰期和表面张力的关系。将式(15)代入到式(18),可确定泡沫半衰期和浓度的关系,见式(19)。

从式(19)中可以看出,溶液中加入少量BSA可以使溶液的泡沫半衰期显著增加;而LZM的加入虽然使溶液的泡沫半衰期增加,但并不显著。BSA和LZM混合溶液的泡沫稳定性主要由BSA贡献。由表1可知,当吸附达到饱和时BSA分子之间的间距小于LZM分子之间的间距,这可能会导致液膜的透气性降低,进而使BSA的泡沫比LZM的泡沫稳定[8]。
图7为BSA和LZM混合溶液的泡沫半衰期随它们各自浓度的变化曲面。
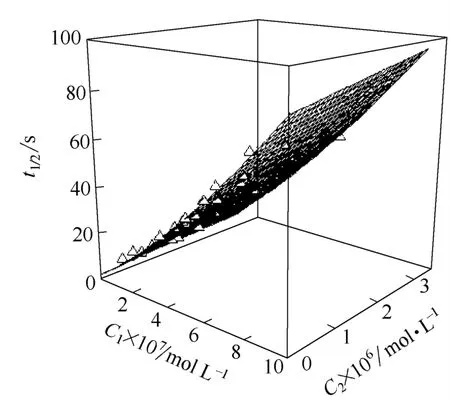
图7 BSA和LZM混合溶液的泡沫半衰期随它们各自浓度的变化曲面Fig.7 Half-time of foam of the solution with BSA and LZM varying with their concentration
3.4 初始泡沫高度和泡沫半衰期与浓度的关系式的准确性检验
图8和图9分别为初始泡沫高度和泡沫半衰期的实验值和用关系式计算的值的对比。
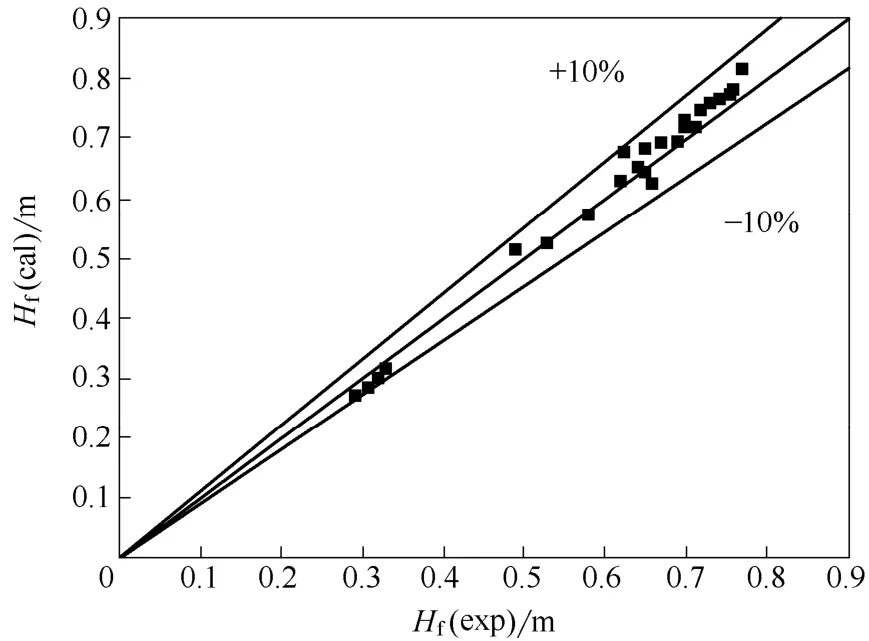
图8 BSA和LZM混合溶液的初始泡沫高度实验值和计算值的比较Fig.8 Comparison of experimental initial foam height of solution with BSA and LZM with calculated ones

图9 BSA和LZM混合溶液的泡沫半衰期实验值和计算值的比较Fig.9 Comparison of experimental half-time of foam of solution with BSA and LZM with calculated ones
由图8和图9可知,BSA和LZM混合溶液的初始泡沫高度和泡沫半衰期的实验值和用关系式计算的值的相对误差均在10%以内,因此这两种关系式可以准确预测BSA和LZM混合溶液的泡沫性能。
4 结 语
多组分生物表面活性物质的组成和浓度对其溶液的泡沫性能有很大的影响。本文用初始泡沫高度和泡沫半衰期分别表征起泡性和泡沫稳定性,建立了两种生物表面活性物质混合溶液泡沫性能与其各自浓度的数学关系式。
(1)通过Szyszkowski扩展方程和Rosen的经验模型,导出了低于临界胶束浓度时两种表面活性物质混合溶液初始泡沫高度与其各自浓度的关系式,并且此关系式可以准确预测BSA和LZM混合溶液的起泡性。
(2)根据泡沫相中溶液的重力势能和表面能都随着气泡破裂而减小的规律,建立了低于临界胶束浓度时两种表面活性物质混合溶液泡沫半衰期与其各自浓度的关系式,并且此关系式可以准确预测BSA和LZM混合溶液的泡沫稳定性。
(3)根据两个关系式,在BSA和LZM混合溶液中,BSA能显著影响溶液的泡沫性能,而LZM对溶液泡沫性能的影响小。
符 号 说 明
b——直径增长速率因子
c——表面活性物质的浓度,mol·L−1
d——气泡直径,m
d0——初始泡沫高度时塔中气泡的平均直径,m
g——重力加速度,N·kg−1
H——泡沫高度,m
k——表面活性物质的吸附系数,L·mol−1
R——理想气体常数,J·mol−1·K−1
r——塔的内半径,m
T——温度,K
t——泡沫消泡的时间,s
t0——气泡从直径为0增大到d0所用的时间,s
x——某区域距离零势能面的高度,m
γ——溶液表面张力,N·m−1
γ0——水的表面张力,N·m−1
ε——平均持液率
ρ——溶液密度,g·L−1
ω——表面活性物质在表面的极限偏摩尔面积,m2·mol−1
[1] Hedreul C, Frens G. Foam stability [J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2001, 186: 73.
[2] Pandey S, Bagwe R P, Shah D O. Effect of counterions on surface and foaming properties of dodecyl sulfate [J].Journal of Colloid and Interface Science, 2003, 267 (1): 160-166.
[3] Langevin D. Polyelectrolyte and surface active material mixed solutions: behavior at surfaces and in thin films [J].Advances in Colloid and Interface Science, 2001, 89/90: 467-484.
[4] Ozdemir G, Peker S, Helvaci S S. Effect of pH on the surface and interfacial behavior of rharnnolipids R1 and R2 [J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2004, 234 (1/2/3): 135-143.
[5] Samanta S, Ghosh P. Coalescence of bubbles and stability of foams in aqueous solutions of Tween surface active materials [J].Chemical Engineering Research and Design, 2011, 89 (11A): 2344-2355.
[6] Butler J A V. Chemical Thermodynamics [M]. London: Macmillan, 1962.
[7] Hu Y F, Lee H. Prediction of the surface tension of mixed electrolyte solutions based on the equation of Patwardhan and Kumar and the fundamental Butler equations [J].Journal of Colloid and Interface Science, 2004, 269 (2): 442-448.
[8] Brown A K, Kaul A, Varley J. Continuous foaming for protein recovery (Part Ⅱ): Selective recovery of proteins from binary mixtures [J].Biotechnology and Bioengineering, 1999, 62 (3): 291-300.
[9] Hernáinz F, Caro A. Variation of surface tension in aqueous solutions of sodium dodecyl sulfate in the flotation bath [J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2002, 196 (1): 19-24.
[10] Lee J Y, Hildemann L M. Surface tension of solutions containing dicarboxylic acids with ammonium sulfate, D-glucose, or humic acid [J].Journal of Aerosol Science, 2013, 64: 94-102.
[11] Prosser A J, Franses E I. Adsorption and surface tension of ionic surface active materials at the air-water interface: review and evaluation of equilibrium models [J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2001, 178 (1/2/3): 1-40.
[12] Tuckermann R. Surface tension of aqueous solutions of water-soluble organic and inorganic compounds [J].Atmospheric Environment, 2007, 41 (29): 6265-6275.
[13] Hey M J, Kippax P G. Surface tensions of mixed aqueous solutions of tert-butanol andn-pentanol [J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2005, 262 (1/2/3): 198-203.
[14] Anna Z. The adsorption properties of short chain alcohols and Triton X-100 mixtures at the water-air interface [J].Journal of Colloid and Interface Science, 2009, 335 (2): 175-182.
[15] Aumann E, Hildemann L M, Tabazadeh A. Measuring and modeling the composition and temperature-dependence of surface tension for organic solutions [J].Atmospheric Environment, 2010, 44 (3): 329-337.
[16] Rosen M J, Solash J. Factors affecting initial foam height in the Ross-Miles foam test [J].Journal of the American oil Chemists’Society, 1969, 46: 399-402.
[17] Eisner M D, Jeelani S A K, Bernhard L, Windhab E J. Stability of foams containing proteins, fat particles and nonionic surface active materials [J].Chemical Engineering Science, 2007, 62: 1974-1987.
[18] Alahverdjieva V S, Khristov Khr, Exerowa D, Miller R. Correlation between adsorption isotherms, thin liquid films and foam properties of protein/surface active material mixtures: Lysozyme/C10DMPO and lysozyme/SDS [J].Colloids and Surfaces A:Physicochemical andEngineering Aspects, 2008, 323 (1/2/3): 132-138.
[19] Wang Wen (王闻), Zhuang Xinshu (庄新姝), Yuan Zhenhong (袁振宏), Yu Qiang (余强), Qi Wei (亓伟), Wang Qiong (王琼), Tan Xuesong (谭雪松). Effects of ions and surface active material on enzymatic hydrolysis of sweet sorghum bagasse [J].CIESC Journal(化工学报), 2013, 64 (10): 3767-3774.
[20] Phillips M C. Protein conformation at liquid interfaces and its role instabilising emulsions and foams [J].Food Technology, 1981, 35: 50-57.
[21] Graham D E, Phillips M C. Proteins at liquid interfaces (Ⅱ): Adsorption isotherms [J].Journal of Colloid and Interface Science, 1979, 70: 415-426.
[22] Graham D E, Phillips M C. The Conformation of Proteins at the Airwater Interface and Their Role in Stabilising Foams [M]. New York: Academic Press, 1976: 237-255.
[23] Burghoff B. Foam fractionation applications [J].Journal of Biotechnology, 2012, 161: 126-137.
[24] Wang Y, Nan F, Zheng H, Wu Z. Effects of temperature and trehalose on foam separation of nisin from the culture broth produced byLactococcus lactissubspecieslactisW28 [J].Journal of Dairy Science, 2012, 95: 5588-5596.
[25] Zhang F, Wu Z L, Wu Z J, Wang H W. Effect of ionic strength on the foam separation of nisin from the fermentation broth [J].Separation and Purification Technology, 2011, 78: 42-48.
Relationship between foam properties and protein concentration in aqueous solution of bovine serum albumin and lysozyme
KOU Qianyun, WU Zhaoliang, HU Nan
(School of Chemical Engineering and Technology,Hebei University of Technology,Tianjin300130,China)
The concentration of biologic surface active materials has a great influence on the foam properties of the solution with them. Foam properties include foaming ability and foam stability. In this work, foaming ability and foam stability were characterized by initial foam height and half-time of foam, respectively. The relational expression between the initial foam height of the solution with two surface active materials and their concentration bellow the critical micelle concentration (CMC) was determined by using the extended Szyszkowski equation and Rosen’s empirical model. The relational expression between the half-time of foam of the solution with two surface active materials and their concentration bellow the CMC was established on the basis of the rules that the gravitational potential energy and the surface energy all decreased with the bubble breakup in the foam phase. An aqueous solution with bovine serum albumin (BSA) and lysozyme (LZM) was used as the simulation system to verify the accuracy of these relational expressions. The results showed that the two relational expressions could be used to accurately predict the foam properties of the solution with BSA and LZM. The effect of BSA on the foam properties of the solution was more significant than that of LZM.
foam; stability; foaming ability; surface tension; surface active material; foam property
Prof. WU Zhaoliang, zhaoliangwu_hebut@ 163.com
10.11949/j.issn.0438-1157.20150269
O 648
:A
:0438—1157(2015)10—4107—08
2015-03-05收到初稿,2015-06-12收到修改稿。
联系人:吴兆亮。
:寇倩云(1989—),女,硕士研究生。
国家自然科学基金项目(21346008)。
Received date: 2015-03-05.
Foundation item: supported by the National Natural Science Foundation of China (21346008).

