乙二酸和苯甲酸在活性炭上的脱附行为
王占营,刘应书,2,李子宜,杨雄,2,杨权,姜理俊
(1北京科技大学机械工程学院,北京 100083;2北京科技大学北京高校节能与环保工程研究中心,北京 100083)
乙二酸和苯甲酸在活性炭上的脱附行为
王占营1,刘应书1,2,李子宜1,杨雄1,2,杨权1,姜理俊1
(1北京科技大学机械工程学院,北京 100083;2北京科技大学北京高校节能与环保工程研究中心,北京 100083)
低挥发性有机酸不仅自身污染环境而且显著促进颗粒污染物形成,对其吸脱附性能的研究有助于这类物质的控制。采用程序升温脱附(TPD)技术对乙二酸、苯甲酸在活性炭(AC)上的脱附行为进行了研究。结果表明,吸附主要发生在粗微孔(0.7~2 nm)、细微孔(<0.7 nm)中,对应TPD曲线中的吸附位Ⅰ、Ⅱ。粗微孔对乙二酸、苯甲酸的脱附活化能为101.63、112.43 kJ·mol−1,吸附量均大于总吸附量的91%。细微孔对乙二酸、苯甲酸的脱附活化能为118.01、130.87 kJ·mol−1,吸附量均小于总吸附量的9%。细微孔吸附强度高于粗微孔,但吸附量远低于粗微孔,因为细微孔对吸附质的迁移阻力较大,仅少量吸附质能进入细微孔中。苯甲酸在迁移中受到阻力较乙二酸大,在细微孔中吸附量更小,表现为分子筛分作用。
乙二酸;苯甲酸;活性炭;动力学;脱附;吸-脱附机理
引 言
近年研究显示,以乙二酸、苯甲酸为代表的有机酸不仅自身对环境危害严重,而且在二次颗粒物形成过程中具有显著促进作用[1-2]。对有机酸净化脱除的研究,将有助于颗粒污染物的控制研究。在有机酸的吸附研究中,吸-脱附机理研究对吸附剂的设计、生产至关重要,同时对吸附净化工艺的流程设计也极为关键。
因有机酸等低挥发性有机物具有沸点高、饱和蒸气压低等特点,有机蒸气的气相吸附实验研究难度较大,同时其作为动力学直径较大的分子,与常见小分子气体的吸-脱附机理有所区别,因而研究成果有限。目前,对低挥发性有机物的吸-脱附机理的研究,主要集中在苯系物[3-4]、烷烃[5]、卤代烃[6]等,而有机酸的研究尚未见报道。
通常在有机蒸气的吸附过程中,物理吸附起主导作用,孔道结构影响吸附是最关键的因素[7]。在芳香烃蒸气吸附研究中,Mastral等[8]、Lillo-Ródenas等[9]提出细微孔(narrow micropore,<0.7 nm,也称超微孔[10])、粗微孔(wide micropore,0.7~2 nm)对吸附起主导作用,大孔、介孔起协同作用。此外,吸附剂结构不均匀是形成多吸附位的主要原因,不同吸附位体现出的吸/脱附强度不同:Malović等[11]、Ban等[12]认为苯在silicalite-1分子筛上体现出的两种吸附位分别由微孔交叉处、直孔道造成,吸附质优先占据孔道交叉处,此处吸附质受到更大的孔壁作用,更难于脱附;杜旭东等[13]对正己烷在5A分子筛上脱附研究表明,脱附曲线中的双脱附峰分别由分子筛外表面、孔道内表面中的吸附位造成。
在脱附动力学研究方法中,程序升温脱附(TPD)技术因其快速、便捷等优点,近年受到研究者的重视,用于求算脱附活化能Ed,Ed值大小代表脱附难易程度,可表征吸附作用的强度;已用于辅助分析二英[14]、二苯并呋喃[15]、二氯甲烷[6]、苯[16]等有机物在活性炭上脱附行为。
本文以乙二酸、苯甲酸两种典型有机酸在AC上的脱附为研究对象,结合TPD技术求算动力学参数,定量描述脱附作用强度,分析吸附剂孔道结构、表面性质及吸附质性质对脱附性能影响,推测吸附质在吸附剂中的吸附状况,借以探究有机酸在AC上的吸-脱附机理。
1 实验材料和方法
1.1 材料
乙二酸(AR),苯甲酸(AR),甲醇(AR),沥青质AC(粒径150~180 μm,上海吴羽化学有限公司),AC使用前进行改性处理,改善其吸附性能。改性方法为:取适量AC,经去离子水振荡清洗、过滤3次后,用0.1 mol·L−1HCl溶液清洗3次,浸泡2 h后过滤,用去离子水清洗至pH=7,再用0.1 mol·L−1NaOH溶液清洗3次,浸泡2 h后过滤,用去离子水清洗至pH=7后,在373 K下的干燥箱中干燥备用。吸附质主要性质见表1。

表1 乙二酸和苯甲酸的分子参数Table 1 Molecular parameters of ethanedioic acid and benzoic acid
1.2 实验方法
取0.15 g的AC放入25 ml浓度为0.2 mol·L−1的乙二酸、苯甲酸的甲醇溶液中,置于298 K恒温水浴槽中12 h后过滤,将AC与滤纸一同置于343 K干燥箱内2 h;同时,作为对比,相同条件下制备仅附着甲醇的AC和空白AC,上述样品封存备用。将空白及已吸附甲醇、乙二酸、苯甲酸的AC分别记为C-AC、M-AC、E-AC、B-AC,以上样品进行动力学分析。此外,验证实验溶液浓度为0.06 mol·L−1,其他条件相同。
脱附实验在TGA Q500型热重分析仪(TA Instruments)上进行,同种样品分别取3份(每份20 mg±1 mg)在3种升温速率下进行脱附实验,如图1所示。此外,针对每种样品在相同条件下进行了两组重复性实验,实验重复性较好,热重(TG)曲线基本重合;由滴定法测得制备样品的溶液中吸附质的减少量与脱附实验中样品脱附量近似相等,即样品在脱附实验中已脱附完全。升温程序为:初始平衡温度303 K,保温2 min后,开始记录数据;升温速率分别为8、12、16 K·min−1,达到833 K后,停止记录数据,恢复初始平衡温度,准备下一组实验;实验载气为高纯N2,流量100 ml·min−1。脱附实验可获得不同升温速率下的热重(TG)曲线、失重速率(DTG)曲线,TPD曲线可由DTG曲线计算得到[17]。

图1 TPD实验装置示意图Fig.1 Schematic for TPD experiment
1.3 脱附动力学处理方法
1.3.1 动力学参数求算方法 在通过TPD曲线获取动力学参数前,需判断在脱附过程中有无明显再吸附现象[18],即吸附质分子在脱附过程中与孔壁发生碰撞并再次吸附于吸附剂表面上的现象。根据有无再吸附现象发生,结合吸附、脱附本征动力学反应方程,脱附速率r有如下两种表达[19-20]。

进行三元线性回归,可得到n和p值。
通过分析拟合的相关系数R2的大小、n和p的合理性,可判断有无再吸附现象及反应级数值,即确定合理脱附机理。
2 实验结果与讨论
2.1 待吸附AC表征与分析
2.1.1 TG曲线分析 图2为C-AC、M-AC、E-AC、B-AC等4种样品在升温速率为12 K·min−1下的TG曲线。在实验温度范围内,C-AC与M-AC的TG曲线几乎重合;二者失重量仅为1.05%,主要发生在低于373 K的温度范围内,表明失重主要是由样品内残余的水分蒸发造成的,同时说明甲醇在样品制备过程中已脱除完全,不会对研究乙二酸和苯甲酸在AC上的脱附造成影响。由TG曲线可见,乙二酸和苯甲酸的脱附起始温度分别为383和423 K,均在AC性质稳定的温度范围内。

图2 样品热重(TG)曲线Fig.2 TG curves of AC samplesa—C-AC;b—M-AC;c—E-AC;d—B-AC
2.1.2 AC表征与分析 在77、273 K下分别以N2、CO2为分子探针,使用Autosorb-1C物理吸附仪对AC的孔道结构进行表征,如图3所示,具体参数见表2。参考Mastral等[8]、Lillo-Ródenas等[9]分析方法,粗微孔(wide micropore,0.7~2 nm)孔容V(N2)、介孔(2~50 nm)孔容VBJH和比表面积SBET均由N2吸附数据分别采用D-R、BJH和BET方程求得,而其细微孔(narrow micropore,<0.7 nm)孔容V(CO2)、孔分布均匀性η和平均孔径X由CO2吸附数据采用D-R、D-A方程求得。由图3可知,在微孔范围内(<2 nm)以0.7 nm为分界线呈现出较明显的双峰分布,说明AC具有较分明的细微孔、粗微孔结构。
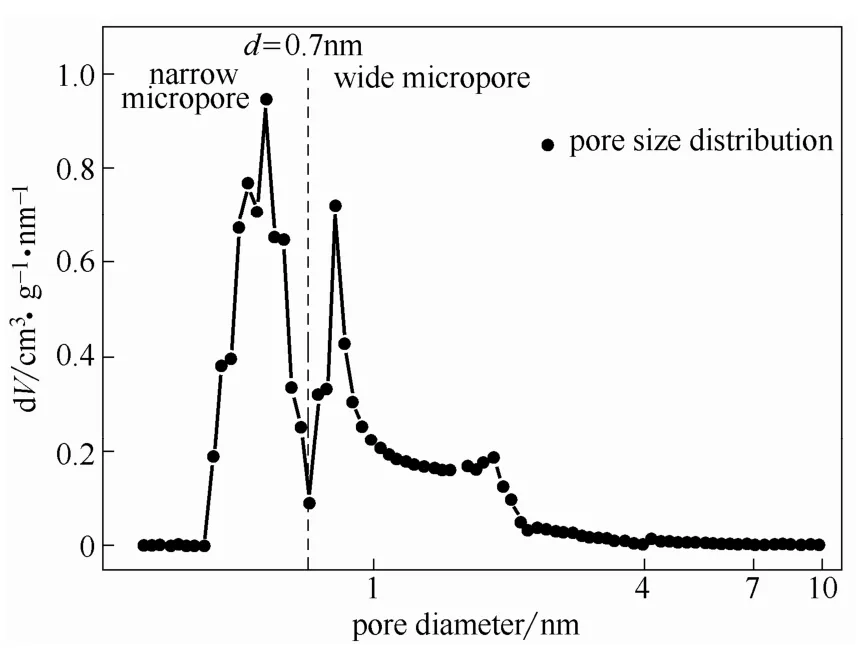
图3 AC孔径分布曲线Fig.3 Pore size distribution of AC

表2 活性炭结构参数Table 2 Textural parameters of activated carbon
同时,使用自动电位滴定仪(瑞士万通 905)以Boehm滴定法表征AC表面官能团,表征结果见表3,AC表面官能团含量相对较少,可能与改性处理有关[22]。
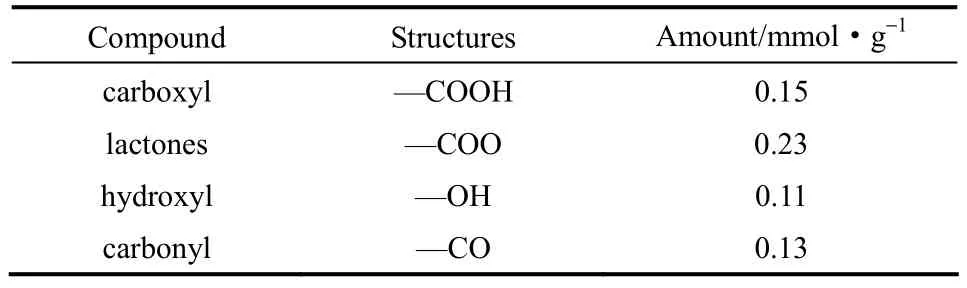
表3 活性炭表面化学性质Table 3 Chemical properties of activated carbon
2.2 脱附动力学分析
2.2.1 TPD曲线双脱附峰剥离处理 图4和图5分别为E-AC、B-AC在不同β的TPD曲线,曲线中脱附峰与一种强度的吸附位相对应,即E-AC、B-AC均体现出两种不同强度的吸附位。曲线中的脱附峰Ⅰ、Ⅱ出现峰面重叠、拖尾等复杂情况。多元线性拟合一般适用于单脱附峰,双脱附峰情况需进行剥离。可先根据脱附峰的对称性推测可能的n值[23],再利用对称因子法对脱附峰进行剥离处理,进而由多元线性拟合法确定脱附机理。
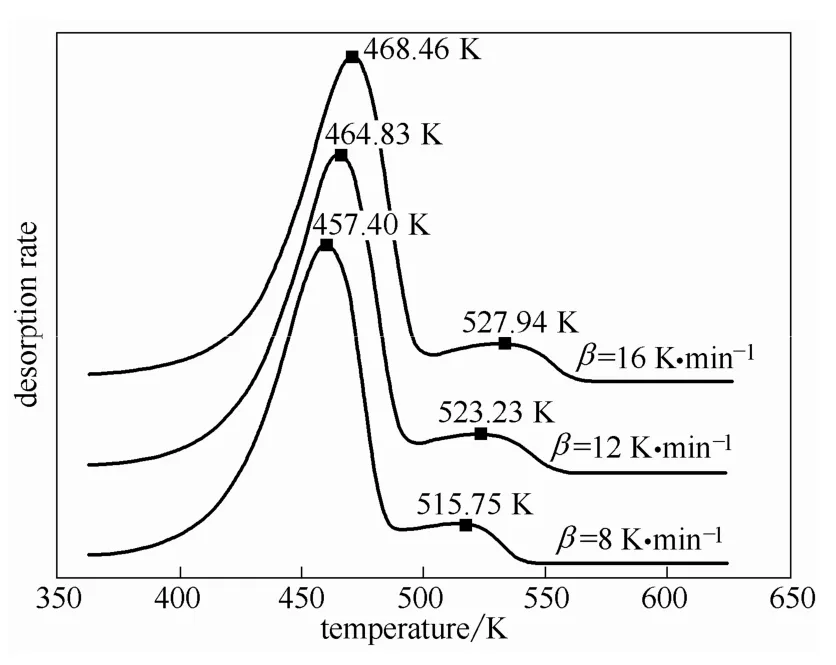
图4 乙二酸程序升温脱附曲线Fig.4 TPD desorption curves of ethanedioic acid

图5 苯甲酸程序升温脱附曲线Fig.5 TPD desorption curves of benzoic acid
Chen[24]认为,理想的脱附峰的对称因子μ0为定值,n=1时,μ0=0.42,n=2时,μ0=0.52,如图6。据式(3)可知,θp=1−μ0,则n=1时,θp=0.52,n=2时,θp=0.48。

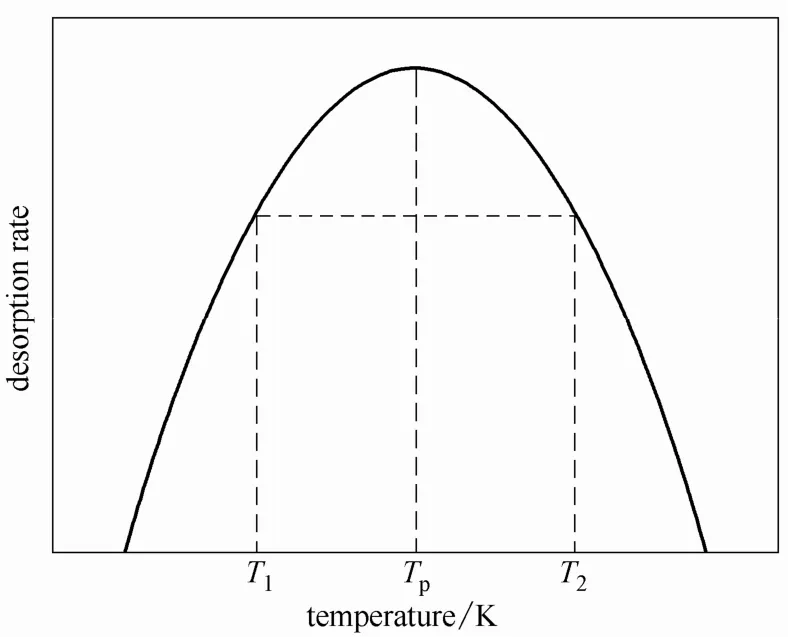
图6 对称因子法示意图Fig.6 Curve of symmetry factor method
从脱附峰对称性推断乙二酸脱附峰Ⅰ、Ⅱ的n值分别为1、2,苯甲酸的两个脱附峰的n值均为2。一般认为,低温峰Ⅰ低温分支和高温峰Ⅱ高温分支相互影响较小,取其为研究对象,进行剥离处理,结果见表4。
由表4,Qest与Qexp非常接近,δ<1%,双峰剥离处理较为理想。此外,同种吸附质质量比与物质量比数值相等,为便于计算文中质量比与物质量比等同。QⅠ>QⅡ,分别占Qest的91.00%和97.72%,说明相比于吸附位Ⅱ,吸附位Ⅰ对乙二酸、苯甲酸均具有更大的吸附容量;QⅡ,E/Qest,E(9.00%)>QⅡ,B/Qest,B(2.28%),说明相比于苯甲酸,吸附位Ⅱ更适宜乙二酸吸附。
2.2.2 脱附机理判断 由表4中得到的QⅠ和QⅡ,结合式(3)可得到不同吸附位θ与T的对应关系,取脱附峰Ⅰ的低温侧和脱附峰Ⅱ的高温侧分析,见表5。
将表5中的数据分别代入式(15)、式(16),进行多元线性拟合分析,得到拟合结果见表6。
由表6,E-AC、B-AC的p值均接近于零,说明再吸附现象影响极小。此外,E-AC的脱附峰Ⅰ、Ⅱ的n值分别接近1、2,B-AC的脱附峰Ⅰ、Ⅱ的n值均接近2,与利用对称性判断n值的结果相同,再次验证该剥离处理的合理性。
2.2.3 脱附动力学参数求算 对无再吸附现象发生的脱附过程,将图4、图5中的Tp值代入式(12),利用(2lnTp−lnβ)对1/Tp作图,由斜率和截距可求算Ed和A值,如图7所示。

图7 脱附峰温度与升温速率关系Fig.7 Relationship between maximum desorption temperature and heating rate
求算结果见表7,Ed,B>Ed,E且Ed,Ⅱ>Ed,Ⅰ,因Ed值可表征吸附作用强度,可以判断苯甲酸与吸附剂的作用强度强于乙二酸,且吸附位Ⅱ作用强度强于吸附位Ⅰ。引入亲和性指数TA[25](TA=Tp−Tb,出现双脱附峰时Tp取较高值),可得TA,E、TA,B分别为99.28、162.40,说明苯甲酸与AC间的亲和性(吸附作用)强于乙二酸,与Ed分析结果相同。
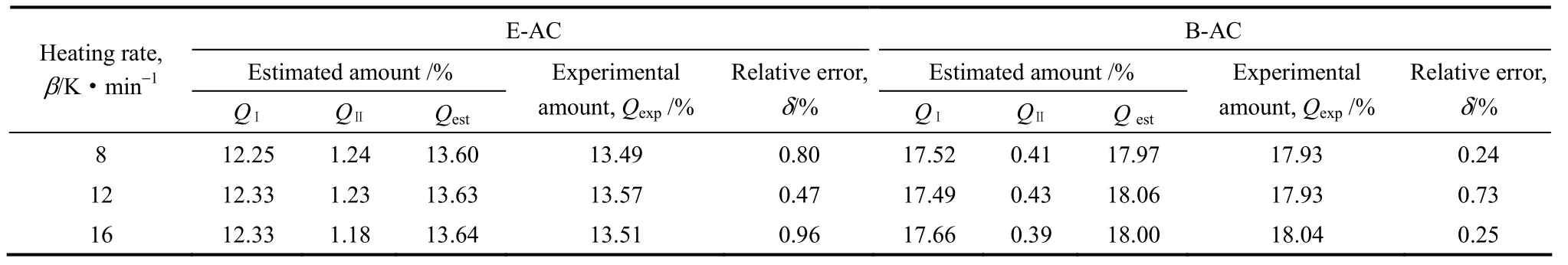
表4 对称因子法剥离脱附峰结果Table 4 Split of TPD desorption peaks

表5 TPD曲线中覆盖度与温度的关系Table 5 Relationship between coverage and temperature in TPD curve

表6 E-AC和B-AC的多元线性拟合结果Table 6 Multiple linear regression of E-AC and B-AC TPD curves
2.3 吸-脱附机理探究
2.3.1 吸附剂结构对吸-脱附机理影响 吸附过程中,吸附质在孔道内迁移将受到一定的阻力,阻碍吸附质进入位置更深的孔道[26]。大孔、介孔为AC的主要通道,粗微孔、细微孔为其裂缝、分支形成,因而进入粗微孔中的吸附质较少,仅有极少量可进入细微孔中。孔道壁面吸附作用越强,吸附质越易被吸附。大孔、介孔孔径远大于吸附质动力学直径,吸附作用较弱,难于有效吸附进入其中的吸附质;粗微孔、细微孔孔径与吸附质动力学直径相当,吸附作用较强,细微孔内的范德华势场叠加作用将进一步强化吸附作用;此外,由图3可知,AC存在明显的粗微孔、细微孔分界。因此,可推断尽管两种吸附质动力学直径略有差异,但吸附均主要发生在粗微孔、细微孔中,大孔、介孔主要起协同作用,与Mastral等[3]提出的不同PAHs在碳材料上吸附机制相似;粗微孔、细微孔分别表现为吸附位Ⅰ、Ⅱ,与实验结果(QⅠ>QⅡ、EdⅡ>EdⅠ)相符,Huang等[27]也认为吸附热ΔH(物理吸附,Ed≈ΔH)与孔径呈负相关。

表7 乙二酸和苯甲酸在活性炭上的脱附动力学参数Table 7 Dynamic parameters of ethanedioic acid and benzoic acid desorption from activated carbon
吸附初始阶段,吸附质优先吸附于粗微孔中,随着吸附量增加,吸附质间作用增强,少部分会迁移进入细微孔,发生吸附[28]。可推断,低吸附量AC的TPD曲线中,脱附峰Ⅱ会明显减弱,甚至消失。图8为低吸附量(QE=6.25%,QB=11.66%)TPD曲线,可见乙二酸脱附峰Ⅱ明显减弱(QⅡ/Q0= 4.06%<9.00%),苯甲酸已无明显脱附峰Ⅱ出现,即低吸附量时吸附质极少或几乎不吸附于细微孔中。
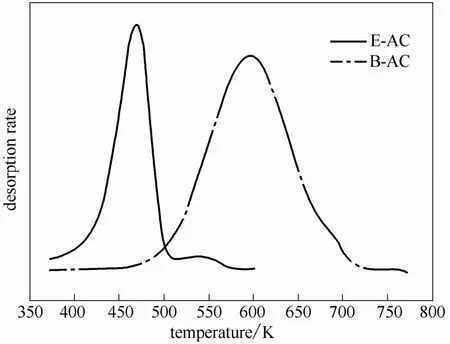
图8 低吸附量乙二酸和苯甲酸在AC上的TPD曲线Fig.8 TPD curves of ACs with low loads of organic acids
2.3.2 吸附质性质对吸-脱附机理影响 吸-脱附机制不仅与吸附剂结构密切相关,还与吸附质自身性质相关,如分子动力学直径、形状、官能团、相对分子质量、沸点等[29]。由于分子动力学直径、形状等因素,在吸附质迁移过程中,苯甲酸(σB=0.58 nm,环状结构)受到的阻力大于乙二酸(σE=0.45 nm,链状结构)[28],且此差异随孔径减小将愈发显著,在细微孔中表现出较明显的分子筛分作用(molecular sieving effect)[30],乙二酸的脱附峰Ⅱ较苯甲酸更突出,即相比于苯甲酸吸附位Ⅱ更易吸附乙二酸,QⅡ,E/Qest(9.00%)>QⅡ,B/Qest(2.28%)。
有机酸的吸附作用受范德华力、氢键等影响,苯甲酸(MB=122 g·mol−1、Tb,B=522 K)的范德华力强度大于乙二酸(ME=90 g·mol−1、Tb,E=374 K),而苯甲酸(一个羧基)受到的氢键作用弱于乙二酸(两个羧基)。根据动力学求算结果,AC对苯甲酸的吸附作用(Ed=112.43、130.87 kJ·mol−1)强于乙二酸(Ed=101.63、118.01 kJ·mol−1),苯甲酸的脱附峰温度高于乙二酸,且AC表面官能团含量较低(表3),推测范德华力对有机酸吸附作用的贡献较氢键更突出。
3 结 论
(1)吸附主要发生在粗微孔、极微孔中,分别表现为脱附过程的吸附位Ⅰ、Ⅱ,孔道中迁移阻力、孔径造成Q、Ed的差异。
(2)乙二酸、苯甲酸在吸附位Ⅱ上的吸附作用强于吸附位Ⅰ,在吸附位Ⅰ、Ⅱ上的Ed值分别为:乙二酸101.63、118.01 kJ·mol−1,苯甲酸112.43、130.87 kJ·mol−1;而在吸附位Ⅰ上的吸附量均占总吸附量的绝大部分,分别为91.00%和97.72%。
(3)苯甲酸(σB=0.58 nm,环状结构)在吸附迁移中受到阻力较乙二酸(σE=0.45 nm,链状结构)大,在细微孔中的吸附量更低,细微孔对两种吸附质表现出较明显的分子筛分作用。
符 号 说 明
A,B——脱附、吸附的频率因子,s−1
C——主气相中的吸附质摩尔分数
Ea,Ed——吸附、脱附的活化能,J·mol−1
F——载气流量,m3·s−1
ΔH——吸附热,J·mol−1
ka,kd.K——吸附、脱附速率常数、指前因子,s−1
M——分子摩尔质量,g·mol−1
m,m0,m1——样品在某温度时、初始时、脱附结束后质量,%
n,p——脱附、吸附反应级数
Q,Q0——某温度下单位吸附剂吸附量、初始吸附量,%
r——脱附速率,%·s−1
T,T0,Tp——温度、脱附初始温度、脱附峰点温度,K
Vs——吸附剂的体积,m3
β——升温速率,K·s−1
η——微孔分布均匀性指数
θ——吸附位覆盖度
σ——最小截面动力学直径,nm
下角标
E,B ——乙二酸,苯甲酸
Ⅰ,Ⅱ ——脱附峰Ⅰ,Ⅱ
[1] Zhang Renyi, Suh I, Zhao Jun, Zhang Dan, Fortner E C, Tie Xuexi, Molina L T, Molina M J. Atmospheric new particle formation enhanced by organic acids [J].Science, 2004, 304(5676): 1487-1490.
[2] Huang Xiaofeng (黄晓锋), Hu Min (胡敏), He Lingyan (何凌燕). Determination of water soluble organic acids in PM2.5 of atmosphere in Beijing city [J].Environmental Science(环境科学), 2004, 25(5): 21-25.
[3] Mastral A M, García T, Callén M S, Navarro M V, Galbán J. Removal of naphthalene, phenanthrene, and pyrene by sorbents from hot gas [J].Environ. Sci. Technol.,2001, 35(11): 2395-2400.
[4] Li Liqing (李立清), Liang Xin (梁鑫), Shi Rui (石瑞), Gu Qingwei (顾庆伟), Yao Xiaolong (姚小龙), Tang Lin (唐琳), Liu Zheng (刘峥). Adsorption of toluene and methanol onto activated carbons with acid modification [J].CIESCJournal(化工学报), 2013, 64(3): 970-979.
[5] Liu Zhiping (刘芝平), Zhang Qiangqiang (张嫱嫱), Ma Jinghong (马静红), Li Ruifeng (李瑞丰). Adsorption ofn-paraffins on mesoporous 5A zeolites [J].CIESCJournal(化工学报), 2014, 65(3): 934-941.
[6] Pan Hongyan (潘红艳), Li Zhong (李忠), Xia Qibin (夏启斌), Xi Hongxia (奚红霞), Li Jing (李晶), Qian Yu (钱宇). Effect of metal ions loaded onto activated carbons on desorption activation energy of dichloromethane [J].Journal of Chemical Industry and Engineering(China) (化工学报), 2007, 58(9): 2259-2265.
[7] Chiang Y, Chiang P, Huang C. Effects of pore structure and temperature on VOC adsorption on activated carbon [J].Carbon, 2001, 39(4): 523-534.
[8] Mastral A M, Garca T, Callén M S, Murillo R, Navarro M V, López J M. Sorbent characteristics influence on the adsorption of PAC (Ⅰ): PAH adsorption with the same number of rings [J].Fuel Process. Technol.,2002, 77(2): 373-379.
[9] Lillo-Ródenas M A, Cazorla-Amorós D, Linares-Solano A. Behavior of activated carbons with different pore size distributions and surface oxygen groups for benzene and toluene adsorption at low concentrations [J].Carbon, 2005, 43(8): 1758-1767.
[10] Liu Kewan (刘克万), Gu Min (辜敏), Lin Wensheng (林文胜), Xian Xuefu (鲜学福), Zeng Lai (曾来). Characterization of microstructure of carbon molecular sieve [J].Journal of Materials Science and Engineering(材料科学与工程学报), 2008, 26(6): 984-989.
[11] Malović D, Vučelić D. Application of thermal analysis for explaining the sorption of benzene andN-hexane on silicalite [J].J. Therm. Anal. Calorim.,1998, 53(3): 835-842.
[12] Ban Hongyan, Gui Jianzhou, Zhang Xiaotong, Dai Min, Song Lijuan, Sun Zhaolin, Rees L V C. TPD of cyclic hydrocarbons in silicalite-1 studied by intelligent gravimetry [J].Thermochim. Acta., 2005, 439(1): 121-126.
[13] Du Xudong (杜旭东), Tang Yun (唐芸), Cui Qun (崔群), Wang Haiyan (王海燕), Yao Huqing (姚虎卿). Desorption characteristic ofn-hexane adsorbed on binder-free 5A zeolites [J].Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2013, 27(1): 32-37.
[14] Xi Hongxia, Li Zhong, Zhang Haibing, Li Xiang, Hu Xijun. Estimation of activation energy for desorption of low-volatility dioxins on zeolites by TPD technique [J].Sep. Purif. Technol.,2003, 31(1): 41-45.
[15] Li Xiang (李湘), Li Zhong (李忠), Luo Lingʼai (罗灵爱). New TPD model for activation energy estimation [J].Journal of Chemical Industry and Engineering(China) (化工学报), 2006, 57(2): 258-262.
[16] Li Jing (李晶), Li Zhong (李忠), Xi Hongxia (奚红霞), Xia Qibin (夏启斌). Activation energy for desorption of benzene on modified activated carbons [J].The Chinese Journal of Process Engineering(过程工程学报), 2006, 6(5): 734-737.
[17] Park J H, Yang R T. Predicting adsorption isotherms of low-volatile compounds by temperature programmed desorption: iodine on carbon [J].Langmuir, 2005, 21(11): 5055-5060.
[18] Xia Xinyu, Strunk J, Litvinov S, Muhler M. Influence of re-adsorption and surface heterogeneity on the microkinetic analysis of temperature-programmed desorption experiments [J].J. Phys. Chem. C., 2007, 111(16): 6000-6008.
[19] Cvetanović R J, Amenomiya Y. A temperature programmed desorption technique for investigation of practical catalysts [J].Catal. Rev. Sci. Eng.,1972, 6(1): 21-48.
[20] Konvalinka J A, Scholten J, Rasser J C. Analysis of second-order desorption kinetics in temperature-programmed desorption [J].J. Catal.1977, 48(1): 365-373.
[21] Duan Xue (段雪), Wang Qi (王琪), Peng Shaoyi (彭少逸). Analysis for TPD and TPR curves by linear regression multidimentions [J].Petroleum Processing and Petrochemicals(石油炼制与化工), 1988, 1(3): 53-58.
[22] Fan Yanzhen (范延臻), Wang Baozhen (王宝贞), Wang Lin (王琳), Yu Min (余敏). Adsorption of organic micropollutants on modified activated carbons [J].Environmental Chemistry(环境化学), 2001, 20(5): 444-448.
[23] Amennomiya Y, Cvetanovic R J. Advances in Catalyst [M]. New York: Academic Press, 1967: 103-149.
[24] Chen R. On the analysis of thermal desorption curves [J].Surface Science, 1974, 43(2): 657-661.
[25] Qian Bin (钱斌), Sun Yaojun (孙尧俊), Long Yingcai (龙英才). Study on affinity index of adsorbate on siliceous zeolites with different channel size [J].Acta Chimica Sinica(化学学报), 2001, 59(2): 235-240.
[26] Kubo S, Kosuge K. Salt-induced formation of uniform fiberlike SBA-15 mesoporous silica particles and application to toluene adsorption [J].Langmuir, 2007, 23(23): 11761-11768.
[27] Huang M C, Chou C H, Teng H. Pore size effects on activated carbon capacities for volatile organic compound adsorption [J].AIChE J.,2002, 48(8): 1804-1810.
[28] Dai Min (代敏), Ban Hongyan (班红艳), Zhang Xiaotong (张晓彤), Song Lijuan (宋丽娟), Sun Zhaolin (孙兆林). Thermal desorption behavior of cyclopentane and cyclohexane in silicalite-1 zeolites [J].Journal of Fuel Chemistry and Technology(燃料化学学报), 2005, 33(1): 117-120.
[29] Chiang Y, Chiang P, Chang E E. Effects of surface characteristics of activated carbons on VOC adsorption [J].J. Environ. Eng., 2001, 127(1): 54-62.
[30] Kosuge K, Kubo S, Kikukawa N, Takemori M. Effect of pore structure in mesoporous silicas on VOC dynamic adsorption/ desorption performance [J].Langmuir, 2007, 23(6): 3095-3102.
Desorption behavior of ethanedioic acid and benzoic acid on activated carbon
WANG Zhanying1, LIU Yingshu1,2, LI Ziyi1, YANG Xiong1,2, YANG Quan1, JIANG Lijun1
(1School of Mechanical Engineering,University of Science and Technology Beijing, Beijing100083,China;2Beijing Engineering Research Center for Energy Saving and Environmental Protection,University of Science and Technology Beijing,Beijing100083,China)
Low-volatility organic acids are harmful to the environment. Adsorption/desorption study of organic acids on adsorbents is of great significance to control these pollutants. Here temperature programmed desorption method was used to study the desorption behavior of ethanedioic and benzoic acids on activated carbon. Results show that textural characteristics of activated carbon play a critical role since wide micropores (0.7—2 nm) and narrow micropores (<0.7 nm) dominate the adsorption at active sites Ⅰ and Ⅱ, respectively. Interactions of ethanedioic and benzoic acids with active site Ⅰ (Ed= 101.63, 112.43 kJ·mol−1) are weaker than those with active site Ⅱ (Ed=118.01, 130.87 kJ·mol−1), whereas the adsorption amount on active site Ⅰ is much larger than that on active site Ⅱ. Molecular sieving effect is shown to explain the fact that ethanedioic acid with a chain structure and smaller kinetic diameter is easier to be adsorbed into narrow micropores as compared to benzoic acid with a circular structure and larger kinetic diameter.
ethanedioic acid; benzoic acid; activated carbon; kinetics; desorption; adsorption-desorption mechanism
YANG Xiong, yangx@ustb.edu.cn
10.11949/j.issn.0438-1157.20150408
TQ 028.1
:A
:0438—1157(2015)10—4016—09
2015-04-01收到初稿,2015-07-08收到修改稿。
联系人:杨雄。
:王占营(1989—),男,硕士研究生。
国家自然科学基金项目(51478038)。
Received date: 2015-04-01.
Foundation item: supported by the National Natural Science Foundation of China (51478038).

