pH振荡研究型化学实验*
杨珊侯玉龙胡道道**
(1陕西师范大学材料科学与工程学院 陕西西安710062;2渭南师范学院化学与生命科学学院 陕西渭南714099)
化学振荡是指在某些化学反应体系中,某些参数(如物质浓度、温度、颜色、电极电位等)随时间、空间的变化而发生周期性变化的现象[1]。化学振荡反应以其非平衡、非线性变化的特点,成为物理化学实验教学的经典实验之一[2-3]。该实验可对激发学生实验兴趣发挥积极作用。在以往的物理化学实验中,皆以B-Z振荡反应(-CH2(COOH)2-Ce4+)为模型,测试其电位或颜色振荡行为,且振荡发生在封闭体系中。这类实验对于学生了解化学振荡反应现象、初步理解自然界中普遍存在的非平衡非线性问题等具有积极意义。尽管该实验具有装置简单、现象明显等特点,但以电位变化反映振荡行为,不易以此为基础进行拓展性实验。pH刺激响应现象的普遍性使得pH振荡反应更具拓展性。所谓pH振荡,是指H+驱动的化学振荡反应[4]。由于pH变化在自然界的普遍性,使得pH振荡转化为其他振荡的可能性更为广泛。目前已见报道的pH振荡体系有20多个,其中溴酸盐-亚硫酸盐-亚铁氰化物(BrO-3-,简称BSF)体系是最典型的一个大幅pH振荡体系[5]。这类振荡反应与络合平衡、沉淀平衡偶合,可将pH振荡转化为Ca2+、F-、Al3+等振荡[6]。将pH敏感性大分子材料与pH振荡体系偶合,可将pH振荡转化为机械或光学行为振荡[7-10],如利用BSF体系pH振荡实现DNA构象振荡[7]或光子晶体的颜色振荡[10]。因此,pH振荡具有重要的研究价值和应用价值。基于以上考虑,我们尝试性地将BSF体系pH振荡引入到化学实验教学中,得到了学生的广泛认可。该实验设备简单,pH振幅较大、振荡稳定、重现性好,很适合本科实验教学。与传统的电位振荡实验相比,该实验具有更强的拓展性。将其作为综合性或研究型实验,对学生的关联性学习具有积极的意义。期望通过本实验的介绍为开设新的物理化学实验提供借鉴。
1 实验目的
(1)了解基于BSF反应的pH振荡原理。
(2)了解连续流动式化学振荡反应实验系统。
(3)熟悉pH振荡反应装置及作用原理。
(4)掌握测试表观活化能的实验方法。
(5)了解影响pH振荡反应的因素及机制。
(6)掌握计算机数据采集与处理在化学实验中的应用。
2 实验原理
在一定条件下,BSF体系可以产生周期性的pH变化,即pH振荡。1989年,Edblom等人提出了BSF体系的反应机理[11]。Rábai,Kaminaga和Hanazaki于1996年提出了更为合理的反应机理,被称为RKH模型(表1)[12]。

表1 RKH模型的反应机理和速率常数[12]
在RKH模型中,BSF体系的pH振荡可简要解释如下[12]:在SO23-存在时,反应R1和R3构成一个主要的反应途径(S)(由3R1+R3得到):

该反应是一个需H+催化的反应,但并非自催化。反应(S)只有在存在时才能进行,在此过程中,快速的R1平衡使[H+]保持非常低的状态。当被消耗时,大量的H+被释放,并通过R2反应产生H2SO3。由此引发一个自动催化产生H+的反应(D)(由3R2+R4得到),使pH快速下降。反应(D)为正反馈(positive feedback),称为BSH反应(),它使体系pH降低至一定值。

另一方面,反应R5为负反馈(negative feedback),称为BFH反应它发生作用持续消耗H+,从而使体系回到高pH状态。当pH升高到一定值时,反应(S)启动,使体系进入下一个循环。
振荡反应是一个充满相互竞争的复杂反应体系,振荡是体系在特殊条件下所发生的现象。通常,产生化学振荡需满足3个条件[13]:
(1)反应必须远离热力学平衡态。只有远离平衡态,系统才具有足够的反应推动力,实现从无序自发地转化为有序,从而产生化学振荡[14]。封闭体系(closed system)中产生的振荡会随时间衰减直至消失,体系最终达到热力学平衡态。要产生持续稳定的振荡,必须在不断补充反应物的开放体系的条件下进行。本实验就是一个典型的开放体系,可以获得持续稳定的化学振荡。
(2)体系中存在自催化反应。以BSF体系为例,反应(D)具有产生H+的自催化反应特征[15]。
(3)体系必须存在双稳态。以BSF体系为例,其pH振荡发生在高pH和低pH两个稳定态之间,这主要是由于产生H+的正反馈反应能够在pH=2和pH=6~7这两种状态稳定存在[11]。
BSF体系在间歇(batch)反应器中(即封闭条件)难以产生连续振荡,其pH随时间变化行为如图1(a)所示。在连续进样反应器中能够产生如图1(b)所示的持续、周期性的大幅pH振荡。
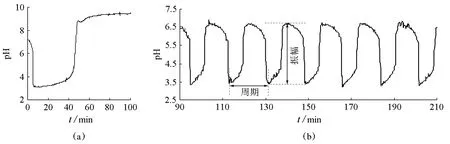
图1 BSF体系典型的pH-t曲线
通过BSF体系pH振荡曲线,可以了解振荡行为及影响反应的各种因素。由于体系pH随时间周期性变化,在实验中可以通过pH电极跟踪反应。振荡曲线可通过两个参数进行描述(图1(b)):周期(τ)为完成一次振荡循环所需时间;振幅(ΔpH)为振荡的最高点与最低点的pH差值。由于BSF体系的pH振荡行为具有对许多因素微扰的敏感性[11],因此,该实验为拓展实验内容提供了更多的可能性。不难理解,振荡现象是在一定条件下体系中各反应物种浓度在空间某处发生的特定行为。除体系的物质组成外,反应器结构、体系中各物种的浓度、反应温度、进样速率、搅拌速率、pH电极检测位置等因素均对pH振荡曲线产生影响。
为了解pH振荡的上述特性,本文主要介绍以下几方面实验内容:
(1)熟悉连续流动的振荡反应装置的基本组成及作用原理。
实验装置系统如图2所示。由于反应物混合程度直接影响反应,因而反应器的形状、进/出液口位置、进样速率、搅拌速率等皆影响pH振荡。特制反应器下部有4个进液口,上部有一出液口。将反应器置于恒温磁力搅拌器的液槽中,以保证反应在一定温度和搅拌下进行。用蠕动泵连续进样并控制进样速率,反应废液用恒流泵导出。反应液的pH变化用pH计连续检测,计算机实时采集数据。由于反应器中反应液混合程度的位置差异性,pH电极置于不同位置所测得的pH会有所差异。
(2)在间歇反应器中,测试正反馈和负反馈反应表观活化能,了解反应的热力学差异性。

图2 pH振荡实验装置系统示意图
升高温度可以缩短反应时间,加速振荡,缩短振荡周期。通过分别测定不同温度下正、负反馈反应相关物料从混合到pH恒定的相应时间tpos和tneg,用时间的倒数(1/t)表示反应速率常数k,以不同温度下的ln(1/tpos)和ln(1/tneg)分别对温度的倒数1/T作图,利用Arrhenius公式lnk=-Ea/RT+lnA中lnk与1/T间的线性关系,由直线斜率可分别求得正、负反馈反应的活化能,并获得温度对这两个反应的影响程度,有助于pH振荡曲线特征的解析。
(3)在间歇反应器和连续流动搅拌反应器中,分别测试体系pH随时间的变化,了解两种条件下振荡反应的差异性。
在间歇反应器中,由于没有新的反应物注入,随着反应物的不断消耗,体系最终达到化学平衡态,振荡随之消失。要获得较为持久的振荡行为,就必须使体系远离平衡态。连续流动搅拌反应器(continuous flow stirred tank reactor,CSTR)是解决该问题的最常用工具。在CSTR中,由于体系不断从外界补充反应物,从而始终保持远离平衡态,于是振荡可持续进行下去。
本实验通过考察给定条件下间歇反应器中以及CSTR中的pH振荡行为,了解这两种条件下振荡行为的差异,以理解远离平衡对产生振荡行为的积极意义,这也是研究pH振荡影响因素和拓展性应用的基础。
(4)在CSTR条件下,测试中性盐(如KCl或NaCl)对体系pH振荡周期和振幅的影响,分析电解质对pH振荡的影响机制。
BSF体系pH振荡是一个多反应偶合的复杂过程,主要涉及多种离子参与的氧化还原反应。这些反应是通过溶液中离子发生相互碰撞而实现的。介质中离子间的相互作用将减小离子间的有效碰撞,从而影响pH振荡反应。这种影响可以用电解质的原盐效应(primary salt effect)给予解释。对氧化还原反应而言,该效应可由下述方程[16]描述:

式中ZA和ZB代表反应物A、B所带电荷数,Ⅰ代表离子强度,k0代表外推至Ⅰ为0时的反应速率常数。该方程反映了反应速率对离子强度的依赖性。对于BSF体系而言,参与正反馈和负反馈反应的离子均带负电荷,因而离子强度的增大对正、负反馈反应均为正原盐效应,结果导致反应速率均加快,反应周期缩短。当电解质浓度过大时,振荡将会消失。
(5)掌握计算机自动化数据采集与数据处理的方法。
目前大多数pH计均有RS232接口,通过RS232接口与计算机连接,可实现测试数据的实时采集。除了商家提供的数据采集软件之外,也可以利用“串口调试助手”软件采集数据。本实验通过RS232接口将pH计与计算机连接,使用“串口调试助手”软件实时采集BSF体系的pH变化数据,并将数据导入Excel或Origin中,绘制pH随时间变化曲线,即pH振荡曲线。
3 仪器和试剂
仪器:PP-50型专业pH计,BT100-1L型高精度4通道蠕动泵,HL-2B型数显恒流泵,DF-101S集热式恒温加热磁力搅拌器。pH振荡反应的发生及检测装置如图2所示。其中CSTR为特制反应器(以标称体积为50 mL的烧杯制成,内径43 mm,下端4个进口,进口距杯底高度10 mm,相邻进口之间夹角90°;上端有一个出口,距离杯底高度41.5 mm),液体在烧杯中的保留体积为60 mL。
试剂:KBrO3、无水Na2SO3、K4[Fe(CN)6]·3H2O、浓H2SO4、KCl,均为分析纯。用二次蒸馏水分别配制:c(KBrO3)=0.26 mol·L-1,c(Na2SO3)=0.30 mol·L-1,c(K4[Fe(CN)6])=0.080 mol·L-1,c(H2SO4)=0.040 mol·L-1的储备液。储备液进入反应器的初始浓度为储备液浓度的1/4,即分别为:c(KBrO3)=0.065 mol·L-1,c(Na2SO3)=0.075 mol·L-1,c(K4[Fe(CN)6])=0.020 mol·L-1,c(H2SO4)=0.010 mol·L-1。
4 实验过程
4.1 正、负反馈反应表观活化能测试
在间歇反应器中,测试正反馈和负反馈反应的表观活化能。实验前开启pH计预热30 min,并标定pH电极,使pH检测系统处于待测状态。以50 mL烧杯为反应器,向其中先加入二次水、Na2SO3和H2SO4储备液各10 mL,搅拌并恒温至20℃后,再加入已20℃恒温的KBrO3储备液10 mL,同时记录pH,用计算机每隔15 s(或30 s)采集pH随时间(t)变化数据,绘制pH-t曲线,从中求出正反馈反应的平衡时间(tpos)。用同样方法分别获得25℃、30℃、35℃、40℃和45℃条件下对应的平衡时间。以不同温度下ln(1/tpos)对相应的温度倒数1/T作图,求得正反馈反应的表观活化能。用等体积的K4[Fe(CN)6]代替Na2SO3,用同样的实验方法可得到负反馈反应的表观活化能。
4.2 间歇反应器中pH-t曲线测试
在给定温度(如30℃)和搅拌速度(360 r/min)下,向50 mL烧杯中先加入Na2SO3、H2SO4、K4[Fe(CN)6]储备液各10 mL,待恒温后,再加入已恒温的KBrO3储备液10 mL,并同时记录体系pH变化,数据采集间隔为15 s或30 s,绘制pH-t曲线。
4.3 CSTR中pH振荡曲线测试
按照图2连接实验仪器。在给定温度(如30℃)和搅拌速度(360 r/min)下,向特制反应器中依次加入已恒温的Na2SO3、H2SO4、K4[Fe(CN)6]及KBrO3储备液各10 mL,然后用蠕动泵将4种储备液分别以给定速率(如1.21 mL·min-1)注入反应器中,溢出反应液由恒流泵从反应器上端支管导出。在蠕动泵进样的同时,开启pH检测系统记录体系pH变化,数据采集间隔为15 s或30 s。绘制pH-t曲线,并从振荡曲线中求出ΔpH和τ,指派振荡曲线中对应的正反馈和负反馈反应,分析这两个反应特点。
4.4 KCl对pH振荡的影响
以H2SO4储备液配制一定浓度的KCl溶液(如2 mol·L-1)代替原H2SO4储备液,其他反应条件及实验方法与4.3相同。测试体系相应的pH-t曲线,从振荡曲线中求出ΔpH和τ,并与4.3的实验结果进行比对分析。
5 注意事项
(1)振荡反应是一个复杂的竞争反应体系,在实验中必须要注意反应物加入顺序。同时,在每次实验前,应先调好pH检测系统状态,以便及时采集数据。
(2)Na2SO3溶液不稳定,最好现配现用,若放置3 h后则不应再使用[1],否则会影响振荡行为,甚至导致振荡无法产生;K4[Fe(CN)6]溶液最好提前一天配好,并保存于棕色瓶中,防止见光分解及氧化[17]。
(3)在CSTR中,必须严格控制温度、流速及搅拌速率等参数[18]。
(4)由于反应在空间上存在差异,实验中应固定pH电极位置。
6 思考题
(1)在活化能测试实验中,溶液加入顺序对测试结果有无影响?为什么?
(2)哪些因素会影响pH振荡行为?为什么?
(3)若向体系中加入有机弱酸盐,会对pH振荡产生怎样的影响?
(4)以本实验为基础,提出一个金属离子振荡实验的基本思路。
7 典型实验结果及相关说明
7.1 表观活化能测试的典型结果
BSH和BFH反应的典型pH-t曲线如图3所示,同样方法求得不同温度下两个反应达到平衡的时间tpos和tneg,并以ln(1/tpos)和ln(1/tneg)分别对1/T作图,根据曲线线性方程的斜率,求得两个反应的活化能分别为Epos=57.21 kJ·mol-1和Eneg=78.63 kJ·mol-1。活化能越小,反应速率越快,因而BSH反应比BFH反应更快。两个反应皆随温度的升高而加快,且温度对BSH反应的影响更大。
7.2 间歇反应器中体系的pH-t曲线
在间歇反应器中,BSF体系的pH-t曲线如图1(a)所示,即体系pH在经历了快速降低和缓慢升高后渐趋稳定,达到平衡态。图1(a)中pH变化曲线相当于图3(a)和图3(b)曲线的叠加,这显示出BSF体系是BSH和BFH反应的复合。由于BSH反应释放H+将减缓BFH消耗H+的速度,或BFH消耗H+减缓BSH产生H+的速度,因此,BSF体系pH达到平衡所需时间比同一温度下孤立的BSH和BFH反应时间的加和要长。
7.3 CSTR中的典型pH振荡曲线
在CSTR中,以本实验所列反应物浓度、温度(30℃)、流速(1.21 mL·min-1)、搅拌速度(360 r/min),获得如图1(b)所示的典型pH振荡曲线。在pH 3.3~6.6之间,BSF体系呈现持续、稳定的大幅pH振荡,其ΔpH=3.3,τ=17.5 min。
由于反应物浓度、温度、进样流速、搅拌速率、磁子的大小和形状、反应器的结构和尺寸、pH电极测试的位置等皆会影响测得的pH振荡行为,即影响振幅和周期,甚至振荡与否[18],因此,在实验中严格控制反应条件极其重要。固定其他条件,升高温度可使振幅和周期减小,增大流速将使振幅和周期增大,加快搅拌速率将使振幅和周期增大,但这3个参数过高或过低都可能使振荡消失。适当降低温度、增大流速、加快搅拌有利于产生长周期、大振幅的pH振荡。在本实验给定反应器及浓度下,产生pH振荡的条件为:温度25~36℃、流速1.2~2.0 mL·min-1、搅拌速率170~450 r/min。此外,医用输液器可代替蠕动泵进样,但由于其控制流速不够精准,实验重现性较差。
7.4 KCl对pH振荡的影响
当体系注入浓度为2 mol·L-1的KCl储备液时,pH振荡τ=10.25 min,ΔpH=3.2;当注入KCl储备液浓度为3 mol·L-1时,τ=9.58 min,ΔpH=3.0。与7.3部分结果相比,注入KCl可显著缩短振荡周期,且其浓度越大,pH振荡周期缩短越显著。NaCl具有与KCl相似的影响效应。
8 小结
本实验试剂易得,仪器简单,操作容易,实验现象明显,重现性好,学生实验兴趣浓厚。实验总学时为10~12学时。本实验将物理化学的实验原理、分析化学的实验方法以及计算机采集和处理数据相结合,实验内容丰富、综合性及拓展性强,有利于激发学生的实验兴趣和创新能力,对培养学生的综合科研能力有很大帮助。
[1]张媛媛.pH振荡和pH-Ca2+复合振荡反应研究:[学位论文].北京:首都师范大学,2009
[2]复旦大学.物理化学实验.第3版.北京:高等教育出版社,2006
[3]董小梅,刘剑波,徐功骅.大学化学,1996,11(2):35
[4]Luo Y,Epstein I R.J Am Chem Soc,1991,113(5):1518
[5]Poros E,Horváth V,Kurin-Csörgei K,et al.J Am Chem Soc,2011,133(18):7174
[6]Kurin-Csörgei K,Epstein I R,Orbán M.Nature,2005,433(1):139
[7]Liedl T,Simmel F C.Nano Lett,2005,5(10):1894
[8]Nabika H,Oikawa T,Iwasaki K,et al.J Phys Chem C,2012,116(10):6153
[9]Buyukcakir O,Yasar F T,Bozdemir O A,et al.Org Lett,2013,15(5):1012
[10]Tian E,Ma Y,Cui L,et al.Macromol Rapid Commun,2009,30(20):1719
[11]Edblom E C,Luo Y,Orbán M,et al.J Phys Chem,1989,93(7):2722
[12]Sato N,Hasegawa H H,Kimura R,et al.J Phys Chem A,2010,114(37):10090
[13]Melka R F,Olsen G,Beavers L,et al.J Chem Educ,1992,69(7):596
[14]刘艳君.化学振荡反应在氨基酸及药物测定中的应用:[学位论文].兰州:西北师范大学,2011
[15]Crook C J,Smith A,Jones R A L,et al.Phys Chem Chem Phys,2002,4(8):1367
[16]Castañeda-AgullóM,del Castillo L M,Whitaker J R,et al.J Gen Physiol,1961,44(6):1103
[17]Rábai G,Kustin K,Epstein I R.J Am Chem Soc,1989,111(11):3870
[18]杨珊,侯玉龙,胡道道.西北大学学报,2014,44(5):756

