合成生物学技术在糖胺聚糖生产中的应用
唐东洋,虞菊萍,陈荣,高向东
(中国药科大学生命科学与技术学院,江苏 南京 210009)
合成生物学技术在糖胺聚糖生产中的应用
唐东洋,虞菊萍,陈荣,高向东*
(中国药科大学生命科学与技术学院,江苏 南京 210009)
糖胺聚糖是一类直链酸性多糖,具有优良的生物相容性和生理活性,被广泛应用于临床治疗,并用作药物运输载体,其中透明质酸、肝素和硫酸软骨素的相关研究最为深入。由于传统方式(如动物组织提取法等)制备糖胺聚糖,存在外毒素、病毒等致病因子污染的风险,因而,利用合成生物学技术,构建重组工程菌株生产糖胺聚糖,逐渐受到研究者们的重视。主要围绕透明质酸、肝素前体及软骨素,综述糖胺聚糖的生物合成途径,并探讨产糖胺聚糖基因工程菌的构建以及糖胺聚糖生物合成过程中分子质量调控机制,以期为构建产高品质糖胺聚糖工程菌株提供新思路。
合成生物学;透明质酸;肝素前体;软骨素;基因工程菌
糖胺聚糖(glycosaminoglycan,GAG)也被称为黏多糖,是一类带负电荷的直链酸性多糖,大多是由糖醛酸和氨基己糖组成的二糖单元反复交联而形成[1]。GAG广泛存在于自然界中,是动物结缔组织间质和细胞间质的特有成分,也是某些病原微生物的细胞荚膜多糖成分。按照单糖组成及连接方式的差异,GAG可分为透明质酸(hyaluronic acid, HA)、肝素(heparin, Hep)、硫酸软骨素(chondroitin sulfate, CS)、硫酸皮肤素(dermatan sulfate, DS)和硫酸角质素(keratan sulfate, KS)(见表1)。

表1 常见GAG及其组成骨架结构Table1 Common GAGs and their backbone structures
GAG具有特殊的生理活性,其中HA、Hep及CS的相关研究最为深入[2]。目前,HA主要通过链球菌发酵产生[3],而Hep和CS主要通过动物组织提取法获得[4],但传统方法制得的GAG会给临床使用带来一定的安全风险。2008年的Hep污染事件就给人们敲响了警钟[5],
美国FDA因此制定了更严格的GAG生产及质量检测标准,也迫使研究者们寻找安全性更高的GAG生产方式。
已知的化学酶法合成策略已能实现对GAG的体外合成,这一度被认为是GAG传统制备方式的替代手段。然而,受制于单糖前体的高昂价格,该法目前只能用于小批量GAG寡糖的合成,尚暂时无法在工业上进行大规模应用[6]。早期的研究已证实,大肠埃希菌K4及F型禽多杀性巴氏杆菌的荚膜多糖含有软骨素[7-8],大肠埃希菌K5及A、D、F型禽多杀性巴氏杆菌的荚膜多糖含有Hep前体Heparosan[4],并且软骨素及Heparosan经过化学修饰,即可成为CS及Hep。得益于合成生物学的发展及GAG生物合成途径的揭示,使用工业安全微生物作为宿主构建重组工程菌进行GAG生产成为了可能。而且,利用合成生物学技术制备的GAG可避免病毒等致病因子的污染,由此可显著提高产品使用的安全性;这种技术方法还具有易于进行放大生产的优点,因而逐渐成为GAG传统生产方法的更为现实可行的替代手段。本文主要围绕HA、Heparosan及软骨素,综述GAG的生物合成途径,并探讨产GAG基因工程菌的构建以及GAG生物合成过程中分子质量调控机制,以期为构建产高品质GAG工程菌株提供新思路。
1 糖胺聚糖的生物合成途径
GAG作为多种病原菌的细胞荚膜多糖成分,其生物合成过程可分为3个步骤:①前体单糖分子的产生;②GAG链的聚合延伸;③新生GAG长链转移至细胞膜外[1]。目前,已有多种不同生物来源的GAG及其合成酶被成功鉴定(见表2)。

表2 天然微生物来源的常见GAG及其合成酶Table2 Common GAGs and their synthetase from natural microbial sources
1.1 透明质酸的生物合成
HA是由GlcNAc和GlcUA通过β-1,4和β-1,3糖苷键而组成的酸性黏多糖,其中两种单糖均来源于葡萄糖代谢通路,HA的生物合成过程包括10步反应(见图1-1)。HA合成酶(HAS)是促使二磷酸尿苷(UDP)-GlcUA 与UDP-GlcNAc进行聚合反应的执行者,目前已发现两类HAS,其中Ⅰ型HAS共有3种来源,即来源于细菌的HAS(sphasA、sehasA等)、来源于病毒的HAS(cvHAS)及来源于脊椎动物的HAS(xlHAS1、mmHAS等),但是仅有1种Ⅱ型HAS被发现,即来源于A型禽多杀性巴氏杆菌的HAS(PmHAS)。这两类HAS的区别在于酶的大小、拓扑结构、合成方向及催化合成方式的不同[9]。
1.2 肝素前体的生物合成
Heparosan是由GlcNAc 与GlcUA通过α-1,3和β-1,4糖苷键连接而形成[10],与HA生物合成过程的唯一差别在于糖链聚合及延伸的执行者不同(见图1-1)。Heparosan是大肠埃希菌K5及A、D、F型禽多杀性巴氏杆菌的荚膜多糖成分,目前发现有两种不同类型微生物来源的Heparosan合成酶。在大肠埃希菌K5中,需要GlcUA转移酶KfiC及GlcNAc转移酶KfiA共同作
用,以完成Heparosan糖链组装,而在禽多杀性巴氏杆菌中,只需单一Heparosan合成酶,即可完成糖链组装过程,此酶包括来源于D型禽多杀性巴氏杆菌的PmHS1或存在于A、D、F型禽多杀性巴氏杆菌中的PmHS2[7]。虽然PmHS1与 PmHS2具有很高的序列同源性(约65%),但却表现出完全不同的金属离子偏爱性、底物单糖分子亲和力及催化合成能力[4]。也有研究认为,PmHS1主要负责大分子质量Heparosan的合成,而PmHS2负责小分子质量Heparosan的合成[11]。
1.3 软骨素的生物合成
组成软骨素的两种单糖为GlcUA和GalNAc。因此,不同于HA或Heparosan的生物合成过程,软骨素合成需要经历UDP-GlcNAc转换至UDP-GalNAc的过程,随后软骨素合成酶催化糖链的聚合反应[12](见图1-2)。目前发现有两种微生物来源的软骨素合成酶,分别为来源于大肠埃希菌K4的KfoC及来源于F型禽多杀性巴氏杆菌的PmCS[4]。KfoC与PmCS具有约60%的同源性,因而推断这两种酶催化多糖合成的方式相似[7]。
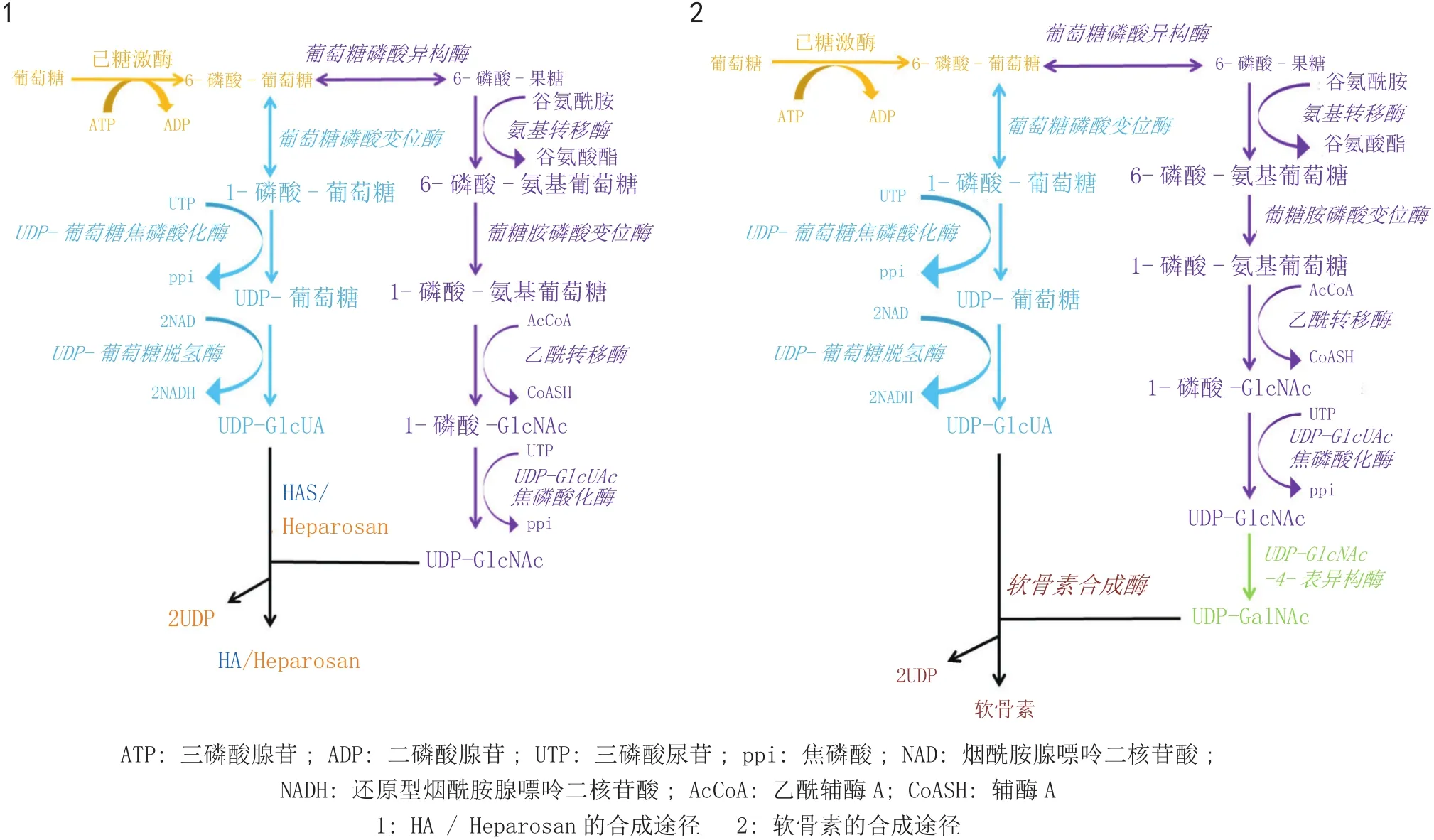
图1 GAG生物合成途径示意图Figure 1 Schematic diagram of biosynthetic pathways for GAGs
2 产糖胺聚糖基因工程菌的构建
目前,临床使用的GAG主要来源于动物组织,而为扩展GAG的来源,并提高GAG临床使用的安全性,工业安全微生物被选作表达宿主,用于构建产GAG重组菌株,以期创造出一种安全性高及生产成本更具优势的GAG生产方式。
2.1 产透明质酸工程菌
由于微生物来源的HA与生物体内的HA结构一致,因此HA成为研究者们最早利用合成生物学技术进行生产尝试的GAG。目前,已有多种微生物经成功改造而具备HA生产能力,如大肠埃希菌(Escherichiacoli)、枯草芽孢杆菌(Bacillus subtilis)、毕赤酵母(Pichia pastoris)、土壤农杆菌(Agrobacterium sp.)及乳酸乳球菌(Lactococcus lactis)等。值得注意的是,产HA基因工程菌的构建策略和培养方式的不同造成了HA产量及分子质量的巨大差异。
2.1.1 大肠埃希菌工程菌Yu等[13]以大肠埃希菌Top10作为宿主,将Ⅰ型HAS基因sphasA和sehasA与HA前体合成关键基因分别组合构建表达载体,由此构建的spABC(sphasA/ugd/galF)菌株其HA产量可达48 mg·L-1,而sseAB(sehasA/ugd)菌株的HA产量可达200 mg·L-1,明显高于spABC菌株产量,表明sehasA
具备更强的HA合成能力。而且,分子质量测定结果显示,sseAB菌株在不同生长条件下可获得相对分子质量为3.5×105~1.9×106的HA,表明菌株培养环境条件的改变会对所产HA的分子质量造成较大影响。Mao等[14]尝试将Ⅱ型HAS基因PmHAS和来自大肠埃希菌K5的尿苷二磷酸葡萄糖脱氢酶基因KfiD共转入大肠埃希菌JM109,并采用补料分批发酵方式,致使此基因工程菌可产2.0~3.8 g·L-1的HA,且增加前体单糖的供应,可有效提高HA产量。Ⅰ和Ⅱ型HAS在大肠埃希菌中的成功表达及高品质HA的获得,表明大肠埃希菌可作为一种潜在宿主通过基因改造而成为能满足HA工业化生产需求的工程菌株,并因此有望产出具特定分子质量的HA。
2.1.2 枯草芽孢杆菌工程菌Widner等[15]将sehasA与HA前体合成相关酶基因构建表达载体,在枯草芽孢杆菌A164Δ5菌株中重构HA代谢通路,这是研究者们首次在异源宿主中实现HA的表达,并且证明UDPGlcUA合成途径的关键酶基因tuaD的过表达有利于HA的积累。该研究小组所筛选出的RB184 (sehasA/tuaD)菌株其HA产量为0.8~1.0 g·L-1,所产HA相对分子质量可达1.1×106~1.2×106,该菌株已被Novozymes公司成功用于工业生产。然而,在生产过程中,HA的积累会造成发酵液黏度急剧增加,故而氧传递效率成为制约HA产量提升的关键。Chien等[16]尝试在过表达sehasA及tuaD的工程菌株中引入透明颤菌血红蛋白(vitreoscilla hemoglobin,vhb),该蛋白可在氧浓度极低的条件下从细胞外摄取氧,从而维持细胞正常生理过程。结果发现,vhb过表达的菌株细胞密度相较不含vhb的菌株增加了25%,HA的产量提升了2倍,达到1.8 g·L-1。
为了探究HA分子质量的调节机制,以获得均一分子质量HA,Jia等[17]将HAS基因PmHAS与HA前体合成关键酶基因分别构建于不同表达载体,创新性地通过两步诱导策略调控基因表达,成功实现了对HA分子质量调控。由此制备的工程菌株TPG223(PmHAS/ tuaD/gtaB)其HA产量可达6.8 g·L-1,并且通过诱导策略的改变,可获得相对分子质量分别为8×103和5.4×106且分子质量均一的HA,为工业化生产均一分子质量HA,提供了全新的思路。从目前的研究成果来看,在众多经改造而用于HA生产的微生物宿主中,枯草芽孢杆菌可被誉为构建工程菌株的最佳宿主。
2.1.3 毕赤酵母工程菌Jeong等[18]克隆了来自非洲爪蟾(Xenopus laevis)的HAS基因xhasA2和xhasB以及来自毕赤酵母的HAS基因hasC、hasD及hasE,并将这些基因以不同的组合方式构建组成型或诱导型表达载体。由此制备的毕赤酵母工程菌株其HA产量可达0.8~1.7 g·L-1,所产HA的相对分子质量在1.2×106左右。另外,该研究团队还发现,降低菌株培养温度或HAS表达水平,可使得所产HA的相对分子质量从1.2×106增至2.5×106或2.1×106。这一研究首次将来源于真核生物的HAS用于HA生产,而重组毕赤酵母表达系统的成功构建,也为HA生产方式提供了新的选择。
2.1.4 土壤农杆菌工程菌Mao等[19]在土壤农杆菌ATCC 31749菌株中成功表达了PmHAS以及来自大肠埃希菌K5的UDP-葡萄糖脱氢酶基因,由此构建的重组菌其HA产量可达0.3 g·L-1,所产HA的相对分子质量在7×105~2×106之间。这是土壤农杆菌首次被用于产HA工程菌株的构建。尽管从结果来看,土壤农杆菌工程菌株的HA产量还有待提高,但由于其为公认的食品级安全微生物宿主,故而可以进一步研究提高其HA产量的策略,为工业化应用打下坚实的基础。
2.1.5 乳酸乳球菌工程菌Prasad等[20]将sehasA与hasB、hasC组合后引入乳酸乳球菌NZ9000菌株,结果,所构建的pSJR2菌株(sehasA/hasB)其HA产量为107 mg·L-1,pSJR3菌 株(sehasA/hasB/hasC) 的HA产量为234 mg·L-1,表明UDP-GlcUA水平的高低是影响HA产量的关键因素。与枯草芽孢杆菌只需过表达hasB即可保证HA高表达[15]不同,在乳酸乳球菌中需同时过表达hasB及hasC才能实现HA产量最大化。在此基础上,Prasad等[21]又构建了pSJR6菌株(sehasA/ hasB/hasD),结果发现,与pSJR2及pSJR3菌株相比,pSJR6菌株具有最高的HA产率,表明,共表达UDPGlcUA与UDP-GlcNAc通路关键酶基因,使前体单糖达到适当比例,能给HA的生产带来最大益处。鉴于HA的分子质量会极大地影响其应用范围,研究者将HA表达相关基因整合入乳酸乳球菌基因组,结果,相较于质粒表达系统,由此产生的HA相对分子质量由2×106增至3.5×106~4×106[22],这为高分子质量HA的获取提供了新来源。Sheng等[23]采用lacF基因作为筛选标志,过表达hasA、hasB及hasC的菌株其HA产量可达(0.594±0.029)g·L-1。提示,尽管这类菌株其HA产
量还有待提高,但是非抗性筛选标志将有助于其在工业上的应用。
2.2 产肝素前体工程菌
Heparosan经修饰可成为Hep,因此通过微生物发酵生产Heparosan并加之特定化学修饰的策略,可视为传统Hep生产方法的一种替代手段。目前研究者们只是在大肠埃希菌作为宿主的表达系统中实现了Heparosan的合成,其中Barreteau等[24]成功将来源于大肠埃希菌K5的Heparosan合成酶基因KfiA、KfiB、KfiC及KfiD转入大肠埃希菌K12中,由于大肠埃希菌K12缺少Heparosan转运系统,因此该合成系统所生产的Heparosan主要集中在细胞内,补料分批发酵条件下的产量可达1 g·L-1;此外,通过在该系统中共表达K5裂解酶,可获得聚合度2-10(DP2-10)的Heparosan寡糖分子且产量接近1 g·L-1。虽然通过该系统可获得低分子质量Heparosan及其寡糖,但其胞内表达会给下游分离纯化带来很大困难。因此, Zhang等[25]尝试在大肠埃希菌BL21 StarTM(DE3)中构建Heparosan合成通路,结果,在恒定溶氧补料分批发酵方式下,由此制备的sABCD(KfiA/KfiB/KfiC/KfiD)菌株实现了Heparosan的胞外分泌,其产量可达1.88 g·L-1。该项研究为Heparosan的工业化生产提供了优良的生产菌株,并且为采用其他类型宿主构建Heparosan高产工程菌株提供了依据。随着生物合成系统中Heparosan产量的不断提升以及Heparosan修饰工艺的引入,可实现为临床提供非动物组织来源的Hep,也必将极大地提高Hep的品质及其临床使用安全性。
2.3 产软骨素工程菌
得益于HA和Heparosan生物合成系统的成功建立,研究者们又开展了对另一种重要GAG——软骨素的生物合成系统研究,以期采用合成生物学技术创造出一种全新的软骨素生产方式。
2.3.1 枯草芽孢杆菌工程菌20世纪90年代,DeAngelis(Biochemistry, 1996年)便报道了一种在枯草芽孢杆菌中实现PmCS表达的方法,并在专利中提供了重组枯草芽孢杆菌发酵生产软骨素的方法。虽然该专利中未见提及软骨素的具体产量,但是该研究成果为后续利用工业安全微生物构建软骨素生产菌株提供了很好的思路。
2.3.2 大肠埃希菌工程菌He等[12]首次在大肠埃希菌BL21 StarTM(DE3)中实现了软骨素的合成,该研究团队将软骨素合成酶基因KfoA、KfoC及KfoF以不同的顺序组合到仿操纵子体系中后发现,当KfoF、KfoA和KfoC表达分别处于高、中、低水平时,采用补料分批发酵此工程菌株所获软骨素的产量达2.4 g·L-1,接近大肠埃希菌K4的生产水平。这给予研究者们极大的鼓舞,相信随着软骨素转运机制的揭示及对工程菌株发酵过程的优化,软骨素生物合成产量有望得到进一步提高。这项研究成果不仅扩大了CS的来源,而且有助于降低CS生产成本。此外,可在工程菌株中共表达硫酸化酶,从而能同步将软骨素修饰成为具有活性的CS。
3 糖胺聚糖生物合成过程中分子质量调控机制
多糖聚合度的差异会导致分子质量不同,进而影响其活性,GAG家族尤为如此。研究表明,高分子质量HA具有抗炎活性,而低分子质量HA却能促进炎症发生[26]。此外,可用作药物运输载体的GAG分子大多集中于小分子质量范围,如低分子质量的HA[27]及肝素或Heparosan寡糖[28]。可见,临床需要生产特定分子质量的GAG,以提高其药效及安全性,因此有必要探讨GAG生物合成过程中其分子质量的调控机制。目前,研究者对HA生物合成过程中其分子质量的影响因素有了较为深入的认识,而对于Heparosan或软骨素的分子质量调控机制尚未见报道。因此,这里主要探讨HA生物合成过程中其分子质量的调控机制,期望为其他GAG生物合成过程中分子质量调控机制的研究提供借鉴。
3.1 菌株培养条件
HA在生物合成过程中需要与产HA菌株生长相互竞争底物及高能分子,因此其合成必定会受到菌株培养条件的影响。Armstrong等(Appl Environ Microbiol, 1997年)考察了链球菌发酵过程中pH、初始葡萄糖浓度和培养温度对所产HA分子质量的影响,结果发现,发酵液在pH 6.3~8.0范围内时,pH的变化不会影响所产HA的分子质量,而葡萄糖浓度的增加或培养温度的降低则有利于高分子质量的HA产生。培养温度降低致使所产HA分子质量增加的效应源于菌株生长速率下降而导致更多的前体糖被用于HA合成,该结论在重组工程菌中同样成立[18]。
Sun等[29]研究证实,在产HA菌株发酵液中加入磷脂酰胆碱,可使所产HA的分子质量提高67.1%。这是因为,磷脂酰胆碱能增加HA合成通路的代谢流量,
并且能提高细胞膜流动性,使得HA长链能轻易通过细胞膜。Pires等[30]在研究中发现,产HA菌株发酵液中Na+的加入有利于获得高分子质量HA,表明HA分子质量受菌株发酵液中金属离子种类的影响。另外,产HA菌株发酵液的搅拌速率也会对所产HA分子质量造成很大影响:在低搅拌速率范围内,提高搅拌速率,可增加发酵液溶氧水平,从而提高HA分子质量;但继续增大搅拌速率,则会造成HA分子质量降低。这主要是由于过大的剪切力造成HA链提前脱落,并且搅拌速率过高会增加发酵液中活性氧水平,进而降低HA分子质量[31]。
产HA菌株培养时间的长短对HA分子质量的影响同样令人关注。Armstrong等(Appl Environ Microbiol, 1997年)研究发现,链球菌所产HA分子质量与其培养时间呈现一定的正相关性。Yu等[13]在对重组大肠埃希菌菌株的研究中也得出类似结论。但毕赤酵母所产HA分子质量并不受其培养时间的影响[18]。另外,Jia等[17]在研究中发现,基于枯草芽孢杆菌构建的TPG223菌株所产HA分子质量与其培养时间却呈现出一定的负相关性,因而需进一步考察并明确菌株培养时间对所产HA分子质量的影响。
基于以上的研究成果,Lai等[32]采用氧运输载体及最优的搅拌速率,在兽疫链球菌(Streptococcus zooepidemicus)中获得相对分子质量高达1.54×107的HA。表明,产HA菌株在合适的培养条件下,可产出高分子质量的HA。
3.2 菌株中UDP-GlcUA与UDP-GlcNAc的比例
Marcellin研究小组发现,含有质粒的工程菌相对于野生菌株,能产生更大分子质量的HA,这是由于质粒的引入能促进UDP-乙酰氨基葡萄糖焦磷酸酶(glmU)的表达,并降低UDP-N-乙酰葡糖胺烯醇丙酮转移酶(murA)的表达,进而提高菌株中UDP-GlcNAc的水平,表明菌株所产HA分子质量与菌株中UDP-GlcNAc浓度密切相关[33-34]。Chen等[35]就菌株中UDP-GlcNAc对所产HA分子质量的影响程度进行了研究,结果发现,发酵液中加入葡萄糖胺,可显著提高菌株中UDPGlcNAc浓度,但产生的HA其分子质量较小,这是由于UDP-GlcNAc浓度升高,加剧了两种前体之间的比例不协调。利用基因工程手段,致使产HA菌株过表达UDP-GlcNAc通路相关基因后,同样也可得到类似结论。这些研究结果表明,在一定范围内提高菌株中UDPGlcNAc的浓度,能够提高HA的分子质量,但UDPGlcNAc浓度升至一定限度时,这种效应便不再存在。Sheng等[36]的研究也证实,产HA菌株中HAS与UDP-葡萄糖脱氢酶的mRNA比例发生变化,会影响UDPGlcUA与UDP-GlcNAc的比例,进而对所产HA分子质量产生显著影响。基于此,有研究者成功设计出可产高分子质量HA的重组工程菌株[37]。
3.3 透明质酸合成酶的特性
在HA生物合成过程中,HAS可独立完成HA双糖分子的组装。由于HAS有诸多来源,而不同来源的HAS各有其特性,因此采用不同来源的HAS或对HAS进行特定的改造,就有可能生产出不同分子质量的HA。
Pummill等[38]对源于哺乳动物的HAS——xlHAS1进行突变研究,结果发现,该酶发生S77F、S77I、C117S和C239S的突变后,由其催化合成的HA分子质量增加,而发生S77A、S77D、S77V、S77Y/R271G或Y107F的突变后,则并不影响其催化合成的HA分子质量,但发生S77T和C337S的突变后,却会引起其催化合成的HA分子质量降低。Kumari等[39]将sehasA中两个保守的极性氨基酸进行突变,即使48位的赖氨酸发生K48R和K48E突变以及327位的谷氨酸发生E327Q、E327K和E327D突变,然后分别构建了含有单突变及双突变(E327K/ K48E)的sehasA,并对其催化产物的分子质量进行研究。结果发现,突变之后的sehasA酶活力相较于野生型酶均有一定程度的下降,由此造成催化产物分子质量的降低。对来源于鼹鼠的HAS分析发现,虽然该酶中有两个天冬酰胺突变为丝氨酸,但它却能催化生产出分子质量高达1.2×107的HA[26]。目前的研究表明,HAS分子与其催化产物分子之间的相互作用强度会影响HA链的结合及延伸,进而影响HA的分子质量。提示,可以通过一定手段对HAS进行定向改造,从而收获特定分子质量的HA。
4 结语
随着人们健康意识的提升以及临床对于高品质GAG的需求增加,传统生产方式(如动物组织提取法等)所制得的GAG已不能满足现今的需要,这一现状促使
研究者们不断开发新的GAG生产方式。目前,利用合成生物学技术及理念构建微生物细胞工厂,进行大宗化学品、天然产物等的生产,已成为研究热点,其中很多产品已实现产业化生产,且创造了可观的经济价值。受此启发,利用重组工程菌株生产GAG的研究也在积极展开,研究者们开发设计了一系列重组生物生产系统用于GAG的生产,并尝试对其产量及分子质量进行调控,且已取得丰硕成果。当然,还有一些亟待解决的问题,如生物合成的Heparosan及软骨素需经后续修饰才能成为活性形式,不过可尝试利用合成生物学技术,将参与修饰反应的酶引入GAG合成系统,以解决此问题,进而收获活性形式的GAG。此外,GAG产量及分子质量的调控机制仍未被完全揭示,这也可通过合成生物学加之相关学科如系统生物学等的发展,予以进一步探究。可以相信,在不久的将来,利用重组工程菌株生产GAG的方式必将取代传统的动物组织提取法,这将极大地提高GAG的使用安全性,并降低其生产成本,最终为患者带来福音。
[1]DeAngelis P L.Glycosaminoglycan polysaccharide biosynthesis and production: today and tomorrow[J].Appl Microbiol Biot, 2012, 94(2):295-305.
[2]Miller T, Goude M C, McDevitt T C,et al.Molecular engineering of glycosaminoglycan chemistry for biomolecule delivery[J].Acta Biomater, 2014, 10(4): 1705-1719.
[3]Yoshimura T, Shibata N, Hamano Y,et al.Heterologous production of hyaluronic acid in an-poly-L-lysine producer,Streptomyces albulus[J].Appl Environ Microbiol, 2015, 81(11): 3631-3640.
[4]Chavaroche A A, van den Broek L A, Eggink G.Production methods for heparosan, a precursor of heparin and heparan sulfate[J].Carbohyd Polym, 2013, 93(1): 38-47.
[5]Kishimoto T K, Viswanathan K, Ganguly T,et al.Contaminated heparin associated with adverse clinical events and activation of the contact system[J].N Engl J Med, 2008, 358(23): 2457-2467.
[6]DeAngelis P L, Liu J, Linhardt R J.Chemoenzymatic synthesis of glycosaminoglycans: re-creating, re-modeling and re-designing nature's longest or most complex carbohydrate chains[J].Glycobiology, 2013, 23(7): 764-777.
[7]Mikami T, Kitagawa H.Biosynthesis and function of chondroitin sulfate[J].Biochim Biophys Acta, 2013, 1830(10): 4719-4733.
[8]Cimini D, De Rosa M, Carlino E,et al.Homologous overexpression of RfaH inE.coliK4 improves the production of chondroitin-like capsular polysaccharide[J].Microb Cell Fact, 2013,12: 46.
[9]Weigel P H, DeAngelis P L.Hyaluronan synthases: a decade-plus of novel glycosyltransferases[J].J Biol Chem, 2007, 282(51): 36777-36781.
[10]Wang Z, Dordick J S, Linhardt R J.Escherichia coliK5 heparosan fermentation and improvement by genetic engineering[J].Bioeng Bugs, 2011, 2(1): 63-67.
[11]Otto N J, Green D E, Masuko S,et al.Structure/function analysis ofPasteurella multocidaheparosan synthases: toward defining enzyme specificity and engineering novel catalysts[J].J Biol Chem, 2012, 287(10): 7203-7212.
[12]He W, Fu L, Li G,et al.Production of chondroitin in metabolically engineeredE.coli[J].Metab Eng, 2015, 27: 92-100.
[13]Yu H, Stephanopoulos G.Metabolic engineering ofEscherichia colifor biosynthesis of hyaluronic acid[J].Metab Eng, 2008, 10(1): 24-32.
[14]Mao Z, Shin H D, Chen R.A recombinantE.colibioprocess for hyaluronan synthesis[J].Appl Microbiol Biotechnol, 2009, 84(1): 63-69.
[15]Widner B, Behr R, Von Dollen S,et al.Hyaluronic acid production inBacillus subtilis[J].Appl Environ Microbiol, 2005, 71(7): 3747-3752.
[16]Chien L J, Lee C K.Enhanced hyaluronic acid production inBacillus subtilisby coexpressing bacterial hemoglobin[J].Biotechnol Prog, 2007, 23(5): 1017-1022.
[17]Jia Y, Zhu J, Chen X,et al.Metabolic engineering of Bacillus subtilis for the effcient biosynthesis of uniform hyaluronic acid with controlled molecular weights[J].Bioresour Technol, 2013, 132: 427-431.
[18]Jeong E, Shim W Y, Kim J H.Metabolic engineering ofPichia pastorisfor production of hyaluronic acid with high molecular weight[J].J Biotechnol, 2014, 185: 28-36.
[19]Mao Z, Chen R R.Recombinant synthesis of hyaluronan byAgroba-
cterium sp[J].Biotechnol Prog, 2007, 23(5): 1038-1042.
[20]Prasad S B, Jayaraman G, Ramachandran K B.Hyaluronic acid production is enhanced by the additional co-expression of UDP-glucose pyrophosphorylase inLactococcus lactis[J].Appl Microbiol Biotechnol, 2010, 86(1): 273-283.
[21]Prasad S, Ramachandran K B, Jayaraman G.Transcription analysis of hyaluronan biosynthesis genesin Streptococcus zooepidemicusand metabolically engineeredLactococcus lactis[J].Appl Microbiol Biotechnol, 2012, 94(6):1593-1607.
[22]Hmar R V, Prasad S B, Jayaraman G,et al.Chromosomal integration of hyaluronic acid synthesis (has) genes enhances the molecular weight of hyaluronan produced inLactococcus lactis[J].Biotech J, 2014, 9(12):1554-1564.
[23]Sheng J, Ling P, Wang F.Constructing a recombinant hyaluronic acid biosynthesis operon and producing food-grade hyaluronic acid inLactococcus lactis[J].J Ind Microbiol Biotechnol, 2015, 42(2): 197-206.
[24]Barreteau H, Richard E, Drouillard S,et al.Production of intracellular heparosan and derived oligosaccharides by lyase expression in metabolically engineeredE.coliK-12[J].Carbohyd Res, 2012, 360: 19-24.
[25]Zhang C, Liu L, Teng L,et al.Metabolic engineering ofEscherichia coliBL21 for biosynthesis of heparosan, a bioengineered heparin precursor[J].Metab Eng, 2012, 14(5): 521-527.
[26]Tian X, Azpurua J, Hine C,et al.High-molecular-mass hyaluronan mediates the cancer resistance of the naked mole rat[J].Nature, 2013, 499(7458): 346-349.
[27]Camacho K M, Kumar S, Menegatti S,et al.Synergistic antitumor activity of camptothecin-doxorubicin combinations and their conjugates with hyaluronic acid[J].J Control Release, 2015, 210: 198-207.
[28]Wei Z, Deakin J A, Blaum B S,et al.Preparation of heparin/heparan sulfate oligosaccharides with internal N-unsubstituted glucosamine residues for functional studies[J].Glycoconjugate J, 2011, 28(8/9): 525-535.
[29]Sun J, Wang M, Chen Y,et al.Understanding the influence of phosphatidylcholine on the molecular weight of hyaluronic acid synthesized byStreptococcus zooepidemicus[J].Appl Biochem Biotech, 2012, 168(1): 47-57.
[30]Pires A M, Eguchi S Y, Santana M H.The infuence of mineral ions on the microbial production and molecular weight of hyaluronic acid[J].Appl Biochem Biotech, 2010, 162(8): 2125-2135.
[31]Zhang X, Duan X J, Tan W S.Mechanism for the effect of agitation on the molecular weight of hyaluronic acid produced byStreptococcus zooepidemicus[J].Food Chem, 2010, 119(4): 1643-1646.
[32]Lai Z W, Rahim R A, Ariff A B,et al.Biosynthesis of high molecular weight hyaluronic acid byStreptococcus zooepidemicususing oxygen vector and optimum impeller tip speed[J].J Biosci Bioeng, 2012, 114(3):286-291.
[33]Chen W Y, Marcellin E, Hung J,et al.Hyaluronan molecular weight is controlled by UDP-N-acetylglucosamine concentrationin Streptococcus zooepidemicus[J].J Biol Chem, 2009, 284(27):18007-18014.
[34]Marcellin E, Chen W Y, Nielsen L K.Understanding plasmid effect on hyaluronic acid molecular weight produced byStreptococcus equi subsp.zooepidemicus[J].Metab Eng, 2010, 12(1): 62-69.
[35]Chen W Y, Marcellin E, Steen J A,et al.The role of hyaluronic acid precursor concentrations in molecular weight control inStreptococcus zooepidemicus[J].Mol Biotechnol, 2014, 56(2):147-156.
[36]Sheng J Z, Ling P X, Zhu X Q,et al.Use of induction promoters to regulate hyaluronan synthase and UDP-glucose-6-dehydrogenase ofStreptococcus zooepidemicusexpression in Lactococcus lactis: a case study of the regulation mechanism of hyaluronic acid polymer[J].J Appl Microbiol, 2009, 107(1): 136-144.
[37]Badle S S, Jayaraman G, Ramachandran K B.Ratio of intracellular precursors concentration and their flux influences hyaluronic acid molecular weight inStreptococcus zooepidemicusand recombinantLactococcus lactis[J].Bioresour Technol, 2014,163: 222-227.
[38]Pummill P E, DeAngelis P L.Alteration of polysaccharide size distribution of a vertebrate hyaluronan synthase by mutation[J].J Biol Chem, 2003, 278(22): 19808-19814.
[39]Kumari K, Baggenstoss B A, Parker A L,et al.Mutation of two intramembrane polar residues conserved within the hyaluronan synthase family alters hyaluronan product size[J].J Biol Chem, 2006, 281(17):11755-11760.
Application of Synthetic Biology Technologies in Glycosaminoglycan Production
TANG Dongyang, YU Juping, CHEN Rong, GAO Xiangdong
(School of Life Science and Technology, China Pharmaceutical University, Nanjing 210009, China)
Glycosaminoglycans(GAGs), one class of unbranched acidic polysaccharides with superior biocompatibility and physiological activity, have been widely used in clinic and as the carriers for drug delivery, among which hyaluronic acid, heparin and chondroitin sulfate have been most intensively studied.Allowing for the risk of the pollution of pathogenic factors such as exotoxin, virus and so on being brought in by conventional means for GAG production such as extraction from animal tissue, the construction of recombinant engineered strains for GAG production by utilizing synthetic biology technologies has been arousing great interest among scientists.Taking hyaluronic acid, heparosan and chondroitin as examples, this review focused on the biosynthetic pathways for GAGs, the constructions of genetically engineered strains producing GAGs and the mechanisms controlling molecular weight in biosynthesis of GAGs, with a view to providing new insights for the construction of genetically engineered strains producing high-quantity GAGs.
synthetic biology; hyaluronic acid; heparosan; chondroitin; genetically engineered strain
Q538; Q782
A
1001-5094(2015)05-0376-08
接受日期:2015-04-10
项目资助:国家“重大新药创制”科技重大专项资助项目(No.2012ZX09502001-004);江苏高校优秀科技创新团队资助项目
*通讯作者:高向东,教授;
研究方向:生物大分子结构与功能;
Tel:025-83271298; E-mail:xdgao@cpu.edu.cn

