宫颈癌术后患者临床预后影响的多因素分析*
姜光瑶 赵志伟 吴江 郭鹏
(1.四川大学华西第四医院,四川 成都 610041;2.四川大学华西基础医学与法医学院,四川 成都 610041)
宫颈癌是女性常见的恶性肿瘤,占所有女性恶性肿瘤发病的13%。我国宫颈癌发病率为12.96/10万,累积率(0~74 岁)为0.89%,平均每年新发病例11万以上,每年约有2~3万女性死于宫颈癌[1,2]。而目前宫颈癌发病的机制尚不明晰。有研究认为,HPV、人工流产次数、性伴侣、被动吸烟、丈夫包皮过长、宫颈肿瘤家族史、早婚、精神创伤、结婚次数、吸烟、多产及初产年龄过早可增加宫颈癌发病的危险[3~6]。鉴于宫颈癌的危险性较大,本研究结合我院临床宫颈癌患者病理资料,分析对宫颈癌临床预后存在的影响因素,以更好地评估患者临床预后,制定随访方案,进而给予相关患者早期干预。
1 资料和方法
1.1 一般资料 本研究针对2010年1月~2014年12月在我院住院手术治疗的宫颈癌患者,筛选病理资料、随访资料均完整的患者纳入分析。共纳入病理资料及随访完整的有效宫颈癌患者168例,年龄19~64岁,平 均(38.9±11.0)岁,其 中≤40 岁 的95 例(56.5%),>40岁的73例(43.5%);患者1年累计生存率为95.2%,3年累计生存率为62.8%,5年累计生存率为54.7%。
1.2 研究方法 收集指标包括患者年龄、肿块直径、肿瘤分化程度、肿瘤分期、有无浸润或淋巴结转移、FIGO 分期、人类乳头瘤病毒(HPV)检测及生存状态等。患者病理资料:肿块直径1~7.2cm,平均(3.3±1.46)cm,≤4cm 的113 例(67.3%),>4cm 的55 例(32.7%);病理类型:鳞癌106例(63.1%),腺癌57例(33.9%),其 他5 例(3%);分化程度:低分化43 例(25.6%),中分化71 例(42.3%),高分化54 例(32.1%);肿瘤分期:Ⅰ期67 例(39.9%),ⅡA 期80例(47.6%),ⅡB 期21例(12.5%);有肿瘤浸润者71例(42.3%),有淋巴结转移者60例(35.7%),HPV 感染阳性者66例(39.3%)。随访工作以患者确诊宫颈癌后开始,通过电话、门诊复查、病友会等多种方式对患者进行随访,按照统一的随访表记录患者情况。宫颈癌临床预后影响因素的8项指标赋值见表1。

表1 宫颈癌临床预后影响因素的指标赋值Table 1 Assignment on the prognostic factors of cervical cancer for COX regression analysis
1.3 统计学分析 采用SPSS 17软件对数据进行统计分析,单因素方差分析采用χ2检验,多因素分析采用COX 回归分析,采用寿命表计算累计生存率,采用Kaplan-Meier法绘制生存曲线,选用Logrank检验对不同指标类别的生存率进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 单因素方差分析 结果显示,除病理类型、肿瘤浸润2 项指标对临床预后影响尚不显著外(P >0.05),其余指标对临床预后均有显著性影响(P<0.05)。其中年龄≤40岁患者的生存率(50.5%)显著低于>40岁的患者(65.8%,P=0.048<0.05);肿块直径>4cm 患者的生存率(43.6%)显著低于≤4cm 的患者(63.7%,P=0.014<0.05);低分化程度患者的生存率(39.5%)显著低于中分化、高分化的患者(P=0.025<0.05);肿瘤分期中ⅡB 期患者的生存率(38.1%)低于Ⅰ、ⅡA 期患者(P=0.012<0.05);有淋巴结转移患者的生存率(49.3%)显著低于无转移的患者(62.9%,P=0.018<0.05);HPV 阳性患者的生存率(42.4%)显著低于阴性的患者(66.7%,P=0.002<0.01),见表2。
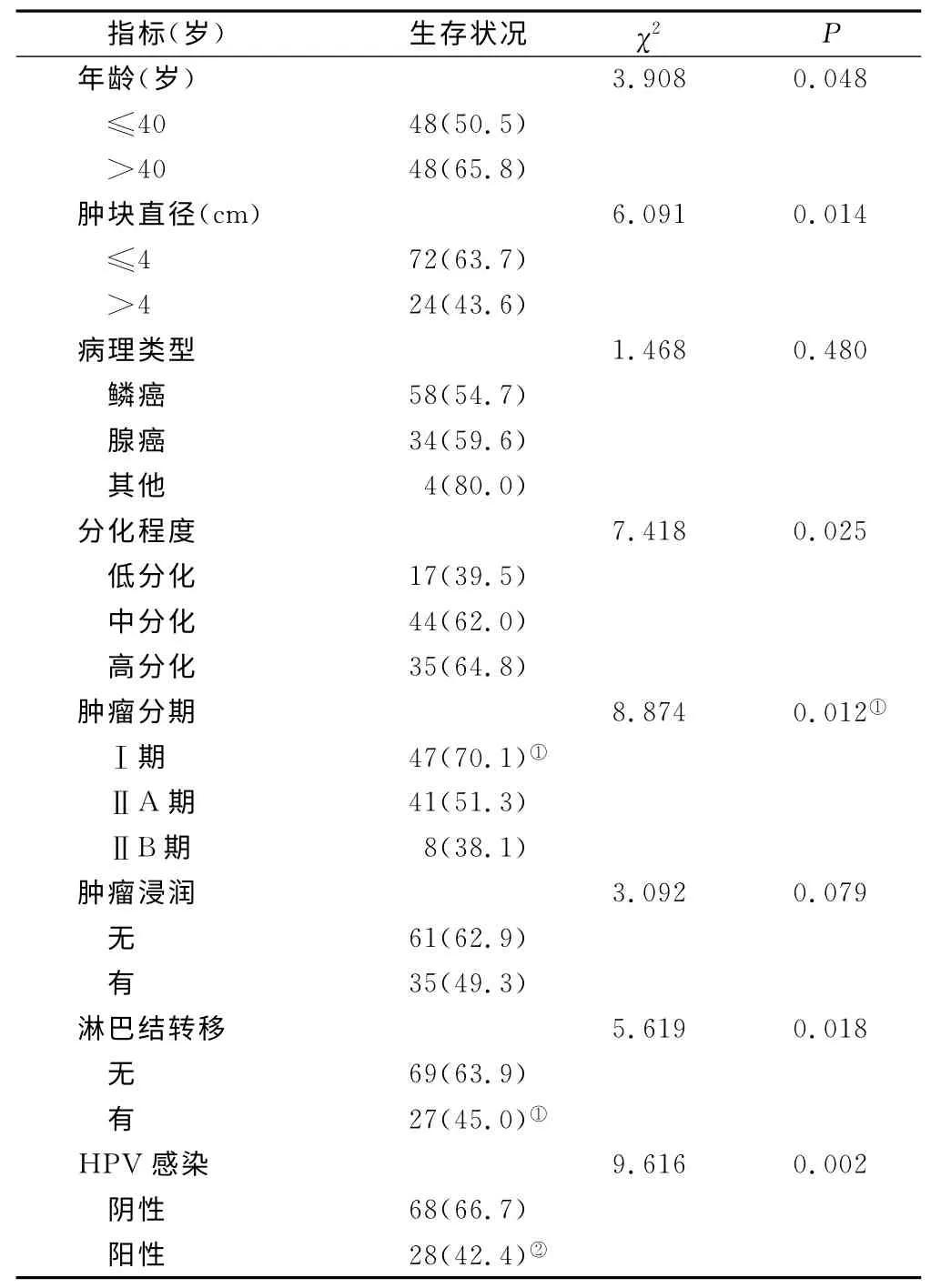
表2 宫颈癌临床预后指标的单因素方差分析[n(×10-2)]Table 2 Univariate analysis of the prognostic factors for cervical cancer
2.2 影响宫颈癌患者临床预后指标的COX 回归分析 结果显示,共有4项指标纳入回归分析模型:h(t,x)=h0(t)exp(0.706*肿块直径-0.4*分化程度+0.391*肿瘤分期+0.548* HPV)。其中肿块直径越大生存率越低,相对危险度[Exp(B)]为2.026(1.253,3.277);HPV 阳性较阴性生存率低,相对危险度为1.73(1.08,2.77);肿瘤分期越高生存率越低,相对危险度为1.478(1.031,2.12);肿瘤分化程度越低,生存率越低;COX 回归分析模型见表3。
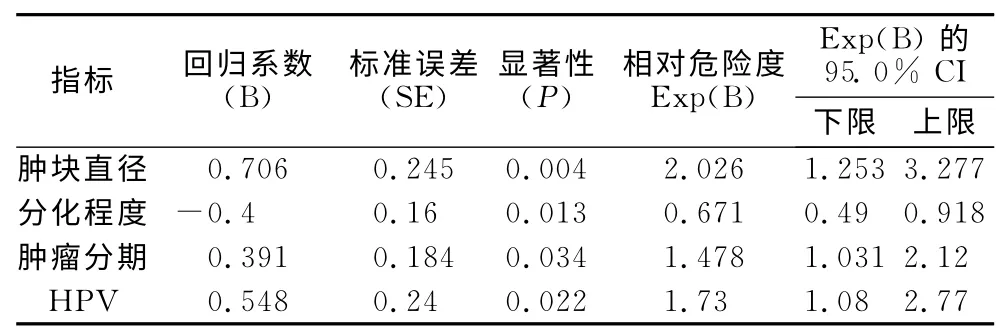
表3 宫颈癌临床预后影响因素的COX回归分析模型Table 3 COX regression analysis of the prognostic factors for cervical cancer
2.3 采用Kaplan-Meier法、Logrank检验对不同肿瘤直径间的累计生存率分析 结果显示,不同肿瘤直径间累计生存率存在差异(χ2=7.925,P=0.005<0.05),生存曲线见图1;随时间延长,累计生存率逐渐下降,在术后2~3年曲线下降较快,5年左右趋于平缓。肿块直径≤4cm 患者的5年累计生存率(61.4%)高于>4cm 的患者(40.6%);≤4cm 患者的中位生存时间为72个月,而>4cm 者为47个月。
2.4 采用Kaplan-Meier法、Logrank 检验对不同分化程度间的累计生存率分析 结果显示,不同分化程度的累计生存率存在差异(χ2=9.859,P=0.007<0.05),其生存曲线在5年左右趋于平缓,中、高分化组生存曲线较一致,低分化组生存曲线明显低于中、高分化组,累计生存率较低(P<0.05),见图2。其中低分化组的5年累计生存率(38.3%),低于中分化组的59%和高分化组的63.1%;中位生存时间低分化组为44个月,中、高分化组均为72个月。
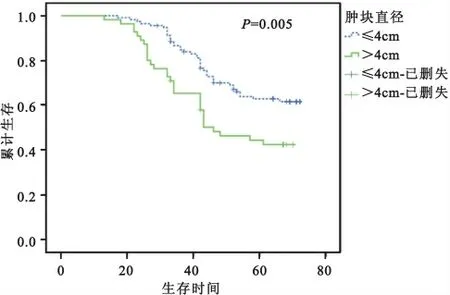
图1 宫颈癌不同肿瘤直径累计生存率分析结果Fig.1 Impact of tumor size on the survival of cervical cancer
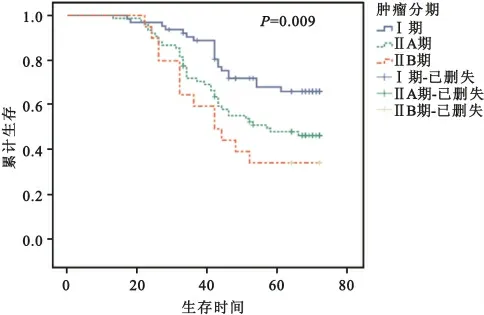
图2 宫颈癌不同分化程度累计生存率分析结果Fig.2 Impact of tumor differentiation on the survival of cervical cancer
2.5 采用Kaplan-Meier法、Logrank检验对不同肿瘤分期间的累计生存率分析 结果显示,不同肿瘤分期的累计生存率存在差异(χ2=9.423,P=0.009<0.05),其生存曲线亦在5年左右趋于平缓,3个分期在2年后区分明显,见图3。其中Ⅰ期的5年累计生存率最高(67%),ⅡA 及ⅡB期分别为49%和38.1%;Ⅰ期的中位生存时间为72个月,ⅡA、ⅡB期均为66个月。
2.6 采 用Kaplan-Meier 法、Logrank 检验对不 同HPV 结果的累计生存率分析 结果显示,HPV 检测阴性、阳性间累计生存率存在差异(χ2=8.69,P=0.003<0.05),HPV 感染检测阴性、阳性的生存曲线见图4。HPV 阴性的5年累计生存率(64%)高于阳性(40.7%),而HPV 阴性的中位生存时间为72 个月,阳性为49个月。
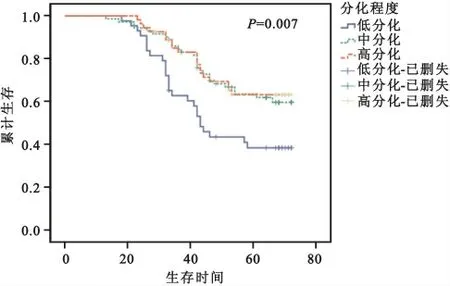
图3 宫颈癌不同肿瘤分期累计生存率分析结果Fig.3 Impact of FIGO staging on the survival of cervical cancer
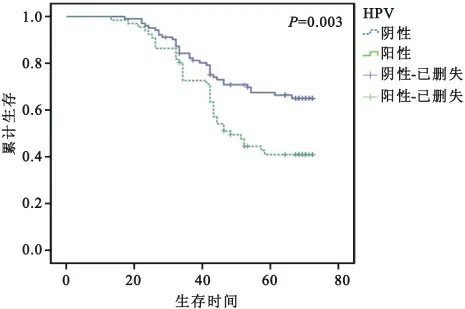
图4 宫颈癌不同HPV结果累计生存率分析结果Fig.4 Impact of HPV examination on the survival of cervical cancer
3 讨论
3.1 宫颈癌的复发 宫颈癌的发病率在女性恶性肿瘤中仅次于乳腺癌,目前治疗手段以手术、放化疗为主,但尚不能完全根治,需要早期干预治疗。宫颈癌诊断多于2年内发生复发,复发后未得到治疗者,多数在0.5~1年内死亡,存活>2年者仅为少数,复发患者的平均存活期仅为7 个月[7,8]。本研究结果显示,患者从1年累计生存率95.2%较快地下降到3年累计生存率62.8%,提示宫颈癌治疗后1~3年较为关键,需要加强随访及规范化、个性化地干预指导。
3.2 宫颈癌临床预后影响因素分析 本研究结果显示,对宫颈癌临床预后影响因素的分析中,单因素方差分析共筛选出6项指标、多因素共筛选出4项指标,其中肿块直径、分期、分化程度、HPV 均在单因素和多因素分析中呈显著相关。年龄、淋巴结转移仅在单因素方差分析中显著,但仍需给予重视。本研究中年龄≤40岁患者的生存率,显著低于>40岁患者(P<0.05),提示年轻女性肿瘤恶化程度较高,可能与年轻女性性交提前[9],HPV 感染机率较高有关[10]。同时有研究表明,年轻女性肿瘤细胞活跃,腺癌发生率和盆腔淋巴结转移率较高[11]。本研究结果显示,有淋巴结转移患者的生存率显著低于无转移的患者(P<0.05),表现出淋巴结转移对临床预后的负向影响。另有研究发现,有淋巴结转移患者的复发率显著升高[12,13]。
本研究COX 回归分析显示,肿块直径的相对危险度对临床预后影响显著,5年累计生存率分析结果提示,肿块直径越大,患者临床预后越差。另有研究显示,HPV 感染是宫颈癌发病的根源,提示HPV 感染对宫颈癌的发病、治疗、临床预后全程均有显著影响[14]。本研究结果亦显示,HPV 阳性相对危险度高,其5年累计生存率明显低于HPV 阴性的患者。在肿瘤分期指标中,Ⅰ期的5年累计生存率最高,其次为ⅡA 和ⅡB期,提示癌症患者早期治疗后生存率明显高于晚期,因此需要早期干预,及时治疗。分化程度的5年累计生存率分析结果显示,低分化<中分化<高分化,这与相关报道的低分化组累计生存率越低的趋势类同[15],分化程度越低,其恶性程度越高,患者的临床预后越差[16,17]。
4 结论
本研究结果显示,肿块直径、分期、分化程度和HPV 感染对宫颈癌的临床预后影响较大,而年龄、淋巴结转移仍然需要给予重视,应根据患者的个人情况,制定规范化的治疗干预方案。
[1]应倩,夏庆民,郑荣寿,等.中国2009年宫颈癌发病与死亡分析[J].中国肿瘤,2013,(8):612-616.
[2]周权,黄民主,黄霜,等.中国已婚妇女宫颈癌发病影响因素Meta分析[J].中国癌症杂志,2011,(2):125-129.
[3]陈琼,何莎,孟中容.宫颈病变的诊断治疗及研究进展[J].西部医学,2013,25(5):796-797.
[4]Baek M H,Park J Y,Kim D,et al.Comparison of adenocarcinoma and adenosquamous carcinoma in patients with early-stage cervical cancer after radical surgery[J].Gynecol Oncol,2014,135(3):462-467.
[5]杨凌云,王红静,贾西彪,等.35岁以下年轻宫颈癌患者临床病理特征及临床预后分析[J].广东医学,2012,33(18):2802-2805.
[6]李晓兰.宫颈癌发病年轻化趋势分析[J].中国妇幼保健,2007,22:3206-3207.
[7]DiMaio D.Nuns Warts Viruses and Cancer[J].Yale J Biol Med,2015,88(2):127-129.
[8]Suh D H,Lee K H,Kim K,et al.Major clinical research advances in gynecologic cancer in 2014 [J].J Gynecol Oncol,2015,26(2):156-167.
[9]Teke F,Yoney A,Teke M,et al.Lack of any impact of histopathology type on prognosis in patients with early-stage adenocarcinoma and squamous cell carcinoma of the uterine cervix[J].Asian Pac J Cancer Prev,2014,15(6):2815-2819.
[10]Chase D,Goulder A,Zenhausern F,et al.The vaginal and gastrointestinal microbiomes in gynecologic cancers:A review of applications in etiology,symptoms and treatment[J].Gynecol Oncol,2015,138(1):190-200.
[11]张美琴,陈鸣之.年轻妇女子宫颈癌174例临床及临床预后分析[J].中华妇产科学杂志,2003,38(11):689-693.
[12]Thaxton L,Waxman A G.Cervical cancer prevention:immunization and screening 2015[J].Med Clin North Am,2015,99(3):469-477.
[13]Dasari S,Wudayagiri R,Valluru L.Cervical cancer:Biomarkers for diagnosis and treatment[J].Clin Chim Acta,2015,445:7-11.
[14]Arbyn M,Castellsague X,de Sanjose S,et al.Worldwide burden of cervical cancer in 2008[J].Ann Oncol,2011,22(12):2675-2686.
[15]Soung M C.Screening for cancer:when to stop?:A practical guide and review of the evidence[J].Med Clin North Am,2015,99(2):249-262.
[16]王平,路平.Cox回归探讨宫颈癌临床预后影响因素[J].国外医学·妇幼保健分册,2002,(Z1):273-275.
[17]Kuji S,Hirashima Y,Komeda S,et al.The relationship between positive peritoneal cytology and the prognosis of patients with FIGO stage I/II uterine cervical cancer[J].J Gynecol Oncol,2014,25(2):90-96.

