神农香菊表皮毛特征及腺毛分泌物成分1)
何淼 刘颖竹 张蕊 孙颖
(东北林业大学,哈尔滨,150040)
神农香菊表皮毛特征及腺毛分泌物成分1)
何淼 刘颖竹 张蕊 孙颖
(东北林业大学,哈尔滨,150040)
以原产于神农架地区的神农香菊为研究对象,采用荧光显微镜及电子显微镜观察神农香菊表皮毛结构及腺毛密度,通过GC/MS分析腺毛分泌物。结果表明:神农香菊表皮毛的主要类型分为不具有分泌功能的T型非腺毛、具有分泌功能的头状腺毛。神农香菊叶片分别生长到3、4、5个月时,头状腺毛密度分布规律由多到少分别体现为上部叶、中部叶、下部叶;中部叶、上部叶、下部叶;中部叶、下部叶、上部叶。花部腺毛分泌物主要为α-蒎烯、β-蒎烯、α-水芹烯、双戊烯、樟脑、合成右旋龙脑等。
神农香菊;头状腺毛;T型非腺毛;腺毛密度;分泌物
神农香菊(Dendranthemaindicumvar.aromaticum)系菊科菊属野菊(Dendranthemaindicum)的一个新变种[1]。1982年由刘启宏[1]在神农架首先发现并将其命名为神农香菊,因其与同为菊科菊属的野菊花中所含有的化学成分[2-3]基本一致。因此,从植物化学分类学的角度可初步认定神农香菊即为野菊的变种。它是一种新的药用资源植物[4]。其花、叶及根均具有浓郁的香气,且具有平肝明目、清热解毒、散风降压的功效[5]。从花、叶、茎中提炼出的浸膏还是一种配制高档香精的优质原料。1988年,魏学元[6]就对高等植物的表皮毛进行了研究,指出其根据形态、结构可分为单细胞、多细胞的表皮毛和具有分泌功能的腺毛。腺毛大多数都由柄细胞以及腺头组成,既有短柄腺毛(单细胞柄、多细胞头),也有长柄腺毛(多细胞柄、单细胞或多细胞腺头)[7]。对腺毛和腺毛分泌物的研究主要集中在烟草这种植物上。研究证明:烟草腺毛的形态结构与其分泌功能有密切的关系[8-11]。烟叶腺毛密度及其分泌物对烟叶香气有重要作用[12],分泌物主要成分的质量分数与腺毛密度呈正比[13]。同时前人还证实了腺体和腺毛普遍分布于大部分菊科植物上[14]。植物挥发油是一类天然植物性添加剂,能够矫正食品的异味,赋予香气,具有着色、抗菌消炎、抗氧化等作用[15]。研究表明,腺毛是挥发油合成和分泌的主要场所,因此挥发油的产生与分泌和腺毛的分布、类型及其结构等有着直接联系[16]。
吕明月[17]对神农香菊表皮毛进行了初步研究。显微镜观察结果显示,神农香菊叶片表皮毛密度的分布特点为:幼叶大于成熟叶;下表皮大于上表皮;一级叶脉处大于二级叶脉处大于叶边缘。表皮毛类型主要为单列毛和T型毛两种。神农香菊叶片腺毛分泌物的主要成分为烩烯、桉叶油醇、p-侧柏醇、樟脑、揽香烯和a-红没药烯。其中萜烯类占鉴定总成分的22.29%、醇类占31.43%、酸类占11.56%,除此之外,还包括7.05%的苯类和6.53%的烷类。针对目前的研究进展,关于神农香菊表皮毛的研究尚处于初步阶段,文中进一步完善神农香菊植株表皮毛在叶、茎、花上的结构类型,并对不同发育时间、不同叶位的腺毛密度、分泌物的化学成分进行分析并作出多重比较。以期为神农香菊未来致香机理的研究做出一定贡献,为神农香菊的推广应用打下坚实基础。
1 材料与方法
由湖北神农架地区(109°56′~110°58′E,31°15′~31°75′N)引种,经东北林业大学园林学院苗圃基地成功栽培的神农香菊。2013年11月份以细沙进行脚芽扦插,两周后待已生根时换土,置于温室中进行培养,次年3月初以直径为12 cm的花盆上盆,每周浇水一次;至5月初移至东北林业大学园林学院154实验室培养装置下进行培养,作为试验材料备用。
腺毛密度统计及形态结构观察:神农香菊苗培养到3、4、5个月时分别取5盆长势一致的植株第2、7、12片叶,作为不同苗龄上部叶、中部叶、下部叶,将每个叶位的叶片按叶基、叶中、叶尖分割成3部分。采用荧光显微镜对叶片每个取材部位进行观察拍照,每个视野约1.84 mm2,观察时每个叶片的叶基、叶中、叶尖各取4个视野,5盆植株一共20个视野,进行头状腺毛密度的观察统计。以培养4个月最具代表性苗龄的神农香菊苗叶片、茎作为腺毛形态、结构研究的材料,花则直接取花瓣、子房用于扫描电镜观察。10月末待神农香菊开花时,进行花部器官腺毛形态、密度的研究。
腺毛分泌物提取方法:参考朱晓宇等[18]的方法。每个样品共用300 mL二氯甲烷进行提取。每处理选取20个叶片。将取自不同叶位的叶片样品备好,每个样品首先放入装有100 mL二氯甲烷的1号烧杯中浸提1次,侵提时间为2 s,取出待二氯甲烷稍挥发后,再进行第2次、第3次浸提。将2号烧杯中同样倒入100 mL二氯甲烷,将在1号烧杯中处理过的叶片在2号烧杯中再次浸提,浸提3次,每次浸提时间2 s,具体操作同步骤1。将2号烧杯中浸提过的叶片放入装有100 mL二氯甲烷的3号烧杯中进行第3次浸提,操作方法同上。用天平称取15 g无水硫酸钠倒入装有滤纸的漏斗中。将3次浸提得到的浸提液倒入加有无水硫酸钠的漏斗中,缓慢地滤入圆底烧瓶中。将每个烧杯中再倒入20 mL二氯甲烷,进行清洗,然后将清洗液一并滤入圆底烧瓶中。将圆底烧瓶连入旋转蒸发仪进行旋转蒸发,保持恒温40 ℃,转数适宜。待旋转蒸发结束后,用枪头将浓缩液转移至进样瓶中,然后将样品置于冰箱中4 ℃保存备用。
腺毛分泌物分析及鉴定方法:色谱条件GC条件为色谱柱,HP-5MS(30 m×0.25 mm×0.25 μm)弹性石英毛细管柱,进样量1 μL,分流比5∶1,50 ℃保持30 min,升温速度5 ℃·min-1,升到160 ℃,再以10 ℃·min-1升温至270 ℃,溶剂延迟3.5 min。MS条件为电离方式,EI模式,电离能量为70 eV,四极杆温度150 ℃,离子源温度230 ℃,电子倍增器电压2 100 V,接口温度280 ℃,扫描范围4 500 μm,标准质谱图库NIST08L。物质分析鉴定是根据检测结果得出的Cas号进行物质成分鉴定,得到相关数据;利用excel软件进行作图。
数据分析:试验数据采用SPSS17.0进行统计学分析,用平均值和标准误表示测定结果,分别对长势一致不同苗龄的植株进行上部叶、中部叶和下部叶的处理,同一苗龄不同叶位的上/下表皮、叶基、叶中、叶尖,腺毛总数量进行单因素方差分析,并用Duncan法对各测定数据进行多重比较;采用Excel 2010制图。
2 结果与分析
2.1 神农香菊表皮毛形态结构与类型
通过观察,如图1为神农香菊表皮毛的形态、结构,观察发现,神农香菊表皮毛分布于整个植株,在它的叶、茎、花上均有分布;其中在叶片和茎上有两类表皮毛分布,它们分别是T型非腺毛和头状腺毛[19]。而在花器官上的分布则只有头状腺毛。T型非腺毛一般由1个基细胞,嵌入叶肉细胞中;2~15个(3~7个居多)柄细胞,柄细胞呈圆柱状;2个翼状头部细胞组成。头状腺毛呈蚕豆状,一般由1个基细胞,嵌入叶肉细胞中;1个柄细胞和1个头部细胞组成,中间有明显的缢痕。

A.两类表皮毛;B.T型非腺毛结构;C.头状腺毛结构;D.头状腺毛;E.T型非腺毛;F.头部细胞;G.柄细胞;H.基细胞。
2.2 神农香菊叶片头状腺毛密度
2.2.1 神农香菊同一苗龄头状腺毛密度
以具有代表性的4个月苗龄神农香菊头状腺毛密度作为研究对象(图2),神农香菊上部叶(1~3片)叶片腺毛呈小且干瘪的状态,随着叶位的下降,到第5片叶时,呈现大而饱满与小而干瘪的头状腺毛相间状态,随着叶位继续下降,到第7~9片叶,全部呈现为大而饱满的头状腺毛,叶位继续下降,植株底部叶片的腺毛虽仍为大而饱满的头状腺毛,但此时已出现部分腺毛表面破裂,分泌物外泄的状况。
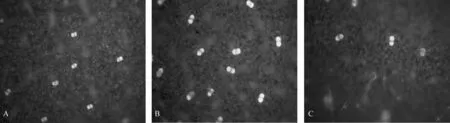
A.上部叶;B.中部叶;C.下部叶。
2.2.2 神农香菊不同苗龄头状腺毛密度
由表1可看出,当苗龄为3个月时,叶片不同叶位下表皮头状腺毛密度分别为28.40、22.90、18.70个·视野-1,而上表皮则为0.50、1.60、2.75个·视野-1,由此可知,神农香菊叶片的头状腺毛集中分布于下表皮,在上表皮的分布极少。此时,叶片头状腺毛密度分布规律由多到少体现为上部叶、中部叶、下部叶。
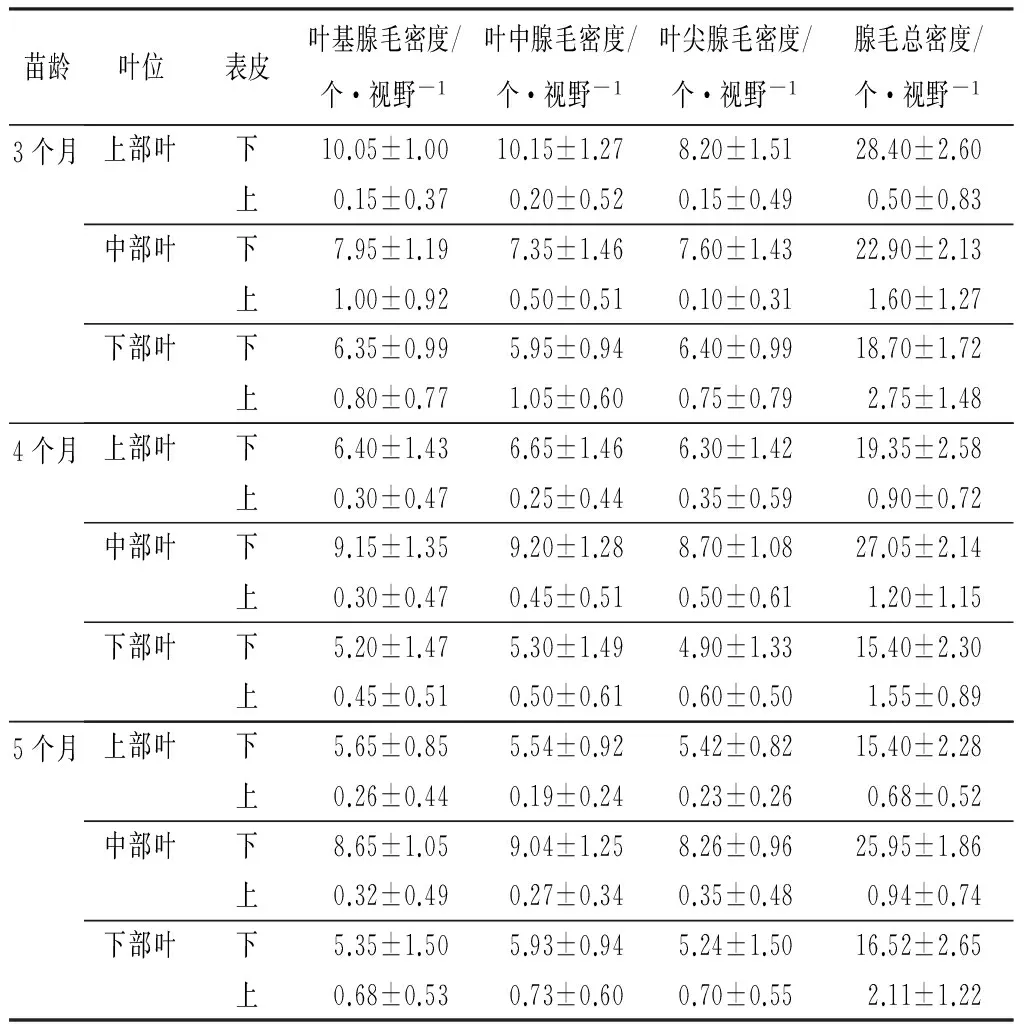
表1 神农香菊不同苗龄头状腺毛密度
当苗龄为4个月时,叶片不同叶位下表皮头状腺毛密度分别为19.35、27.05、15.40个·视野-1,而上表皮则为0.90、1.20、1.55个·视野-1。此时,叶片头状腺毛密度分布规律由多到少体现为中部叶、上部叶、下部叶。
苗龄为5个月时,叶片不同叶位下表皮头状腺毛密度分别为15.40、25.95、16.52个·视野-1,而上表皮则分别为0.68、0.94、2.11个·视野-1。此时,叶片头状腺毛密度分布规律由多到少体现为中部叶、下部叶、上部叶。
由此可见,神农香菊叶片头状腺毛发生发育遵循一定的规律,不同苗龄叶片的不同叶位,头状腺毛数分布不一,呈现先上部叶腺毛数分布最多,之后中部叶腺毛数居上,而后下部叶腺毛数有所提高,但仍以中部叶数量最多。神农香菊叶片不同叶位的叶基、叶中、叶尖头状腺毛密度并无明显规律可言。
2.3 神农香菊花瓣腺毛密度及分泌物
由表2可知,神农香菊花瓣上,只有一类表皮毛分布,即头状腺毛,而没有T型非腺毛的分布;且头状腺毛只分布于花瓣背部。
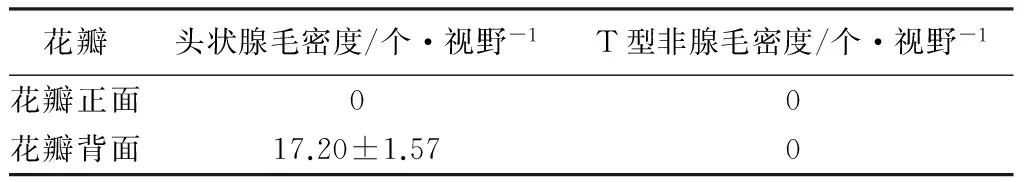
表2 神农香菊花瓣头状腺毛密度
花的腺毛分泌提取物主要有α-蒎烯、β-蒎烯、α-水芹烯、双戊烯以及樟脑、合成右旋龙脑等物质,烯类总质量分数高达25.66%、樟脑及龙脑总质量分数达8.58%,两类物质占了分泌物总质量分数很大的比例,因此,神农香菊花才具有浓郁的香气。
3 结束语
神农香菊作为罕见的具有浓郁香味的种,为菊科菊属中难得的芳香植物,其植株中提取的芳香油具有广阔的开发潜力和应用前景。而挥发油的产生和分泌与腺毛的结构类型、分布密度等有着密不可分的联系。分泌物主要成分的质量分数与腺毛密度呈正比[13]。通过对神农香菊叶、茎、花上的表皮毛形态、结构、类型等进行观察和研究,比较了不同苗龄不同叶位的神农香菊头状腺毛密度,虽然头状腺毛分布不一,呈现先上部叶腺毛数分布最多,之后中部叶腺毛数居上,而后下部叶腺毛数有所提高,但综合比较仍以神农香菊的中部叶数量最多,进而得出中部叶的分泌物质量分数也较高。以此可为今后继续研究神农香菊的制香机理、开发与利用提供了坚实的基础。通过应用芳香植物来营造园林景观,既可以起到美化环境的作用又可产生良好的生态效果,以期为未来园林建设发挥应有的价值。
[1] 刘启宏,张树藩.神农架菊属:新变种[J].武汉植物学研究,1983,11(2):237-238.
[2] 高美华,李华,张莉,等.野菊花化学成分的研究[J].中药材,2008,31(5):682-684.
[3] 吴钉红,杨立伟,苏薇薇.野菊花化学成分及药理研究进展[J].中药材,2004,27(2):142-144.
[4] 田耀平.神农香菊生药学与化学成分的研究[D].武汉:湖北中医学院,2007.
[5] 芦金清,李竣.神农香菊的挥发油化学成分[J].中国中药杂志,2002,27(8):598-599.
[6] 魏学元.浅谈高等植物的毛[J].生物学通报,1988,8(10):16.
[7] 苏德成.中国烟草栽培学[M].上海:上海科学技术出版社,2005:49-53.
[8] 韩锦峰,王广山,远彤,等.烤烟叶面分泌物的初步研究[J].中国烟草,1995(2):10-13.
[9] 史宏志,官春云.烟草腺毛分泌物的化学成分及遗传[J].作物研究,1995,9(3):46-49.
[10] 高致明,刘国顺,符云鹏,等.香料烟叶片腺毛及分泌细胞的研究[J].河南农业大学学报,1996,30(4):329-332.
[11] Spring O. Chemotaxonomy based on metabolites from glandular trichomes[J]. Advances in Botanical Research,2000,31:153-175.
[12] 王伟,孔光辉,李佛琳.烤烟烟叶腺毛及其分泌物研究进展[J].中国农学通报,2007,23(2):251-254.
[13] 孔光辉,宗会.不同部位成熟烟叶腺毛密度及其分泌物的研究[J].中国农学通报,2006,22(12):108-110.
[14] 李雅菲;邢梅;张蝶,等.几种菊属植物叶表毛状体形态观察的比较[M]//张启翔.中国观赏园艺研究进展.北京:中国林业出版社,2009.
[15] Tian Jun, Ban Xiaoquan, Zeng Hong. Chemical composition and antifungal activity of essential oil fromCicutavirosaL. var.latisectaCelak[J]. International Journal of Food Microbiology,2011,145(2/3):464-470.
[16] 胡凤莲.唇形科11种药用植物叶表及表皮毛的比较形态学的研究[D].西安:西北大学,2008.
[17] 吕明月.神农香菊遗传转化体系的建立及其叶片表皮毛初步研究[D].哈尔滨;东北林业大学,2013.
[18] 朱晓宇,姚珊珊,赵宸楠.DIS过程中烤烟叶片腺毛形态结构及分泌物变化[J].江西农业学报,2010,22(5):9-11.
[19] 李杰,邢梅,李雅菲,等.菊花和除虫菊毛状体的比较[J].园艺学报,2010,37(9):1463-1470.
Dendranthemaindicumvar.aromaticumEpidermal Hairs and Glandular Hair Secretions//
He Miao, Liu Yingzhu, Zhang Rui, Sun Ying
(Northeast Forestry University, Harbin 150040, P. R. China)//Journal of Northeast Forestry University,2015,43(9):117-120.
WithDendranthemaindicumvar.aromaticumin the Shennongjia area, we used fluorescence microscope and electron microscope to observe trichome and trichome density, and analyzed the glandular hairs secretions by GC/MS. The main types of trichomes ofD.indicumvar.aromaticumwere T type non-glandular with a secretory function, and capitate glandular hairs with a secretory function. When the leaves ofD.indicumvar.aromaticumwere grown to 3, 4 and 5 months, the capitate glandular trichome density distribution in descending order were upper leaves, middle leaves and lower leaves; middle leaves, upper leaves and lower leaves; middle leaves, lower leaves and upper leaves, respectively. The glandular in the flower secretions wereα-pinene,β-pinene,α-phellandrene, dipentene, camphor, and synthetic borneol.
Dendranthemaindicumvar.aromaticum; Capitate glandularhairs; T type non-glandular trichome; Density of glandular trichome; Secretion
1)国家自然科学基金项目(31400590)。
何淼,女,1975年9月生 ,东北林业大学园林学院,副教授。E-mail:hemiao_xu@126.com。
孙颖,东北林业大学园林学院,副教授。E-mail:littlesuning@126.com。
2015年4月18日。
S682.1+1;Q944.68+1
责任编辑:任 俐。

