柚木无性系苗期抗寒生理评价与选择1)
黄桂华 梁坤南 周再知 马华明 杜健
(中国林业科学研究院热带林业研究所,广州,510520)
柚木无性系苗期抗寒生理评价与选择1)
黄桂华 梁坤南 周再知 马华明 杜健
(中国林业科学研究院热带林业研究所,广州,510520)
以不同柚木无性系盆栽苗为研究对象,分别进行6 ℃培养24 h,接着3 ℃培养24 h,在低温冷害处理前后分别取叶样进行了相对电导率、游离脯氨酸质量分数和超氧化物歧化酶(SOD)活性的测定,分析了低温冷害对柚木生理的影响,综合评价了不同柚木无性系的抗寒性。结果表明,除了SOD活性在6 ℃处理下不同柚木无性系间没有显著差异外,不同柚木无性系间3个生理指标在处理前后都达到显著或极显著差异水平;冷害处理后,柚木无性系相对电导率和游离脯氨酸质量分数基本呈上升趋势,SOD活性则有的无性系先上升后下降,有的无性系先下降后上升;部分柚木无性系通过增加游离脯氨酸质量分数和SOD活性来提高自身的抗寒性;综合评定抗寒性强的柚木无性系有7559、7531、Z408,其次较耐寒的柚木无性系有7509、7544和7514;缅甸种源抗寒性高于印度种源。
柚木;无性系;生理响应;抗寒性;早期选择
柚木(TectonagrandisL. f.)是世界名贵的用材树种,素有“万木之王”的美称;其心材呈黄褐色或暗褐色,材质坚韧耐久,结构致密美观,是制造军舰、建筑、家具、雕刻和木地板等的高级用材[1]。柚木具有生长快,材质优良,用途广和投资回报率高等特点,在热带、南亚热带地区广为种植[2-3]。现在,柚木已被引种到亚洲、非洲、中南美洲和大洋洲的50多个国家,范围从北纬28°,穿越赤道,到南纬18°[4]。
我国引进柚木栽培已有180多年历史,种植范围遍及10个省(自治区)60多个县(市),总面积约1.5万hm2[5]。近年来,云南省、海南省把柚木列为主要造林树种,海南、云南、广东、广西等私人与企业采用柚木造林的也越来越多。然而,柚木作为一个外来引进的热带树种,在我国广东、广西、福建等一些次适生区,柚木苗期或1~3年生幼林期,越冬若遇到持续的霜冻或2 ℃以下的低温,则会出现冷害或冻害现象,顶芽、植株中上部甚至整株死亡[6-8]。因此,寒害是制约我国柚木发展面临的难题,导致柚木在我国的发展地理区域面积有限,也受到极端低温气候的风险,基于此,尽快选育出更加抗寒的柚木优良新品系,是大力发展柚木种植业面临的一个迫切需要解决的现实问题。
前期结果表明,柚木不同种源、不同无性系在抗寒性方面有较大遗传差异[8-9],这为柚木抗寒育种提供了广阔的空间。林木生长周期长,仅靠大田测定结果,育种效率低。现代研究人员常利用生理生化或分子生物学技术手段,可对林木测定材料开展苗期甚至各个生长阶段的评价进行早期选择,从而缩短育种时间,提高评估和育种效率。He et al.[10]研究了福建柏抗寒生理指标变化,为福建柏抗寒种源的选择和引种北移提供了科学依据。张富山等[11]针对科罗拉多云杉不同种源选择测定了6个生理指标,研究得出种源间抗寒性由强到弱顺序为科罗拉多雾蓝、科罗拉多蓝杉、科罗拉多凯巴。张卫华等[12]评估了相思在树种和种源水平上的耐寒性,认为大叶相思和厚荚相思低温敏感温度为0~3 ℃,二者抗寒性强于马占相思,并分别选择出了3个树种耐寒的种源。本研究拟进行柚木无性系盆栽苗期冷害胁迫,测定分析各项生理指标,以便了解柚木无性系的抗寒机理,最后综合评价各无性系的抗寒性差异,辅助柚木优良无性系选育,以期早期选择出一批抗寒性强的柚木优良无性系,缩短育种周期,为我国柚木种植业的大力发展提供栽培材料的保证。
1 材料与方法
选择了21个柚木组培无性系,在中国林科院热带林业研究所苗圃分别移植成活7个月后,移入塑料育苗盆进行盆栽,基质为1 500 g的黄心土,同时以柚木种子园的优良家系种子培育同龄实生苗盆栽为对照,共22个号(表1),文中编号和名称采用最初生产及大田试验林的统一编号,每盆1株,每个无性系3盆。
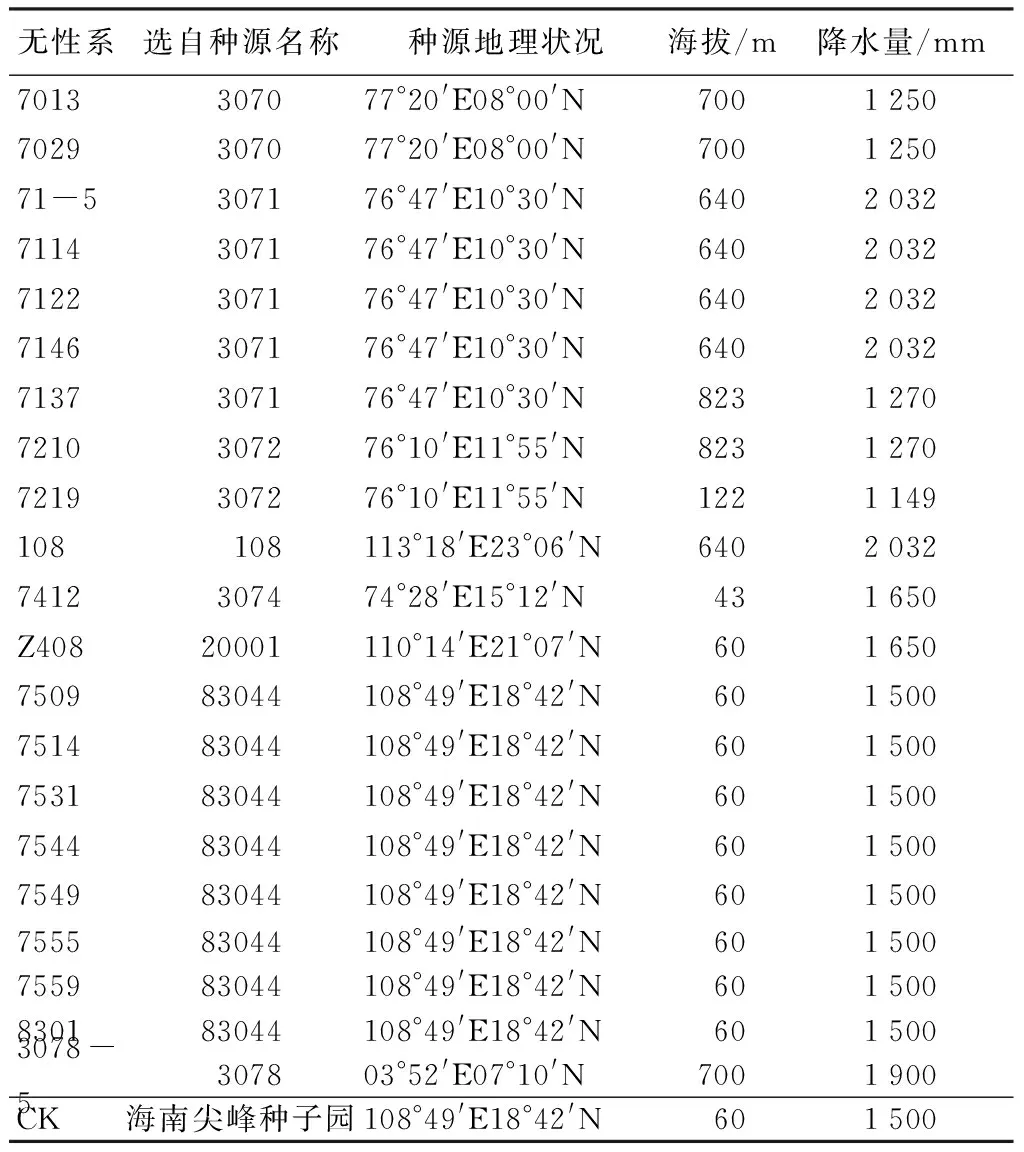
表1 参试柚木无性系及其来源
盆栽5个月时,对每株进行取样分析低温冷害处理前的生理指标,剪取每株的从上往下数第3对成熟叶片,取样后迅速回到实验室进行生理分析或分装于液氮中保存。然后,将所有植株置于人工气候箱进行低温培养,设计从常温开始每小时降3 ℃,降到6 ℃时,保持培养24 h,之后同样对每株采集叶样进行生理分析;接着降到3 ℃保持培养24 h,对每株采集叶样进行生理分析。人工控制培养时,光照强度为1 200 lx,光照时间为12 h,相对湿度保持在70%~80%。
测定的生理指标包括相对电导率、游离脯氨酸质量分数和超氧化物歧化酶(SOD)活性。电导率的测定参照陈建勋等[13]的方法,游离脯氨酸质量分数的测定参照郝再彬[14]的方法,SOD活性的测定参照Giannopolitis et al.[15]的方法。测定时,每个样品每个指标待数值稳定后记录3次。
用Excel计算出每个样品每个指标测定3次数据的平均值,然后采用SAS软件程序进行方差分析和Duncan多重比较。应用多维空间(欧几米德)多向量综合评定法进行无性系抗寒性的综合评定。
2 结果与分析
2.1 冷害后柚木无性系的生长情况观察
柚木无性系冷害发生后,冷害特征首先表现在顶芽和叶片上。本试验柚木无性系在6 ℃培养24 h后,无性系7509、7514、8301、7559和CK有3株顶芽或少量叶片保持完好,其他无性系部分叶片及顶芽萎蔫。3 ℃培养24 h后,上述冷害特征更加严重,无性系7509、7514、8301、7559和CK有3株顶芽完好,7531、Z408、7555、7544有2株顶芽完好,其他无性系几乎所有顶芽和大部分叶片出现萎蔫甚至干枯现象,干枯的叶片主脉及其两侧保持绿色。此次冷害培养处理的人工气候箱有较大的循环冷风,冷害胁迫对顶芽、嫩叶和老叶同时造成伤害。
本试验冷害处理结束后对所有参试柚木无性系植株恢复常温和正常管护,大部分无性系的顶芽和叶片受冷害后都枯萎或凋落。无性系7210、7122、7412和3078-5各有1株死亡,其他无性系都能在1个星期后萌生侧芽,开始正常生长。
2.2 冷害后柚木无性系叶片生理指标的响应
2.2.1 冷害后柚木无性系相对电导率的响应
对冷害处理前后柚木无性系的相对电导率数据进行方差分析,结果表明,处理前柚木无性系间的相对电导率有显著差异(P=0.036 7),3 ℃冷害后则达到了极显著差异(P=0.008 5)。从处理前后的数据变化(表2)来看,随着冷害胁迫温度的降低,柚木无性系的相对电导率主要呈现出升高的趋势,说明低温冷害使细胞膜受伤害,破坏了细胞膜的稳定性,膜透性增加,导致细胞膜内电解质外渗,从而相对电导率升高,并且冷害温度越低,细胞膜透性变得越大,膜受伤害的程度越强。
值得注意的是,无性系7559、7531和Z408等随着冷害温度的降低,相对电导率变化不大。分析其原因,可能是这些无性系具有很强的抗寒性,低温(冷驯化)使其启动了自身的避寒或耐寒机制,细胞膜没有受到伤害。从处理后相对电导率与处理前的比值来看,柚木无性系经历3 ℃冷害处理后,相对电导率变化幅度从小到大依次是7559、7531、Z408、7219、7412、CK和7509,说明它们的细胞膜受到破坏或破坏程度从小到大也是这个顺序,因此,早期选择以20%的入选率,可以认为7559、7531、Z408和7219属于抗寒性强的柚木无性系,其次为7412、7509。相反,71-5、7114、108、7122、3078-5和7210为柚木无性系抗寒性弱。
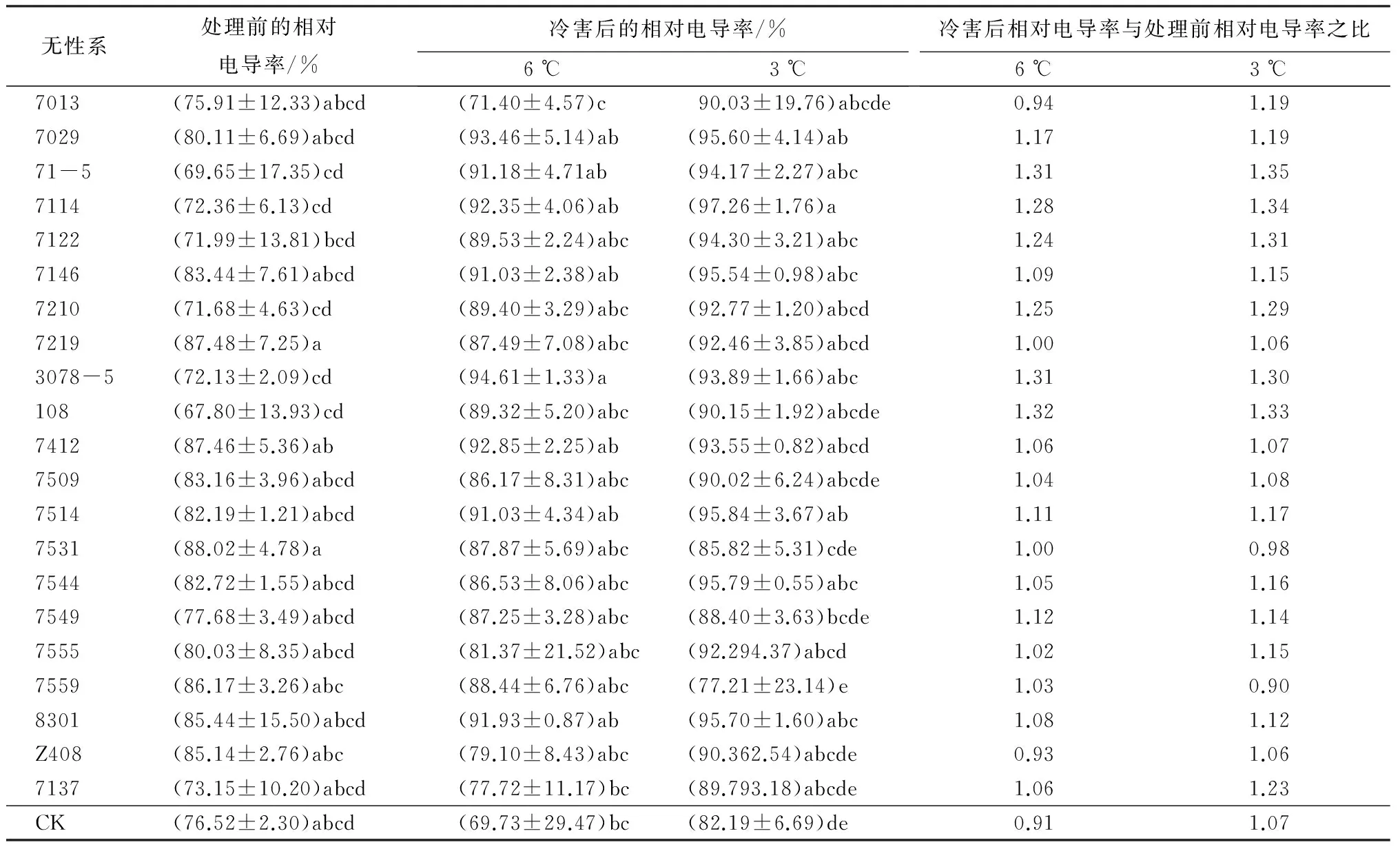
表2 柚木无性系冷害后电导率的邓肯多重比较
2.2.2 冷害后柚木无性系游离脯氨酸质量分数的响应
植物遇到冷害、干旱等逆境条件时,体内会大量积累脯氨酸,脯氨酸作为渗透调节物质可以减少植物在逆境中受到的伤害,从而提高植物抵抗低温胁迫等的能力[16]。方差分析表明,处理前(P<0.000 1)和处理后(6 ℃,P=0.000 4;3 ℃,P<0.000 1)柚木无性系间的脯氨酸质量分数都有极显著差异。从处理前后脯氨酸质量分数数值的变化(表3)来看,随着低温胁迫的加剧,大部分柚木无性系启动了自我生理保护机制,通过脯氨酸的合成和积累提高自身的抗寒性,积累的越多,说明抗寒性越强。从处理后与处理前脯氨酸质量分数的比值来看,以20%的入选率,可知7531、CK、7137、7514、Z408抗寒较强,其次为7219、7509,而无性系7146、7013、7029、71-5、7122、7210不抗寒。
2.2.3 冷害后柚木无性系超氧化物歧化酶活性的响应
超氧化物歧化酶(SOD)是细胞抵御活性氧伤害的膜保护系统,在清除超氧自由基、过氧化氢和过氧化物及阻止或减少羟基自由基形成方面起重要作用[17-18]。在低温胁迫下,植物细胞自由基产生会伤害细胞膜系统,因此,SOD活性的高低反映了植物对低温等逆境抵御能力的大小。对低温冷害处理前后柚木无性系SOD活性进行方差分析,结果表明,处理前柚木无性系间的SOD活性有极显著差异(P<0.000 1),而6 ℃冷害处理后,柚木无性系间的SOD活性差异不显著。比较处理前后SOD活性数据(表4)可知,部分无性系正常生长情况下SOD活性较低(如7509和7544),经过6 ℃冷害处理后,SOD活性增加了;另一些无性系正常生长情况下SOD活性较高(如71-5和7114),经过6 ℃冷害处理后,SOD活性减少了;最后还有一部分柚木无性系(如7013和7137)SOD活性变化或增减很小。可见不同柚木无性系对6 ℃低温的敏感程度不一样,这也体现出了无性系间抗寒性不一样,有的柚木无性系生长对6 ℃低温敏感,有的柚木无性系生长对6 ℃冷害不敏感。3 ℃冷害处理后,不同柚木无性系的SOD活性又有极显著差异(P<0.000 1),说明此时柚木无性系间的SOD活性又因更低温度的胁迫而发生了急剧的变化,3 ℃冷害是柚木无性系生长的更为敏感的温度。
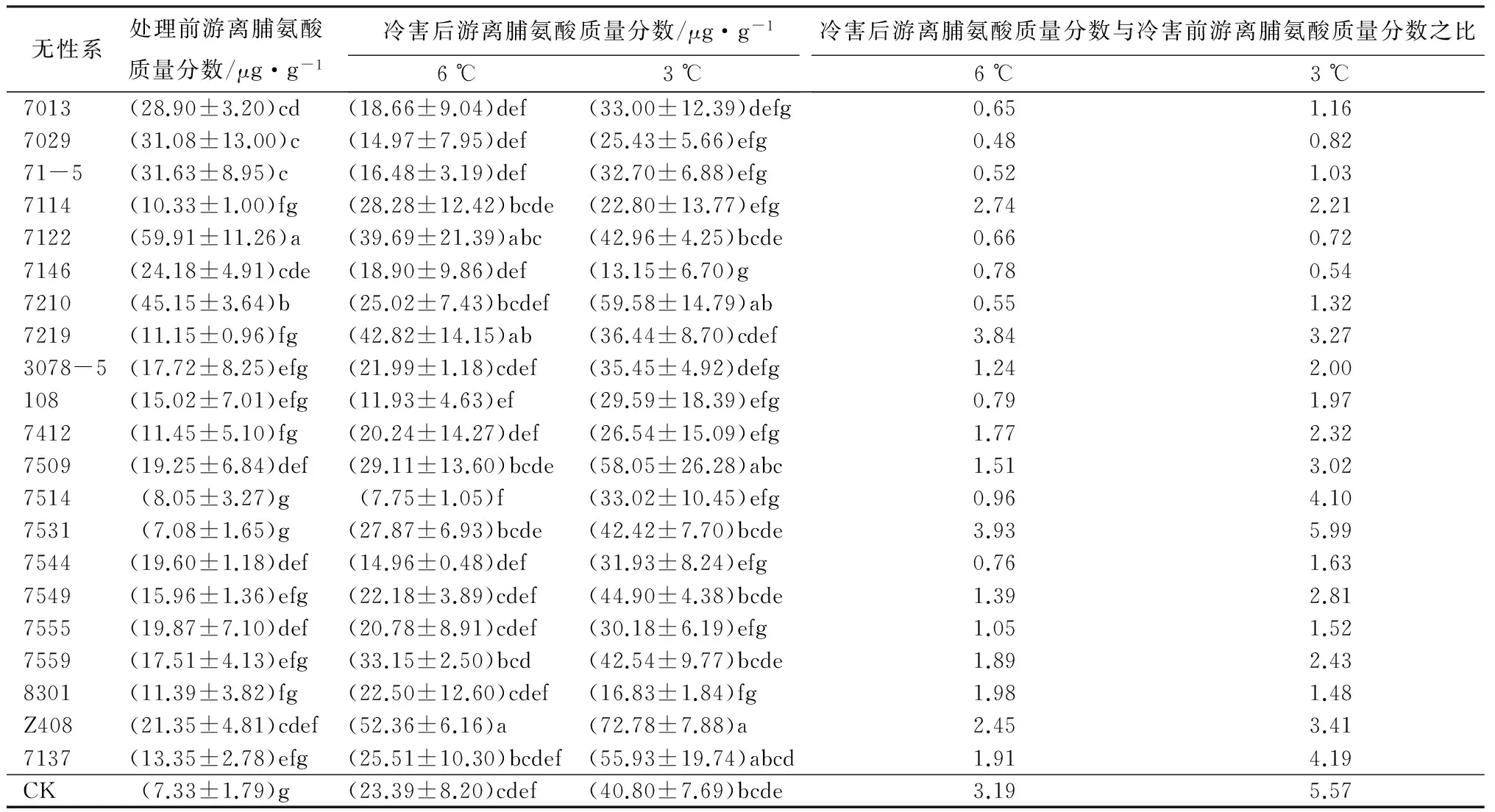
表3 柚木无性系冷害后游离脯氨酸质量分数的邓肯多重比较
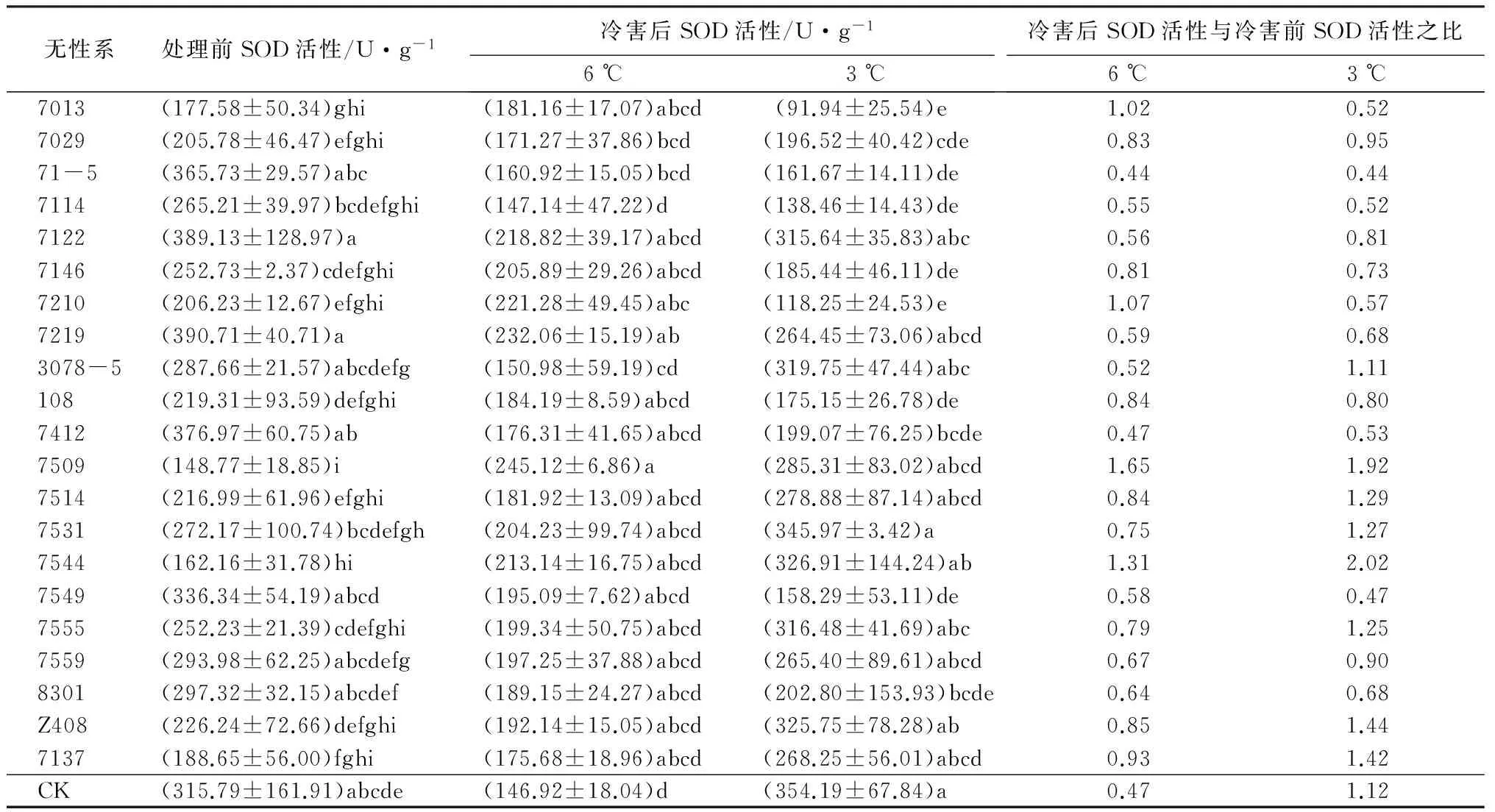
表4 柚木无性系冷害后SOD活性的邓肯多重比较
低温胁迫后,部分柚木无性系通过提高SOD活性来调节提高自身的抗寒性,体内SOD活性越高,说明其抗寒性越强。从处理后SOD活性与处理前的比值来看,7544、7509、Z408等柚木无性系处理后SOD活性明显增加,且随着胁迫的加剧,SOD活性增加量更高,因此,以20%的入选率,可以认为7544、7509、Z408、7137柚木无性系抗寒性强,其次为7514、7531、7555。相反,柚木无性系71-5、7114、7146、7412、7219、108、7013、7210抗寒性弱。
2.3 柚木无性系抗寒性的综合评定
采用欧几米德多向量理论综合评定法对柚木无性系3 ℃(柚木生长敏感温度)处理后的生理指标数据进行分析,评估柚木无性系间的抗寒性(表5),可知比CK抗寒性强的柚木无性系只有7559,以20%的入选率,其次相对较耐寒的柚木无性系有7531、Z408、7509。
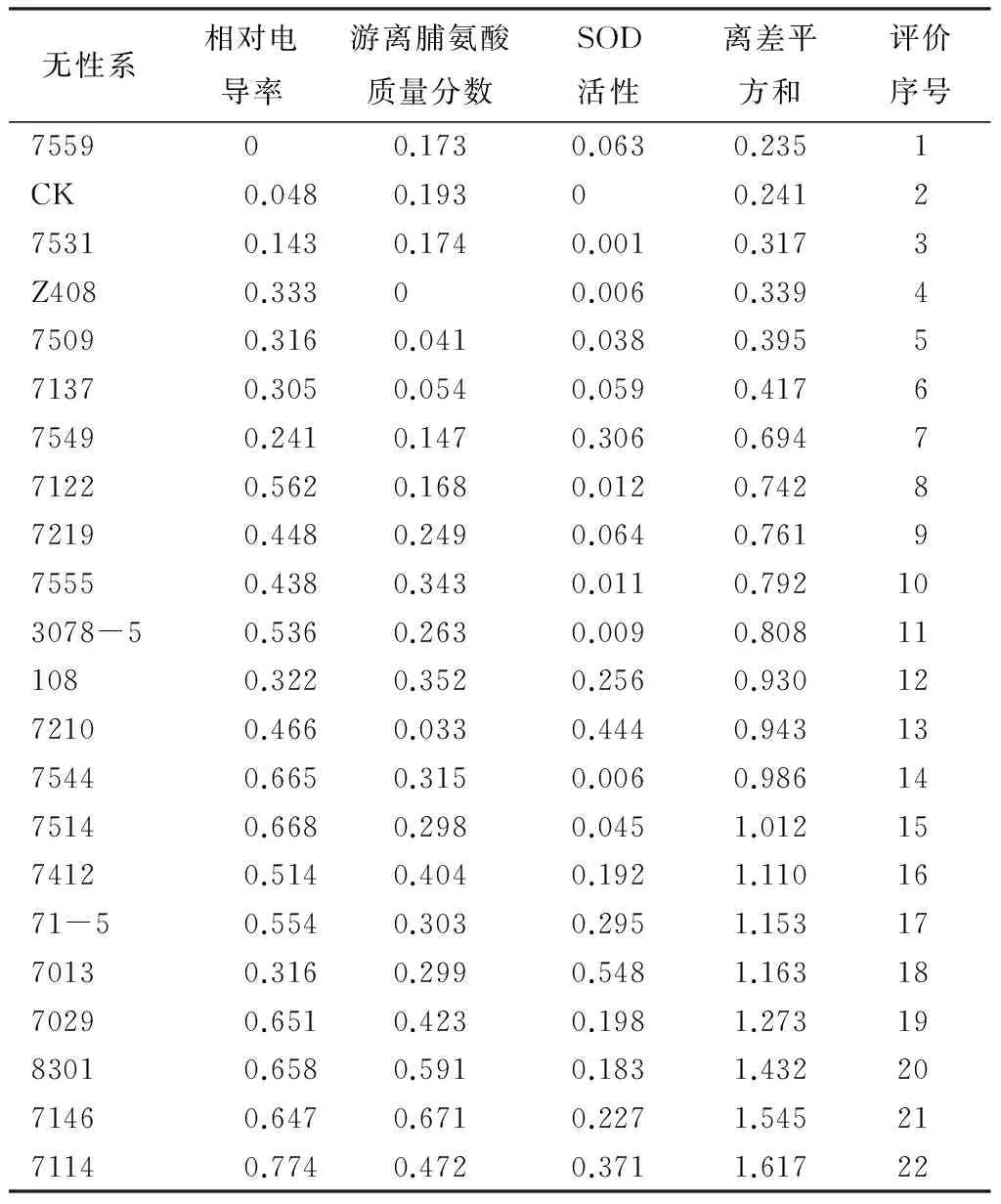
表5 欧几米德多向量理论综合评定柚木无性系抗寒性
3 结论与讨论
植物生长过程中遇到低温冷寒等逆境时,其体内生理活动会发生一系列的复杂连锁反映,这既和外部环境条件有关,也和自身的抗逆特性有密切关系。通过人工模拟林木自然生长可能发生的逆境条件,利用林木生理生化在逆境条件下的这种内在规律性响应,对林木测定材料开展苗期甚至各个生长阶段的评价,取得了一系列的成果。乌风章等[19]研究了低温胁迫对白桦生长和生理的影响,冯献宾等[20]研究了低温胁迫对黄连木抗寒生理指标的影响,李晶等[21]研究了低温胁迫下红松幼苗活性氧的产生及保护酶的变化。上述研究都达到了预期的目标。
值得注意的是,生理指标的选择非常关键,单用一个指标很难说明植物复杂的抗性数量性状;只有采用多个指标进行综合评价,才能客观地反映植物的抗寒生理过程;但也不是指标越多越好,而且根据不同树种特性,指标选择会有所不同。张卫华等[22]评估相思的抗旱性时测定了9个生理指标,主成分分析发现,相对电导率、水分指标、游离脯氨酸和可溶性糖质量分数占了影响因子的88.64%,其中相对电导率又是最主要的影响因子。冯建灿等[23]研究了低温胁迫对喜树幼苗SOD活性、MDA质量摩尔浓度和脯氨酸质量分数的影响,认为叶片内脯氨酸质量分数的高低可作为衡量喜树抗寒性指标。Zhou et al.[24]研究过柚木无性系,测定了CHL、SPRO、SOD、POX和MDA五个生理指标,发现SOD活性适合作为评价柚木无性系抗寒性的生理指标。本研究作者前期试验通过生理指标测定过一批柚木无性系的抗寒性,测定的指标包括相对电导率、游离脯氨酸质量分数、SOD活性、MDA质量摩尔浓度和可溶性糖、叶绿素质量分数,发现相对电导率、脯氨酸质量分数、SOD活性更加符合柚木无性系大田寒害调查的结果(未发表),三者适合作为柚木生理评价的指标体系。
据报道,抗寒性强的柚木无性系可耐2 ℃的最低温[24],一般持续0 ℃或霜冻后即出现严重的冻害死亡现象。本研究合理地选择了6 ℃和3 ℃进行无性系早期评估和筛选研究。从冷害处理前后柚木无性系间相对电导率的数值变化和方差显著性来看,在6 ℃低温处理后,柚木无性系即已经对冷害产生了明显的生理反应,而3 ℃低温冷害后柚木无性系间的相对电导率差异显著增加,则说明了3 ℃是柚木生长的敏感温度,长时间在3 ℃及以下环境,柚木叶片因冷害而导致细胞受损,生长必将受到抑制,甚至叶片和顶芽脱落,更严重时植株顶端甚至整株死亡。SOD活性也印证了对柚木生长来说,3 ℃是比6 ℃更为敏感的温度,而6 ℃是柚木冷害生理反应温度。低温胁迫后,部分柚木无性系通过增加游离脯氨酸质量分数和SOD活性来调节提高自身的抗寒性,但如果随着温度继续降低,低温胁迫已超过了其自身调节能力,就会出现冷害甚至冻害。
本研究分析了冷害处理前后柚木无性系相对电导率、游离脯氨酸质量分数和SOD活性3个生理指标的变化过程的基础上,从单个指标评定了柚木无性系的抗寒性,最后在3个指标的基础上,采用欧几米德多向量理论综合评定法综合评定了不同柚木无性系间的抗寒性,初步筛选出抗寒性强的柚木无性系7559、7531、Z408,其次较耐寒的柚木无性系有7509、7544和7514。本研究所筛选出来的耐寒柚木无性系均选自缅甸种源,这和李运兴等[8]报道的缅甸种源抗寒性高于印度种源的结果一致。
然而,从单个测定的3个生理指标来看,相对电导率和游离脯氨酸质量分数的分析结果认为,无性系7137和7219抗寒性都较强,SOD活性的分析结果认为,无性系7137抗寒性较强,而7219不抗寒;综合评定的结果中,7137抗寒性排第6,7219抗寒性排第9。故认为,7137和7219可能是印度种源无性系中相对抗寒的无性系,但这也有待进一步的研究或大田的寒害调查结果来加以验证。但总的来说,选自印度种源的柚木无性系不抗寒,对立地气候温度条件的要求较高。因此,本研究为柚木无性系的推广应用提供了科学依据。
[1] White K J. Teak: some aspects of research and development[M]. Yangon: San Thain Kha Press,1991:70.
[2] 中国树木志编委会.中国主要树种造林技术[M].北京:中国林业出版社,1981:846-851.
[3] 刘鹏,杨家驹,卢鸿俊.东南亚热带木材[M].北京:中国林业出版社,1993:280.
[4] Alcantara B K, Veasey E A. Genetic diversity of teak (TectonagrandisL. F.) from different provenances using microsatellite markers[J]. Revista Arvore,2013,37(4):747-758.
[5] 周铁烽.中国热带主要经济树木栽培技术[M].北京:中国林业出版社,2001:288-291.
[6] 邝炳朝,郑淑珍.我国柚木的遗传改良[J].林业科学研究,1991,4(2):139-146.
[7] Korkmaz A, Dufault R J. Developmental consequences of cold temperature stress at transplanting on seedling and field growth and yield[J]. Journal of the American Society for Horticultural Science,2001,126(4):404-409.
[8] 李运兴,梁坤南,马华明,等.柚木寒害调查与防护措施[J].林业实用技术,2010(3):27-30.
[9] 梁坤南,周再知,马华明,等.我国珍贵树种柚木人工林发展现状、对策与展望[J].福建林业科技,2011,38(4):173-178.
[10] He Kaiyue, Li Xiaochu, Huang Libin, et al. A study on variations of physiological indices of cold resistance in fukiencypres[J]. Journal of Nanjing Forestry University: Natural Sciences Edition,2002,26(5):10-14.
[11] 张富山,李磊,穆立蔷,等.科罗拉多云杉种下3类群对低温胁迫的适应性[J].东北林业大学学报,2010,38(9):4-6.
[12] 张卫华,张方秋,徐大平,等.三种相思树种的耐寒性评估[J].林业科学研究,2008,21(6):842-846.
[13] 陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2010:64-65.
[14] 郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004:104-106.
[15] Giannopolitis C N, Ries S K. Superoxide dismutase II. Purication and quantitative relationship with water-soluble protein in seedlings[J]. Plant Physiology,1997,59:315-318.
[16] 王相娥,薛立,谢腾芳,等.低温处理对6种园林绿化树种幼苗生理生化的影响[J].南京林业大学学报:自然科学版,2009,33(3):139-142.
[17] Huner N P, Oquist G, Sarhan F. Energy balance and acclimation to light and cold[J]. Trends in Plant Science,1998,3(6):224-230.
[18] Mckersie B D, Chen Y, Debeus M, et al. Superoxide dismutase enhances tolerance to freezing stress in transgenic alfalfa (MedicagosativaL.)[J]. Plant Physiology,1993,103:1155-1163.
[19] 乌风章,王柏臣,刘桂丰,等.低温胁迫对白桦幼苗生长和生理的影响[J].东北林业大学学报,2008,36(9):8-10.
[20] 冯献宾,董倩,王洁,等.低温胁迫对黄连木抗寒生理指标的影响[J].中国农学通报,2011,27(8):23-26.
[21] 李晶,阎秀峰,祖元刚.低温胁迫下红松幼苗活性氧的产生及保护酶的变化[J].植物学报,2000,42(2):148-152.
[22] 张卫华,张方秋,张守攻,等.3种相思幼苗抗旱性研究[J].林业科学研究,2005,18(6):695-700.
[23] 冯建灿,张玉洁,杨天柱.低温胁迫对喜树幼苗SOD活性、MDA和脯氨酸的影响[J].林业科学研究,2002,15(2):197-202.
[24] Zhou Zaizhi, Ma Huaming, Liang Kunnan, et al. Improved tolerance of teak (TectonagrandisL. f.) seedlings to low-temperature stress by the combined effect of arbuscular mycorrhiza and paclobutrazol[J]. Journal of Plant Growth Regulation,2012,31(3):427-435.
Chilling Physiological Estimate and Early Selection ofTectonagrandisL. f. Clones at Seedling Stage//
Huang Guihua, Liang Kunnan, Zhou Zaizhi, Ma Huaming, Du Jian
(Research Institute of Tropical Forestry, Chinese Academy of Forestry, Guangzhou 510520, P. R. China)//Journal of Northeast Forestry University,2015,43(9):12-17.
The potted seedlings of different teak (TectonagrandisL. f.) clones were cultured at 6 ℃ for 24 h, and then 3 ℃ for 24 h to estimate chilling resistance of different teak clones, and the relative conductivity (EC), free proline (FPRO) content and superoxide dismutase (SOD) activity were measured for leaves of each tree before and after treatments. Three physiological indexes had significant and highly significant difference between teak clones before and after treatments except SOD activity after the treatment of 6 ℃ for 24 h. The relative conductivity and free proline content increased after chilling stress, SOD activity increased for some clones first, and then decreased, while others were inverse. Some teak clones became more cold resistant by increasing FPRO content and SOD activity. The teak clones 7559, 7531 and Z408 were screened by chilling resistance capacity, followed by clones 7509, 7544 and 7514. Myanmar teak provenances have higher chilling tolerance than India teak provenances.
TectonagrandisL. f.; Clone; Physiological response; Chilling resistance; Early selection
1)国家“十二五”科技支撑项目(2012BAD21B01)。
黄桂华,男,1979年8月生,中国林业科学研究院热带林业研究所,副研究员。E-mail:hghcom@sina.com。
梁坤南,中国林业科学研究院热带林业研究所,研究员。E-mail:chinateak@163.net。
2015年3月11日。
S723.1+33;Q945.78
责任编辑:任 俐。

