不同花生品种对旱涝胁迫的响应及生理机制
刘登望, 王建国, 李 林,3,*, 谭红姣, 马 杰, 卢 山
1 湖南农业大学旱地作物研究所, 长沙 410128 2 湖南农业大学农学院, 长沙 410128 3 湖南农业大学生物科技学院, 长沙 410128
不同花生品种对旱涝胁迫的响应及生理机制
刘登望1,2, 王建国1,2, 李 林1,2,3,*, 谭红姣1,3, 马 杰1,3, 卢 山1,2
1 湖南农业大学旱地作物研究所, 长沙 410128 2 湖南农业大学农学院, 长沙 410128 3 湖南农业大学生物科技学院, 长沙 410128
为评价花生对旱、涝胁迫的响应,本试验以4个旱、涝耐性差异明显的花生品种为材料,运用温室防雨盆栽方法,在苗期、花针期分别进行正常灌溉(对照)、干旱(7d,叶片萎蔫)、根部淹涝(土面水深2 cm,时间1d、3d、7d)和整株淹涝(水深至苗顶,时间1d、3d、7d)的处理,测定地上部及根系生物量、根冠比、根系活力、叶片超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量。结果表明,苗期、花针期干旱均抑制地上部生长,提高根冠比;苗期干旱降低根系生物量,而花针期增加。2个时期淹涝均促进地上部生长、抑制根系生长、降低根冠比,并随淹水加深、延时而加重。旱、涝条件下根系活力均降低,SOD、MDA呈上升趋势。遭受相同时间(7d)的水分胁迫后,危害程度以干旱重于淹涝,花针期重于苗期。基于生物量、生理指标变化的综合分析进一步表明,4个花生品种的旱、涝耐性差异很大,湘花55号耐旱性强、耐涝性弱,豫花15号耐旱性弱、耐涝性强,中花4号耐旱、涝性均最弱,中花8号耐旱、涝性均最强。
花生; 生物量; 根冠比; 根系活力; SOD; MDA
我国花生多分布在北部温带到南部热带的季风气候区,年降雨330—1800 mm,降水的时空分配不均[1]。随着全球气候变化加剧,我国花生旱、涝灾害呈现出频度增高、危害加重、复杂多变的趋势,非旱即涝,难以出现风调雨顺的年成,其中北方产区多为前旱后涝,南方产区多为前涝后旱,甚至连续旱涝,近年北方涝害有加重趋势[2- 6]。国内外大量研究表明,花生耐旱性较强,但长期少雨、季节性干旱仍然是限制花生产量的重要生态因子[7- 14]。据统计,全国三分之二的花生面积常年遭受干旱威胁,平均减产20%以上[10]。淹涝多发生于多雨地区和低洼地带,虽不及旱灾广泛,但属于隐性灾害,其危害程度、后果不易察觉,因而世界花生淹涝研究起步较晚,一般认为,淹涝对花生生长环境、营养吸收、形态与产量建成、生理生化等产生广泛影响,花生受涝时一般减产20%—30%,与其他作物比较,花生耐涝性中等[15- 22]。筛选耐旱、耐涝种质,开展相关生态育种是提高水分胁迫条件下我国花生产量的有效手段[4,14,19]。花生耐旱的生理机制研究较多[7- 14],然而关于花生遭受旱、涝危害孰轻孰重、不同基因型与生育时期的旱、涝响应差异如何?旱、涝耐性机理上有无异同?这些均鲜见报道。本试验采用温室防雨盆栽方法,选取4个具有旱、涝耐性差异的花生品种,在苗期和花针期进行旱、涝胁迫与正常供水处理,测定植株生物量、根系活力、抗氧化保护酶活性、膜脂过氧化产物等指标,比较不同基因型花生对旱、涝胁迫的响应并进行耐性鉴定评价,探讨旱、涝耐性生理的异同之处,为培育旱、涝兼耐型花生新品种、制定易旱或多涝地区花生减灾避灾栽培技术体系、抵御非旱即涝的高频度自然灾害以及评估旱涝成灾程度提供理论依据。
1 材料与方法
1.1 试验材料
供试材料为4个经大田产量鉴定具有旱、涝耐性差异的花生品种[4]:湘花55号(旱耐涝中)、豫花15号(旱敏涝耐)、中花4号(旱涝皆不耐)、中花8号(旱涝皆耐)。试验材料在湖南农业大学植物激素与生长发育湖南省重点实验室的防雨温室中培养,光照、温度按照自然天气状况进行实时控制。
1.2 试验设计
精选大小一致、完好无损的典型花生种子备用。在直径35 cm、深度40 cm的培养钵中装满沙土(含水量为田间持水量的60%左右),每个钵中播放10粒种子(播深3cm),在正常水分条件下发芽,齐苗后定苗6株。在苗期(4叶1心期)、花针期(50%植株扎针入土)进行水分胁迫处理。试验设置苗期和花针期分别为正常浇水、干旱7d、根部淹涝(简称根淹)1d、3d、7d和整株淹涝(简称株淹)1d、3d、7d。淹涝处理方法:在温室中将淹涝处理的培养钵套入直径50 cm、深度90 cm的白色塑料大桶中,根部淹涝时桶内水深保持至土面2 cm左右,整株淹涝时桶内水深保持至淹没植株顶部。淹涝完成后,将培养钵从桶内移出,进行正常的水分管理。每处理4次(钵)重复,随机区组排列。
1.3 测定项目和方法
每次水分胁迫处理完成后,即刻取样测定:地上部与根系的生物量(鲜重、干重)及根冠比采用称重法;根系活力采用TTC法[23];超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)还原法[24];丙二醛(MDA)含量采用硫代巴比妥酸(TBA)反应法[25]。每处理的2钵用于测定生物量,取样方法:从植株下胚轴处剪断,将地上部(茎秆和叶片)、根系分开,立即称取地上部鲜重,再105℃杀青、70℃烘干至恒重,称取干重;根系用自来水小心洗净泥沙后,蒸馏水冲洗3次,吸干水分,称取鲜重,烘干后称干重。另2钵采集倒数第2片完全展开的功能叶,用于测定生理生化指标。
1.4 试验数据处理
运用Excel2003、Spss10.0软件进行数据的整理和作图,采用LSD法进行差异显著性检验(α=0.05)。
2 结果与分析
2.1 旱涝胁迫对花生生物量及根冠比的影响
由表1、表2可知,花生苗期干旱7d使得各品种平均地上部和根系生物量分别下降44.7%、33.8%, 而根冠比各品种平均增加19.6%,增、减幅度均达显著水平(P<0.05)。其中,地上部生物量降幅中花8号<豫花15号<中花4号<湘花55号;根系生物量降幅中花8号<豫花15号<湘花55号<中花4号;根冠比增幅中花8号>湘花55号>中花4号>豫花15号。花针期干旱各品种平均地上部生物量下降45.9%,而根系生物量增长51.8%,根冠比增长高达179.5%,均达显著水平(P<0.05)。其中,地上部生物量降幅品种间相近,以豫花15稍大;根系生物量增幅中花8号>湘花55号>中花4号>豫花15号;根冠比增幅中花8号>湘花55号>豫花15号>中花4号。
与相同处理时间(7d)的干旱比较可知,苗期根淹7d使各品种平均地上部生物量增加18.6%(与干旱的效应相反),根系生物量减少17.6%(降幅低于干旱),根冠比下降30.7%(与干旱相反),增、减幅度均达显著水平(P<0.05)。其中,地上部生物量增幅中花8号>豫花15号>中花4号>湘花55号;根系生物量降幅中花8号<豫花15号<湘花55号<中花4号;根冠比降幅中花8号<湘花55号、豫花15号<中花4号。花针期根淹7d各品种平均地上部生物量增加47.3%,根系生物量下降7.2%,根冠比下降37.0%,影响趋势与苗期一致,只是地上部徒长更明显,根系受影响程度降低。其中,地上部生物量增幅中花4号>豫花15号>中花8号、湘花55号;根系生物量降幅中花8号<豫花15号<湘花55号<中花4号;根冠比降幅中花8号<湘花55号、豫花15号<中花4号。
2.2 旱涝胁迫对花生根系活力的影响
由表3知,苗期、花针期旱、涝使得根系活力均显著降低(P<0.05),并随淹水加深、延时而降幅增大。苗期、花针期干旱7d各品种平均根系活力分别下降53.9%和65.0%,降幅均以中花4号、豫花15号>中花8号>湘花55号;苗期、花针期根淹7d各品种平均根系活力下降34.5%和46.5%,降幅中花4号、湘花55号>中花8号>豫花15号。
2.3 旱涝胁迫对花生叶片SOD活性的影响
由表4可知,苗期或花针期遭受旱、涝时,除豫花15号与中花8号根淹1d外,其他处理的叶片SOD活性均显著升高(P<0.05),并随淹水加深、延时而升幅增大。苗期、花针期干旱7d各品种平均SOD活性分别升高246.6%和255.2%,升幅均以中花4号、豫花15号>中花8号>湘花55号;苗期、花针期根淹7d各品种平均SOD活性升高168.9%和157.6%,升幅湘花55号>中花4号、中花8号>豫花15号。
2.4 旱涝胁迫对花生叶片MDA含量的影响
由图1、图2可知,苗期或花针期受旱时叶片MDA含量显著增加(P<0.05),受涝时随淹水加深、延时而不同程度地增加。苗期、花针期干旱7d各品种平均MDA含量分别升高39.8%和144.2%,升幅苗期以豫花15号>中花8号>中花4号>湘花55号,花针期中花4号>豫花15号>湘花55号>中花8号;苗期、花针期根淹7d各品种平均MDA含量升高34.0%和49.6%,升幅均以中花4号>湘花55号>中花8号>豫花15号。
3 讨论
3.1 花生品种耐旱性差异与耐旱品种选育
植物对干旱的响应具有整体性,耐旱性是多种因素综合作用的性状表现,不同作物、品种的耐旱性差异是同行不同小写字母表示处理间差异显著(P<0. 05);SDB:地上部生物量干重shoot dry biomass;RDB:根系生物量干重root dry biomass;RSR:根冠比root-shoot radio;D7d:干旱7ddrought 7 days;Rw1d:根淹1d root waterlogging 1 day;Rw3d:根淹3d root waterlogging 3 days;Rw7d:根淹7d root waterlogging 7 days;Pw1d:株淹1d plant waterlogging 1 day;Pw3d:株淹3d plant waterlogging 3 days;Pw7d:株淹7d plant waterlogging 7 days
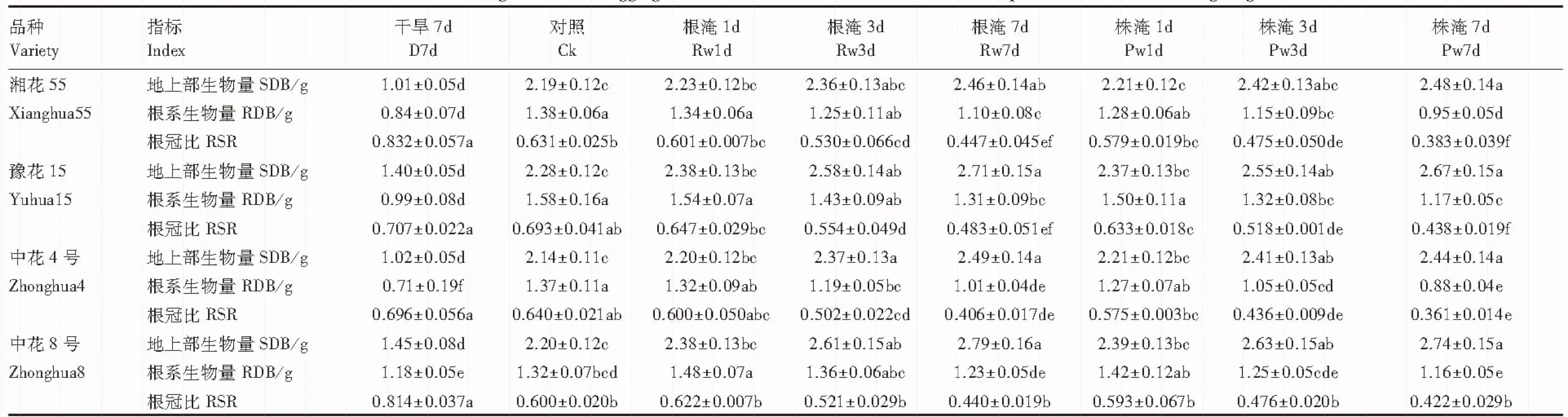
表1 苗期旱涝胁迫对不同品种花生生物量及根冠比的影响

表2 花针期旱涝胁迫对花生生物量及根冠比的影响
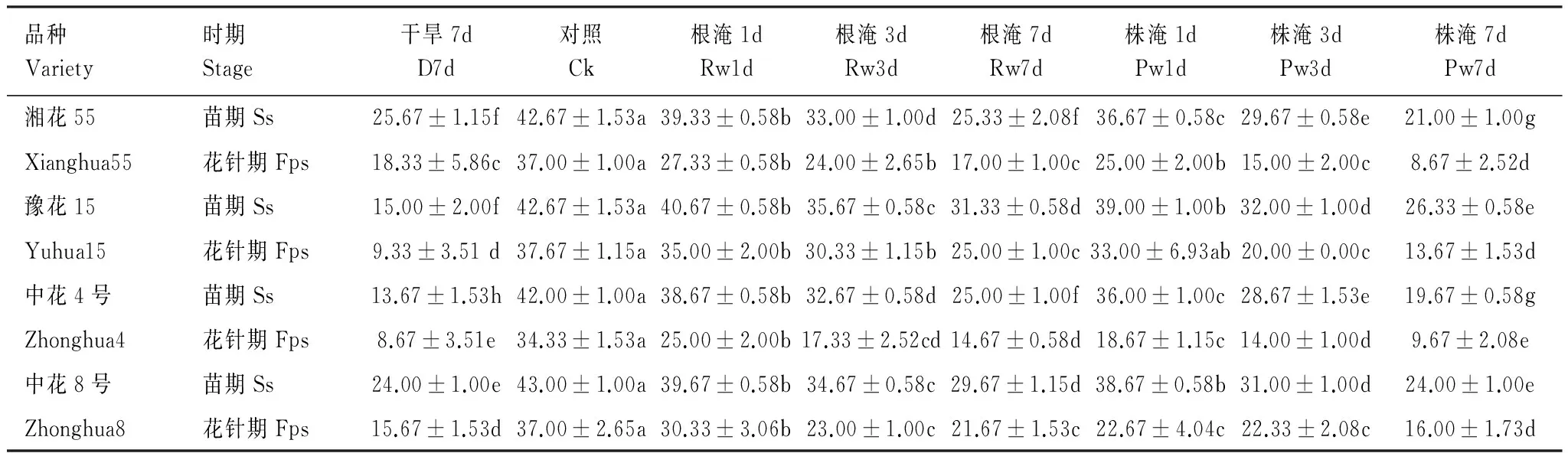
表3 苗期和花针期旱涝胁迫对花生根系活力的影响(μg g-1鲜重 h-1)
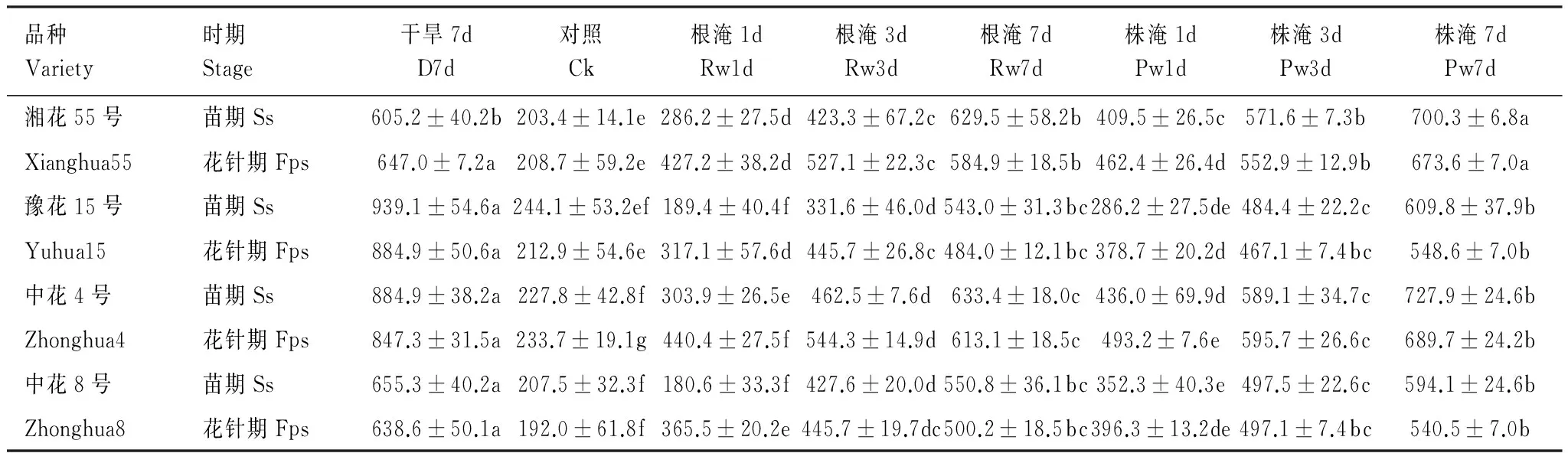
表4 苗期和花针期旱涝胁迫对花生叶片超氧化物歧化酶活性的影响(U/g鲜重)
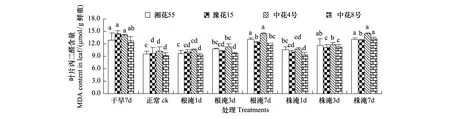
图1 苗期旱涝胁迫对花生叶片丙二醛含量的影响
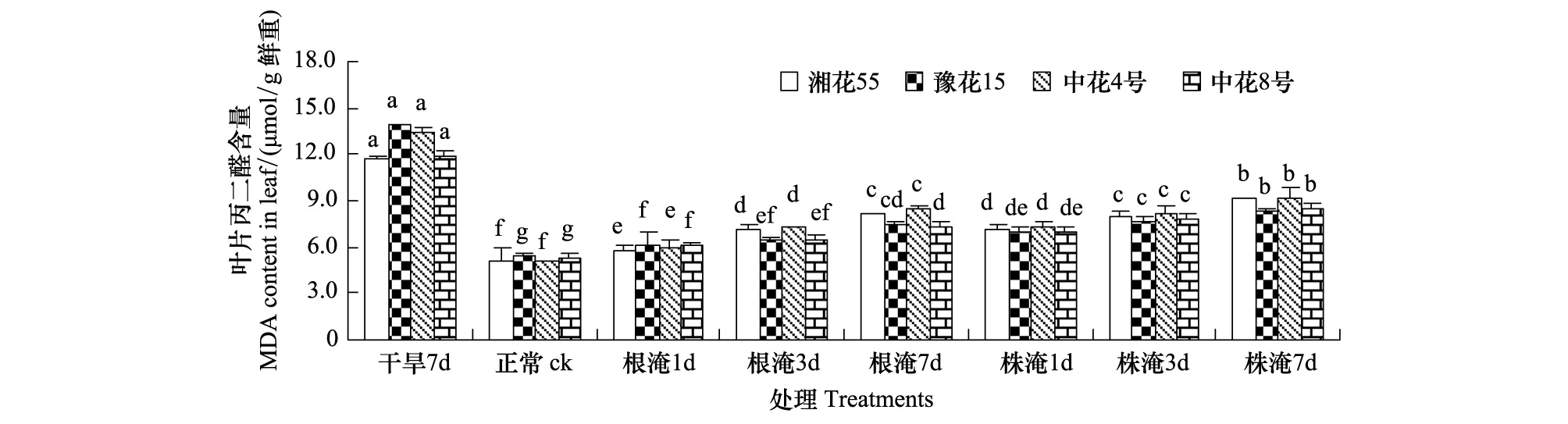
图2 花针期旱涝胁迫对花生叶片丙二醛含量的影响
由自身的遗传特质、结构特性、生理抗性、生长发育节奏以及所处环境因素决定的[8,26]。多数研究认为,植物通过增加根系生物量分配,提高根冠比来适应土壤干旱[27- 28],即一般作物通常表现“旱长根”现象。对于花生而言,一般研究认为耐旱性强,但不同品种、不同生育期对干旱的响应有异,苗期适度干旱有利于根系深扎,提高抗旱性能,有增产效果,而后期尤其花针期干旱影响干物质积累、运转,造成荚果空秕和减产[9]。丁红等[29]研究指出,干旱使敏感品种花育17号花针期、结荚期、饱果期的地上部生物量均降低,而根系生物量、根冠比在花针期、结荚期增加,饱果期则降低;耐旱品种唐科8号地上部生物量、根系生物量无显著差异,根冠比在花针期降低,而结荚期、饱果期增加。张智猛等[14]研究认为,苗期至饱果期连续中度干旱显著影响结荚期、饱果期主茎高、地上部生物量和生理指标,而根冠比增大,且品种间差异明显。本试验结果表明,花生苗期、花针期干旱均抑制地上部的生长,花针期干旱促进根系生长,显著提高根冠比,与前人的结论一致,而苗期干旱抑制根系生长,原因可能是苗期根系入土浅,抗旱性较差,而花针期根系发育较完善,干旱时能深扎,吸水抗旱能力较强。
基于整株生物量的积累及根、冠部的分配状况,品种间耐旱性差异很大,苗期、花针期均以中花8号最强,湘花55号其次,豫花15号、中花4号最弱。相同干旱胁迫条件下不同花生品种响应存在差异,说明耐旱性是由遗传基因和品种特性决定的,这就为筛选耐旱种质及选育耐旱品种提供了可能[14]。
3.2 花生品种耐涝性差异与耐涝品种选育
对花生淹涝影响的评估,应因淹涝程度、品种类型、发育时期、器官部位等而异[20]。张凤[22]研究指出,苗期、开花期及结荚期淹涝均抑制花生地上部生物量积累,正常生理活动受挫,以结荚期影响最重,开花期其次,苗期较小;淹涝显著降低叶片的叶绿素和可溶性蛋白含量,抑制光合作用、荧光作用、根系活力、硝酸还原酶(NR)和谷氨酰胺合成酶(GS)的活性,同时提高叶片的MDA含量、磷酸蔗糖合成酶(SPS)活性及根系乙醇脱氢酶(ADH)活性。研究表明,根系是受涝渍伤害最早、最直接、最严重的部位,幼苗期淹涝造成根系变黑、侧根数减少,所有品种的单株根重、根冠比均大幅降低[17- 20]。本试验发现,花生苗期、花针期淹涝均导致地上部徒长、根系受抑、根冠比降低;受淹涝危害程度,因淹水加深、时间延长而加重,且花针期影响重于苗期,根系活力降幅、SOD与MDA升幅更大,这与一般作物通常出现的“水长苗”现象以及Chung[30]、Matsuoka等[31]研究结果相似。
花生品种间耐涝性差异很大[4,17- 19,22]。本试验结果表明,苗期、花针期耐涝性均以中花8号最强,豫花15号其次,湘花55号第三,中花4号最弱。对18个品种耐涝性的聚类分析结果有较高统一性,说明耐淹涝生态育种是有成效的[4,20]。
3.3 花生耐旱涝生理机制与旱涝兼耐品种选育
不断加剧的全球气候变化使得我国花生生产很少出现风调雨顺的年成,面临更严重挑战,选育旱、涝兼耐的水分广适性品种是有效的应对措施之一[4- 5,18- 19]。花生耐旱的生理机制研究结果基本一致。姜慧芳[10]研究表明,在花针期干旱43d内,胁迫初期叶片SOD活性下降;严重胁迫时SOD 活性增加,抗旱品种比敏感品种增幅更大。严美玲[11]指出,适当干旱可增加花生叶内SOD、POD、CAT活性,MDA增加,提高可溶性蛋白质含量,光合速率下降,解除干旱后MDA降低,光合速率恢复至或超过对照。张智猛[32]研究得知,苗期和花针期降低土壤水分,叶片SOD、CAT活性、渗调物质(可溶性糖、可溶性蛋白质、游离氨基酸、脯氨酸)和MDA含量均有不同程度升高,水分敏感的花针期升幅较大;结荚期水分胁迫初期的抗氧化酶活性升高,但随胁迫时间延长其活性明显降低,而渗透调节物质和 MDA含量显著高于各生育期灌水处理,并认为POD活性变化对灌水处理响应较弱,SOD和CAT是花生适应土壤水逆境的主要保护酶。周西[5]研究表明,在旱、涝急转的胁迫过程中,旱、涝均可使叶片抗氧化酶活性提高,随着胁迫的加深活性降低,复水后活性回落至对照水平,且旱甚于涝;干旱时各品种MDA 含量升高,复水后恢复至对照水平; 而淹涝时MDA 含量呈直线上升趋势,胁迫解除后降低。本研究发现,虽然苗期干旱对花生的危害重于淹涝,花针期淹涝危害大于干旱,但是不论旱、涝胁迫,苗期和花针期的根系活力均降低,叶片SOD活性、MDA含量均显著上升,表明花生对旱、涝逆境可能有某些相似的响应方式或适应机制。可喜的是,通过生长发育、生理生化综合指标的鉴定,已经筛选出旱涝均耐的花生品种中花8号、湘花2008[5]。
4 结论
花生遭受相同时间(7d)的水分胁迫,其危害程度以旱重于涝。干旱对花生的效应因生育期、部位而有所异同:苗期抑制上、下生长,花针期抑上而促下,花针期受干旱影响程度甚于苗期。受干旱影响程度在苗期以地上部最大,根系其次,而根冠比升高;花针期以根冠比最大,根系其次,地上部较小。
淹涝对不同生育期花生的效应相似,均导致地上部徒长、根系受抑、根冠比降低,并随淹水加深、延时而加重,花针期受影响更大。苗期根系受淹涝影响程度大于花针期,而花针期的地上部、根冠比受抑更甚。
4个花生品种的旱、涝耐性差异很大,应根据当地的气候资源特征选育适宜品种。综合生物量、生理指标变化来看,湘花55号耐旱性强、耐涝性弱,适合旱地种植;豫花15号耐旱性弱、耐涝性强,适合在多雨地区种植;中花4号耐旱、涝性均最弱;中花8号耐旱、涝性均最强,水分适应性广。
[1] 孙大容. 花生育种学. 北京: 中国农业出版社, 1998: 424- 445.
[2] 葛道阔, 金之庆. 气候变化对我国花生生产的影响. 江苏农业学报, 1997, 13(1): 55- 59.
[3] 李林, 邹冬生, 刘登望, 刘飞, 张武汉, 孙玉桃, 杨光立. 花生等农作物耐湿涝性研究进展. 中国油料作物学报, 2004, 26(3): 105- 110.
[4] 李林, 邹冬生, 刘登望, 刘飞, 张武汉, 孙玉桃, 周孟辉, 杨光立, 彭科林. 基于产量的花生基因型耐湿涝性综合评价. 中国油料作物学报, 2004, 26(4): 27- 33.
[5] 周西, 李林, 单世华, 刘登望, 周浩, 刘宇. 旱涝急转对不同花生品种生理生化指标的影响. 中国油料作物学报, 2012, 34(1): 56- 61.
[6] 程延年. 未来气候变化对我国花生生产的影响. 花生科技, 1993, (1): 1- 4, 5- 5.
[7] Rao R C N, Wright G C. Stability of the relation between specific leaf area and carbon isotope discrimination across environments in peanut. Crop Science, 1994, 34(1): 98- 103.
[8] 王育红, 姚宇卿, 吕军杰, 李瑜, 刘红旗. 花生抗旱指标研究初报. 干旱地区农业研究, 2002, 20(3): 89- 92.
[9] 万书波. 中国花生栽培学. 上海: 上海科学技术出版社, 2003: 318- 338.
[10] 姜慧芳, 任小平. 干旱胁迫对花生叶片SOD活性和蛋白质的影响. 作物学报, 2004, 30(2): 169- 174.
[11] 严美玲, 李向东, 林英杰, 王丽丽, 周录英. 苗期干旱胁迫对不同抗旱花生品种生理特性、产量和品质的影响. 作物学报, 2007, 33(1): 113- 119.
[12] 周桂元, 李艳, 梁炫强, 李少雄, 洪彦彬, 林坤耀. 节水耐旱花生品种的特征. 花生学报, 2008, 37(2): 32- 34.
[13] 秦立琴, 张悦丽, 郭峰, 万书波, 孟庆伟, 李新国. 强光下高温与干旱胁迫对花生光系统的伤害机制. 生态学报, 2011, 31(7): 1835- 1843.
[14] 张智猛, 万书波, 戴良香, 宋文武, 陈静, 石运庆. 不同花生品种对干旱胁迫的响应. 中国生态农业学报, 2011, 19(3): 631- 638.
[15] Bishnoi N R, Krishnamoorthy H N. Effect of waterlogging and gibberellic acid on leaf gas exchange in peanut (ArachishypogaeaL.). Journal of Plant Physiology, 1992, 139(4): 503- 505.
[16] Bishnoi N R, Krishnamoorthy H N. Effect of gibberellic acid on stomatal diffusive resistance and photosynthesis in waterlogged peanut plants. Biologia Plantarum, 1993, 35(3): 467- 471.
[17] 刘登望, 李林. 湿涝对幼苗期花生根系ADH活性与生长发育的影响及相互关系. 花生学报, 2007, 36(4): 12- 17.
[18] 李林, 刘登望, 邹冬生, 刘飞. 自然湿涝条件下花生种质主要性状与产量的相关性. 中国油料作物学报, 2008, 30(1): 62- 70.
[19] 李林, 刘登望, 熊璟, 邹冬生, 肖浪涛, 王若仲, 刘飞, 赵伟, 覃国栋, 朱旭东. 花生生育早期耐涝性室内鉴定对大田期的意义. 作物学报, 2008, 34(3): 477- 485.
[20] 刘登望, 李林, 邹冬生, 刘飞. 湿涝胁迫对不同种质花生生长和农艺性状的影响. 中国生态农业学报, 2009, 17(5): 968- 973.
[21] 王才斌, 万书波, 王铭伦. 花生生理生态学. 北京: 中国农业出版社, 2011: 352- 367.
[22] 张凤. 淹水对花生生理特性及产量、品质的影响 [D]. 泰安: 山东农业大学, 2012.
[23] 李合生, 孙群, 赵世杰. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2003: 119- 120.
[24] 王爱国, 罗广华, 邵从本, 吴淑君, 郭俊彦. 大豆种子超氧化物歧化酶的研究. 植物生理学报, 1983, 9(1): 77- 84.
[25] 林植芳, 李双顺, 林桂珠, 孙谷畴, 郭俊彦. 水稻叶片的衰老与超氧物岐化酶活性及脂质过氧化作用的关系. 植物学报, 1984, 26(6): 605- 615.
[26] Givnish T J. Adaption to sun and shade: a whole-plant perspective. Australian Journal of Plant Physiology, 1988, 15(2): 63- 92.
[27] Smucker A J M, Aiken R M. Dynamic root responses to water deficits. Soil Science, 1992, 154(4): 281- 289.
[28] 李树华, 许兴, 米海莉, 何军, 魏玉清, 王具红. 水分胁迫对牛心朴子植株生长及渗透调节物质积累的影响. 西北植物学报, 2003, 23(4): 592- 596.
[29] 丁红, 张智猛, 戴良香, 康涛, 慈敦伟, 宋文武. 干旱胁迫对花生根系生长发育和生理特性的影响. 应用生态学报, 2013, 24(6): 1586- 1592.
[30] Chung S H, Hwang H B, Lee J P, Lee S B, Choi D W, Son S G, Kang K H. Effect of inundation and its frequency due to flood at the Nakdong river basin on growth and yield in peanut plant. Research Reports of the Rural Development Administration of Crops, 1987, 29(1): 270- 277.
[31] Matsuoka N, Nakayama K, Kon H. Characteristics of whole plant submerging damage and root submerging damage on peanut(ArachishypogaeaL.). Technical Bulletin of Faculty of Horticulture Chiba University, 1993, 47: 189- 193
[32] 张智猛, 宋文武, 丁红, 慈敦伟, 康涛, 宁堂原, 戴良香. 不同生育期花生渗透调节物质含量和抗氧化酶活性对土壤水分的响应. 生态学报, 2013, 33(14): 4257- 4265.
Responses of different peanut cultivars to drought and waterlogging stress and physiological mechanism
LIU Dengwang1,2, WANG Jianguo1,2, LI Lin1,2,3,*, TAN Hongjiao1,3, MA Jie1,3, LU Shan1,2
1InstituteofUplandCrops,HunanAgriculturalUniversity,Changsha410128,China2CollegeofAgronomy,HunanAgriculturalUniversity,Changsha410128,China3CollegeofBioscience&Biotechnology,HunanAgriculturalUniversity,Changsha410128,China
To evaluate the responses of peanut to drought and waterlogging stresses, biomass of shoot and root, root-shoot ratio, root activity, SOD activity and MDA content in leaves at seedling and flowering-pegging stages were determined. A pot experiment with four different drought-waterlogging tolerance cultivars was conducted in rainproof greenhouse. Four water treatments were carried out as follows: normal irrigation (CK), drought (7d, leaf wilting), root waterlogging (1d, 3d and 7d, 2cm of water-depth over soil surface) and whole plant waterlogging (1d, 3d and 7d, water-depth over the canopy of plant). The results showed that drought stress decreased shoot dry biomass (SDB) and increased root-shoot ratio (RSR) at seedling and flowering-pegging stages, reduced root dry biomass (RDB) at seedling stage whereas elevated at flowering-pegging stage. Waterlogging stress accelerated SDB, reduced RDB and RSR at both stages, and the effects of it aggravated with increase of water level and progress of time. For all cultivars, root activity decreased, but SOD activity and MDA content in leaf increased under drought and waterlogging conditions. After same time (7d) of water stresses, damage suffering from drought was much heavier than that from waterlogging, while that at flowering-pegging stage was much heavier than at seedling stage. Comprehensive analysis based on changing of biomass and physiological indexes further revealed that there was large difference in drought and waterlogging tolerance among cultivars: Xianghua 55 had higher tolerance to drought and lower to waterlogging, Yuhua 15 had lower tolerance to drought and higher to waterlogging, Zhonghua 4 had the lowest tolerance to the two stresses, while Zhonghua 8 had the highest.
peanut (ArachishypogeaeL.);biomass;root-shoot ratio; root activity;SOD;MDA
国家科技支撑计划项目(2014BAD11B04); 国家现代农业产业技术体系建设专项资金(CARS- 14)
2013- 09- 27;
2014- 08- 22
10.5846/stxb201309272375
*通讯作者Corresponding author.E-mail: lilindw@163.com
刘登望, 王建国, 李林, 谭红姣, 马杰, 卢山.不同花生品种对旱涝胁迫的响应及生理机制.生态学报,2015,35(11):3817- 3824.
Liu D W, Wang J G, Li L, Tan H J, Ma J, Lu S.Responses of different peanut cultivars to drought and waterlogging stress and physiological mechanism.Acta Ecologica Sinica,2015,35(11):3817- 3824.

