福寿螺和田螺消化酶活性比较
罗明珠, 章家恩,*, 胡九龙, 赵本良
1 华南农业大学农学院, 广州 510642 2 华南农业大学热带亚热带生态研究所, 广州 510642 3 华南农业大学兽医学院, 广州 510642
福寿螺和田螺消化酶活性比较
罗明珠1,2, 章家恩1,2,*, 胡九龙3, 赵本良1,2
1 华南农业大学农学院, 广州 510642 2 华南农业大学热带亚热带生态研究所, 广州 510642 3 华南农业大学兽医学院, 广州 510642
为比较福寿螺(Pomaceacanaliculata(Lamarck, 1828))和当地中国圆田螺(Cipangopaludinachinensis(Gray, 1832))消化能力的差异,探索福寿螺成功入侵的机制,以田螺为对照,测定了1—4龄的福寿螺和田螺的胃和肝脏的消化酶——纤维素酶(羧甲基纤维素法)、淀粉酶(3,5-二硝基水杨酸法)和脂肪酶(滴定法)的活性。结果表明:1) 相同年龄的福寿螺胃和肝脏中的消化酶活性明显高于田螺。其中,纤维素酶活性分别高出1.00—2.11倍、1.66—2.84倍;淀粉酶活性分别高出1.53—3.47倍、1.47—1.80倍;脂肪酶活性分别高出2.07—4.73倍、6.13—9.93倍。2)在生长发育过程中,福寿螺胃和肝脏中的消化酶活性变化幅度(51.2%—131.2%)明显高于田螺(23.3%—47.1%)。3)福寿螺的各种消化酶之间存在协同作用。如福寿螺的淀粉酶活性与脂肪酶活性呈极显著正相关(胃中r=0.736**、肝脏中r=0.867**)。此外,胃中的淀粉酶活性还与纤维素酶活性呈显著正相关关系(r=0.696*)。相应地,田螺胃中的淀粉酶和脂肪酶之间也存在显著的正相关关系(r=0.706*),而肝脏中的纤维素酶与脂肪酶活性呈显著负相关(r=-0.593*)。4)福寿螺对纤维素类和淀粉类物质都有较强的消化能力,且能较好地消化脂肪类物质,而田螺能消化纤维素类和淀粉类物质,对脂肪的消化能力却很弱。福寿螺的纤维素酶和淀粉酶活性分别是田螺的2.42和1.88倍,脂肪酶活性达到了5.66倍。可见,福寿螺具有较高的消化酶活性,且各消化酶之间存在正协同性。这可能是导致福寿螺食量大、食性杂,使其能快速生长和成功入侵的重要原因之一。
福寿螺(Pomaceacanaliculata(Lamarck, 1828); 田螺(Cipangopaludinachinensis(Gray, 1832));纤维素酶;淀粉酶;脂肪酶; 胃; 肝脏
福寿螺(Pomaceacanaliculata(Lamarck, 1828)),又名大瓶螺、苹果螺,两栖淡水贝类软体动物,隶属于软体动物门(Mollusca)腹足纲(Gastropoda)前鳃亚纲(Prosobranchia)中腹足目(Mesogastropoda)瓶螺科(Ampullariidae)瓶螺属(Pomacea),原产于南美洲亚马逊河流域,20世纪70年代被引入中国台湾,80年代作为一种食物被先后引入到日本、菲律宾、越南、泰国等亚洲国家。1981年被引入广东[1],1984年起广为养殖,并迅速扩散到广西、福建、海南、浙江、上海、江苏、湖南、贵州等地。由于人们对福寿螺的生物学特性、营养价值、市场前景及其危害性缺乏很好地认识,盲目引进,但终因其食味不佳,而被随意遗弃到水沟、田间,结果出现了福寿螺种群暴发,并难以控制的局面,目前已成为水稻生产中危害最严重的恶性水生动物[2]。近十几年来,福寿螺对入侵地水稻[3]、水生植物[4]、农业生态系统[5]和生物多样性[6]等造成了严重破坏。有研究指出,福寿螺入侵对本地螺也产生巨大危害,可吞食扁卷螺(Planorbiscaenosus)[6]、小椎实螺(Austropepleaollula)、藁杆双脐螺(Biomphalariastraminea)、瘤拟黑螺(Melanoidestuberculata)、尖膀胱螺(Physaacuta)、石田螺(Sinotaiaquadrata)[7]等多种淡水螺,也吃小虾[8],导致大量本地物种的减少或彻底消失[9]。2000年,国际自然保护联盟(International Union for Conservation of Nature,IUCN)外来入侵物种专家委员会就将福寿螺列为世界100种恶性外来入侵物种之一[10]。2003年3月,国家环保总局将福寿螺列入首批入侵我国的16种外来物种“黑名单”[11]。
作为一种入侵性物种,福寿螺具有适应能力强[12]、繁殖能力强[13]、食量大、生长迅速[14]等特性。其中,福寿螺食性杂、食量大等生物学特性可能与其消化能力存在一定的关系。目前,有关福寿螺消化酶的研究主要集中在纤溶酶的分离纯化及其活性[15- 16]、纤维素酶的酶学性质[17]、糖基水解酶基因的克隆和表达[18]等方面。徐建荣等[19]发现福寿螺消化道中纤维素酶和果胶酶活性较高,而肝脏中淀粉酶活性较高。国内外关于圆田螺的研究主要集中在神经系统[20]和生殖系统的解剖[21]、显微镜观察[22- 23]以及其营养分析[24- 25]、开发利用[26- 27]和其寄生虫——管圆线虫的调查和研究[28- 29],仅有段旭等[30]研究松墨天牛和中国圆田螺(Cipangopaludinachinensis(Gray, 1832),俗称螺蛳、田螺等,隶属于软体动物门(Mollusca)腹足纲(Gastropoda)中腹足目(Mesogastropoda)田螺科(Viviparidae)圆田螺属(Cipangopaludina)(以下简称田螺))体内纤维素酶系的组成和活性,表明两者体内均具有将纤维素降解为简单糖的完整纤维素酶系,且松墨天牛体内纤维素酶系中各组分的活性均较中国圆田螺高。有关对比分析外来入侵物种福寿螺和本地螺——中国圆田螺的消化酶活性差异的研究报道未见涉及。因此,本研究通过揭示福寿螺和田螺肝脏和胃中消化酶活性的变化规律及差异的对比分析,探讨福寿螺食性杂、食量大的可能原因,旨在从消化能力角度和蛋白质水平来揭示其成功入侵的相关机理,进而为开展福寿螺的针对性防控提供理论支持。
1 材料和方法
1.1 实验材料
2010年5—10月,从广州郊区的水沟和稻田中采集福寿螺和田螺样本带回实验室,并根据福寿螺和田螺厣上一圈圈的同心环纹[31],将螺分为1—4龄螺,厣上有1圈清晰的同心环纹定为1龄螺,有2圈清晰的同心环纹定为2龄螺,依此类推。
1.2 样品的制备
将福寿螺和田螺在实验室水族箱中饲养,实验前让供试螺空腹48 h。实验时尽量将螺所携带水分吸干,置于冰浴中,解剖,取出胃与肝脏,剔除多余脂肪及其它物质,用滤纸吸干,每处理取10只螺,合并取样。称取0.2 g左右的组织,加入9倍质量的去离子水,匀浆(匀浆器PRO 200);匀浆液离心15 min(10 000 r/min,4 ℃;离心机(Hema TGL-16 R)),取上清液,置于4 ℃冰箱中保存待用(存放时间不超过24 h)[32]。每个测定指标设3次生物学重复,每个样本设3次技术性重复。
1.3 酶活性的测定
1.3.1 纤维素酶活性测定
采用羧甲基纤维素(Carboxymethyl cellulose,CMC)法,具体操作步骤及计算参见王琳等[33]的方法。酶比活力单位设定方法:将每mg组织蛋白在50 ℃、pH值7.0下每分钟催化纤维素水解成1 μmol葡萄糖的酶量定为一个酶活力单位。
1.3.2 淀粉酶活性测定
用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法进行测定[34]。酶比活力单位设定方法:将每mg组织蛋白在最适pH值下每分钟水解淀粉产生1 μmol麦芽糖定为一个酶活力单位。
1.3.3 脂肪酶活性的测定
采用滴定法,参照赵亚华等[35],略有改动。取25 mL三角瓶若干,每瓶加入1.5 mL 0.025 mol/L磷酸缓冲液和1 mL聚乙烯醇橄榄油乳化液,置于40 ℃水浴中保温5 min,然后在两个瓶中各加入2 mL酶液,从加入酶液开始精确计算时间,保温12 h,取出后立即加入95%乙醇3 mL,以终止酶作用,再加(1%麝香草)酚酞指示剂3滴,用0.05 mol/L NaOH溶液滴定至溶液呈粉红色为止。另外两个瓶子不加酶液,作为对照。酶比活力单位设定方法:将1 mL酶液在40 ℃下作用于聚乙烯醇橄榄油乳化液15 min,最后消耗l mL 0.05 mol/L NaOH溶液,定为100个活性单位。
1.3.4 蛋白质含量的测定
采用考马斯亮蓝G- 250法测定蛋白质含量[36]。
1.3.5 数据处理
用SPSS 15.0软件和MS Excel软件进行统计学分析或制作图表。对相同年龄的福寿螺和田螺的消化酶(纤维素酶、淀粉酶、脂肪酶)活性分别进行t检验;对不同年龄的福寿螺或者田螺的消化酶活性进行多重比较;同时对消化酶活性进行多因素方差分析;最后对福寿螺、田螺的消化器官的3种酶活性进行相关性分析。显著水平为P<0.05,极显著水平为P<0.01,数据以平均数±标准误表示。
2 结果2.1 纤维素酶活性比较2.1.1 胃中纤维素酶活性比较
相同年龄福寿螺胃中纤维素酶活性明显高于田螺,其中福寿螺高出田螺1.00—2.11倍(图1)。在4 个年龄段,福寿螺和田螺的胃纤维素酶活性随着螺龄增加都呈现出先升后降的趋势,且均表现为2龄螺活性最高。同种螺中,福寿螺或田螺的2龄螺与其他龄的胃纤维素酶活性差异显著(P<0.05),其中2龄田螺的胃纤维素酶活性是其它龄螺的1.32—1.46倍,2龄福寿螺则是其它龄螺的1.58—2.27倍。福寿螺1龄、3龄和4龄间无显著性差异,田螺的1龄和3龄间无显著性差异,但与4龄有显著差异(P<0.05)。
2.1.2 肝脏中纤维素酶活性比较
与胃纤维素酶活性变化规律类似,在4个年龄段,福寿螺和田螺的肝脏纤维素酶活性都表现出随着螺龄增加先升而后降的趋势,但田螺变化幅度较小。同一年龄段福寿螺肝脏纤维素酶活性均显著高于田螺,如1龄福寿螺肝脏纤维素酶活性是田螺的1.66倍,而3龄的则是2.84倍(图2)。同种螺中,田螺的2龄螺肝脏纤维素酶活性最高,而福寿螺则是3龄螺的酶活性最高。
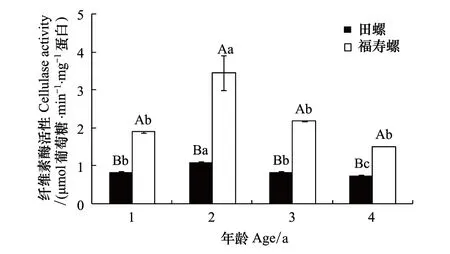
图1 不同年龄福寿螺和田螺胃纤维素酶活性比较
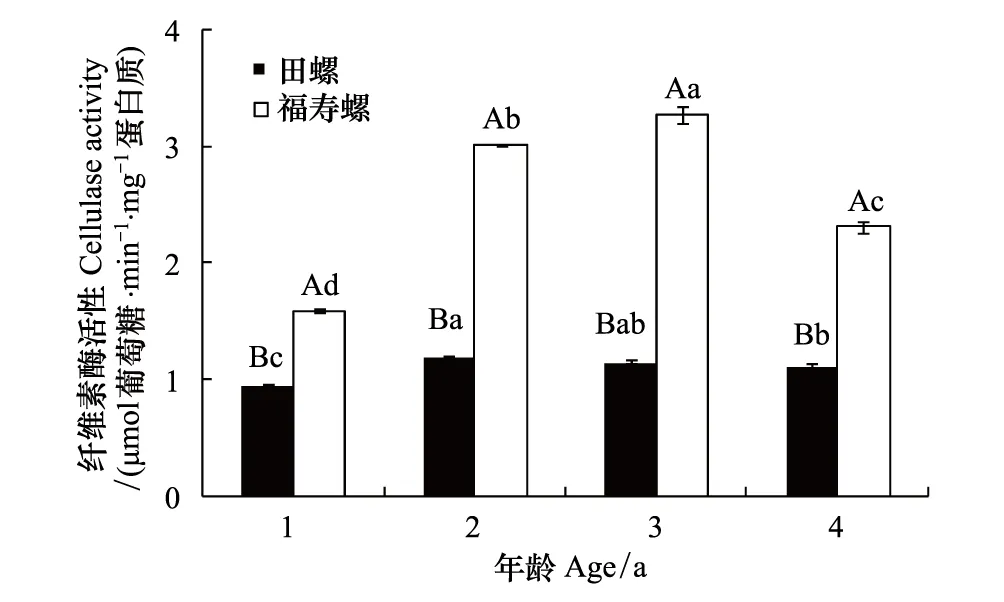
图2 不同年龄福寿螺和田螺肝脏中纤维素酶活性的比较
2.1.3 多因素分析
多因素方差分析结果显示,螺的种类、年龄、器官单因素对纤维素酶活性均有极显著性影响(F统计量值分别为560.536、46.05、17.362,P<0.001)。螺的种类与年龄、年龄与器官交互作用的F统计量值分别为24.819、14.25(P<0.001),螺的种类与器官对纤维素酶活性交互作用的F统计量值为0.272(P=0.606),表明螺的种类与年龄、年龄与器官对纤维素酶活性交互作用极显著,而种类与器官的纤维素酶活性交互作用并不显著。螺的种类、年龄、器官三因素对纤维素酶活性的交互作用极显著(F值=7.265,P=0.001)。
2.2 淀粉酶活性比较
2.2.1 胃中淀粉酶活性比较
在4个年龄段中,同龄福寿螺胃淀粉酶活性均显著高于田螺(P<0.05),其中福寿螺高出田螺1.53—3.47倍(图3)。福寿螺胃的淀粉酶活性在1—4龄段随着螺龄增加都呈现出先升后降的趋势,2龄福寿螺胃淀粉酶活性显著性高于其他龄螺(P<0.05),1龄福寿螺胃淀粉酶活性显著性高于3、4龄螺(P<0.05),2龄螺胃淀粉酶活性是其他龄螺的1.24—1.98倍。田螺的胃淀粉酶活性随着螺龄的增加则呈现先降后升的趋势,1龄田螺胃淀粉酶活性显著性高于其他龄螺(P<0.05),4龄田螺胃淀粉酶活性显著性高于2、3龄螺(P<0.05),2龄螺胃淀粉酶活性是其他龄螺的70%—97%。
2.2.2 肝脏中淀粉酶活性比较
相同年龄福寿螺肝脏的淀粉酶活性明显高于田螺,其中福寿螺高出田螺1.47—1.80倍(图4)。在4个年龄段,田螺和福寿螺肝脏淀粉酶活性随着螺龄的增加都表现出先降后升的趋势,且均为4龄螺活性最高,与其他龄的肝脏淀粉酶活性差异显著(P<0.05)。其中4龄田螺的肝脏淀粉酶活性是其他龄螺的1.18—1.47倍,福寿螺则为1.45—1.51倍。
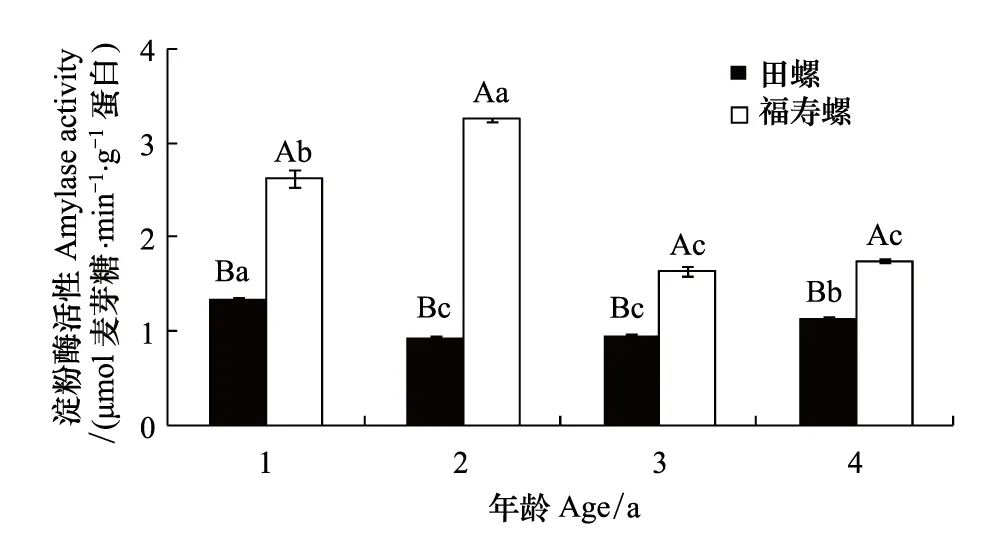
图3 不同年龄福寿螺和田螺胃淀粉酶活性比较
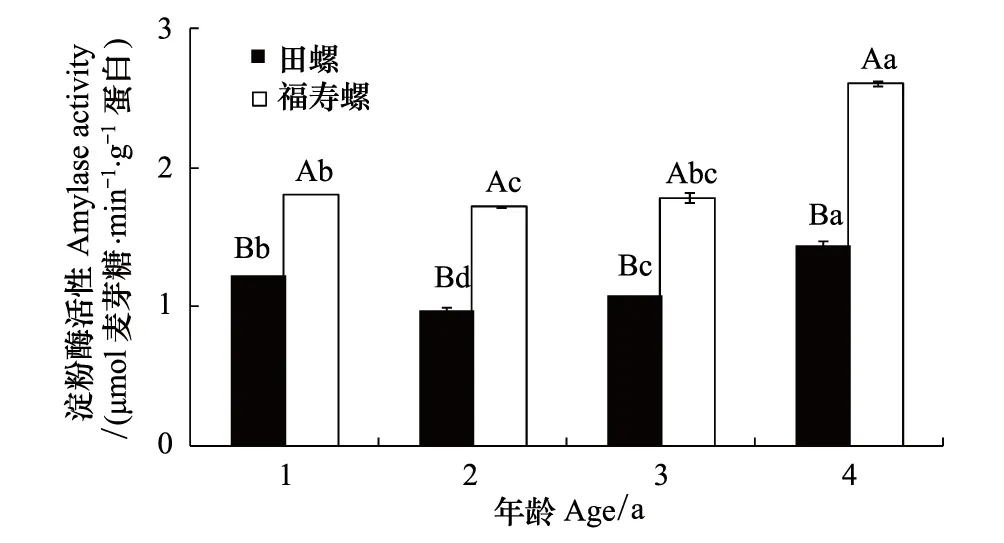
图4 不同年龄福寿螺和田螺肝脏淀粉酶活性比较
2.2.3 多因素分析
多因素方差分析结果显示,螺的种类、年龄、器官单因素的F统计量值分别为3925.977、130.977、60.772(P<0.001),表明它们对纤维素酶活性均有极显著影响。螺的种类与年龄、年龄与器官、种类与器官对纤维素酶活性的交互作用的F统计量值分别为126.855、343.95、178.151(P<0.001),表明这些交互作用均极显著。螺的种类、年龄、器官三因素对纤维素酶活性的交互作用也极显著(F值=206.577,P<0.001)。
2.3 脂肪酶活性比较
2.3.1 胃中脂肪酶活性比较
同一年龄福寿螺胃脂肪酶活性远高于田螺(P<0.01)(图5),其中福寿螺高出田螺2.07—4.73倍。福寿螺胃脂肪酶活性在1—4龄段随着螺龄的增加呈现下降趋势,变化幅度较大,1龄和2龄福寿螺胃脂肪酶活性显著性高于3龄和4龄螺,1龄福寿螺胃脂肪酶活性是其他龄的1.29—2.31倍;田螺胃脂肪酶活性在1—4龄段活性很低、变化幅度较小,1龄田螺胃脂肪酶活性是其他龄的1.01—1.23倍。
2.3.2 肝脏中脂肪酶活性比较
同一年龄下福寿螺肝脏脂肪酶活性均显著高于田螺(P<0.05),其中福寿螺高出田螺6.13—9.93倍。田螺和福寿螺肝脏脂肪酶活性在1—4年龄段随着螺龄增加均呈现先降后升的趋势。2龄田螺肝脏脂肪酶活性显著低于1龄;4龄福寿螺肝脏纤维素酶活性显著高于其它龄的,其中4龄福寿螺肝脏纤维素酶活性是其它龄的1.42—1.69倍,而4龄田螺肝脏纤维素酶活性是其它螺龄的0.93—1.28倍(图6)。
2.3.3 多因素分析
多因素方差分析结果显示,螺的种类、器官单因素的F统计量值分别为726.474、187.276(P<0.001),年龄的F统计量值为5.680(P=0.003),表明螺的种类、器官、年龄对脂肪酶活性均有极显著性影响。年龄与器官、种类与器官交互作用的F统计量值分别为19.085、177.13(P<0.001),表明年龄与器官、种类与器官的脂肪酶活性交互作用极显著;种类与年龄交互作用的F统计量值为3.435(P=0.028),表明种类与年龄的淀粉酶交互作用显著。螺的种类、年龄、器官三因素的交互作用的F统计量值为18.619(P<0.001),表明三因素对脂肪酶活性的交互作用极显著。
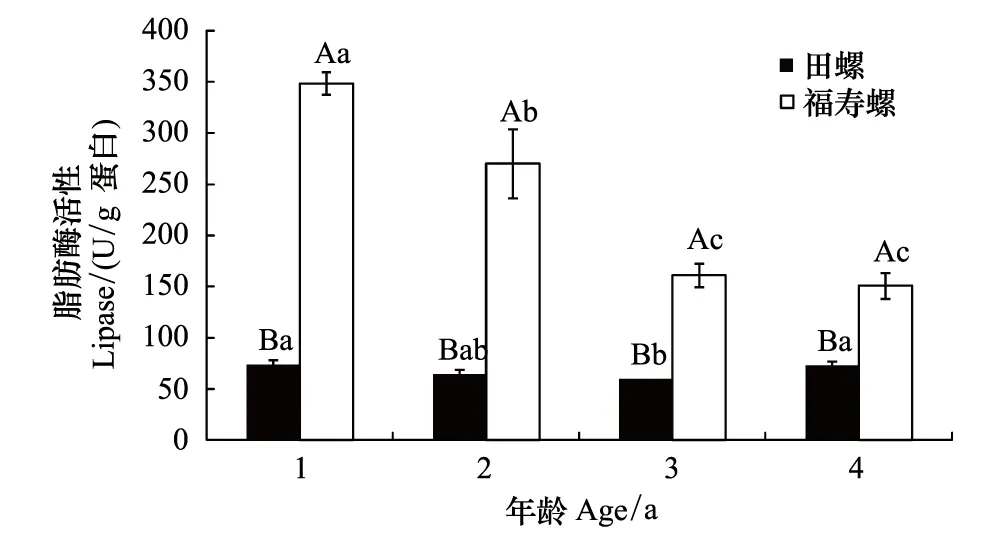
图5 不同年龄福寿螺和田螺胃脂肪酶活性比较
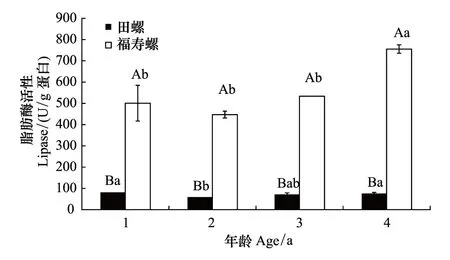
图6 不同年龄福寿螺和田螺肝脏脂肪酶活性比较
2.4 几种消化酶活性的相关性分析
福寿螺胃中淀粉酶活性与纤维素酶活性、脂肪酶活性呈显著或极显著正相关;肝脏中淀粉酶活性和脂肪酶活性也呈极显著性正相关。田螺胃中淀粉酶活性和脂肪酶活性之间也存在显著的正相关,而肝脏中纤维素酶活性与脂肪酶活性呈显著负相关(表1,表2)。其余酶活性之间的相关性不显著。
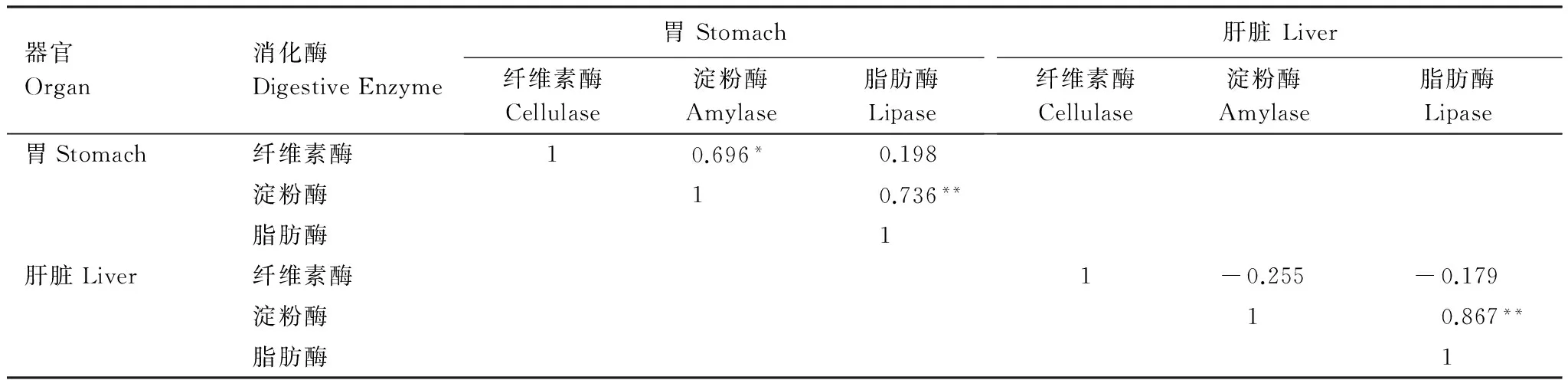
表1 福寿螺3种消化酶活性的相关性分析(n=12)

表2 田螺3种消化酶活性的相关性分析(n=12)
3 讨论与结论
3.1 福寿螺的强消化能力
费志良等[37]发现3种淡水蚌(褶纹冠蚌、背角无齿蚌、三角帆蚌)淀粉酶活性较高,它们对淀粉类物质有强的消化能力。本研究发现,相同年龄的福寿螺胃和肝脏中3种消化酶(纤维素酶、淀粉酶、脂肪酶)活性都明显高于田螺,表明福寿螺对纤维类、淀粉类、脂肪类物质的消化能力强于田螺,这与福寿螺食量远高于田螺的生物学特性一致。同时,在生长发育过程中,福寿螺各种酶活性的变幅较大,幅度在51.2%—131.2%(对应地,田螺仅为23.3%—47.1%)。这可能与其生长发育快相适应。福寿螺生长发育快时其消化酶的活性就大幅度升高,消化能力显著上升,进而能获取更多养分。这可能是其能更好地获取食物能量,快速生长、成功入侵的原因之一。
本研究通过多因素分析表明,消化酶(纤维素酶、淀粉酶、脂肪酶)活性的最主要影响因素是螺的种类,其影响远大于器官间、年龄间消化酶的差异。同时,器官和年龄也是影响消化酶活性的重要因素。前人的研究发现对虾肝脏和肠的淀粉酶活性[38]、肝胰腺的蛋白酶和脂肪酶的活性[39]先逐渐增加,到收获期出现一定程度的下降,而胃淀粉酶活性随生长发育一直增强;鱼类胃、肠的淀粉酶活性随着生长进程不断升高,而后变化不明显[40];而随着牙鲆的生长,胃、肠中蛋白酶、脂肪酶活性增强,淀粉酶活性减弱[41]。本研究发现,在福寿螺和田螺1—4龄的发育过程中胃、肝脏的3种消化酶活性变化规律并不一致,表现为1—2龄螺胃的消化酶活性较高,而3—4龄螺肝脏的消化酶活性较高,这些消化酶活性的变化在一定程度上反映出福寿螺和田螺在不同生长阶段和不同消化器官对食物消化能力的变化。
3.2 福寿螺消化酶之间的正协同性
无论福寿螺还是田螺,同一器官(胃或肝脏)中的淀粉酶与脂肪酶活性呈极显著或显著正相关。福寿螺胃中淀粉酶与纤维素酶活性存在显著正相关,但田螺则表现为负相关。同时,田螺肝脏中纤维素酶与脂肪酶也呈显著负相关。由此可见,福寿螺的消化酶间存在着一定的协同作用。这与张丽丽等[42]关于方斑东风螺胃蛋白酶活性与淀粉酶活性有同步升高或降低趋势的研究结果类似。福寿螺胃和肝脏中消化酶活性的正相关性有利于福寿螺对淀粉类、纤维素类和脂肪类物质的消化,这可能是福寿螺食量大、食性杂的原因之一,进而表现出与本地田螺之间在食物资源方面的竞争优势,有利于其成功入侵。
3.3 福寿螺的杂食性
从总体上看,福寿螺的纤维素酶和淀粉酶活性分别是田螺的2.42和1.88倍,表明福寿螺对纤维素类和淀粉类物质都有更强的消化能力。相对而言,两者的脂肪酶活性差异更为明显,达到了5.66倍,表明福寿螺能更好地消化脂肪类物质,而田螺对脂肪的消化能力很弱。这可能是导致福寿螺和田螺的食性不同的重要原因之一。田螺广泛成群地栖息于水田、湖泊、沼泽、河流等淡水中,主要以多汁的水生植物叶片及藻类为食[8],即主要摄食富含淀粉类物质及纤维类的物质,极少摄食含脂肪的物质。而福寿螺的食谱较广,动植物都吃,喜食水生维管束植物的嫩茎和幼叶[43]。作者在实验过程中发现福寿螺存在“大螺吃小螺”的现象,前人研究也表明福寿螺可摄食扁卷螺[6]、小椎实螺、藁杆双脐螺、瘤拟黑螺、尖膀胱螺、石田螺[7]等多种淡水螺。同时,有研究发现,喂食不同的饲料,会在不同程度上影响鱼类(如鲤鱼、草鱼、鲑鱼、白鲑鱼等)[44]的消化酶活性。因此,福寿螺的杂食性也反过来会影响其各种消化酶的活性,使其保持较高的活性和良好的协同性。
综上可见,福寿螺消化器官中的几种消化酶的高活性及其协同作用与其强大的消化能力和食谱的广泛性是密不可分的,这为福寿螺成功入侵奠定了基础。
[1] 蔡汉雄, 陈日中. 新的有害生物-大瓶螺. 广东农业科学, 1990, (5): 36- 38.
[2] Wada T, Ichinose K, Higuchi H. Effect of drainage on damage to direct-sown rice by the apple snailPomaceacanaliculata(Lamarck) (Gastropod:Ampullariidae). Applied Entomology and Zoology, 1999, 34(3): 365- 370.
[3] Yusa Y, Sugiura N, Ichinose K. Predation on the apple snail,Pomaceacanaliculata(Ampullariidae), by the Norway rat,Rattusnorvegicus, in the field. Veliger, 2000, 43(4): 349- 353.
[4] Baker P, Zimmanck F, Baker S M. Feeding rates of an introduced freshwater gastropodPomaceainsularumon native and nonindigenous aquatic plants in Florida. Journal of Molluscan Studies, 2010, 76: 138- 143.
[5] Carlsson N, Bronmark C, Hansson L A. Invading herbivory: The golden apple snail alters ecosystem functioning in Asian wetlands. Ecology, 2004, 85(6): 1575- 1580.
[6] Cazzaniga N J. Predation ofPomaceaCanaliculata(Ampullariidae) on adultBiomphalariaperegrina(Planorbidae). Annals of Tropical Medicine and Parasitology, 1990, 84(1): 97- 100.
[7] Kwong K L, Chan R K Y, Qiu J W. The potential of the invasive snailPomaceacanaliculataas a predator of various life-stages of five species of freshwater snails. Malacologia, 2009, 51(2): 343- 356.
[8] 张玺, 刘月英. 田螺的形态、习性和我国常见的种类. 生物学通报, 1960, (2): 49- 57.
[9] Yusa Y, Wada T. Impact of the introduction of apple snails and their control in Japan. Naga, 1999, 22(3): 9- 13.
[10] Lowe S, Browne M, Boudjelas S, De Poorter M. 100 of the world′s worst invasive alien species. Auckland, New Zealand: The IUCN/SSC Invasive Species Specialist Group (ISSG), 2000.
[11] 王志高, 谭济才, 刘军, 钟浪. 福寿螺综合防治研究进展. 中国农学通报, 2009, 25(12): 201- 205.
[12] Oya S, Hirai Y, Miyahara Y. Overwintering of the apple snail,Pomaceacanaliculata(Lamarck), in north Kyushu. Japanese Journal of Applied Entomology And Zoology, 1987, 31(3): 206- 212.
[13] Teo S S. Biology of the golden apple snail,Pomaceacanaliculata(Lamarck, 1822), with emphasis on responses to certain environmental conditions in Sabah, Malaysia. Molluscan Research, 2004, 24(3): 139- 148.
[14] Morrison W E, Hay M E. Feeding and growth of native, invasive and non-invasive alien apple snails (Ampullariidae) in the United States: Invasives eat more and grow more. Biological Invasions, 2011, 13(4): 945- 955.
[15] 毛孙忠, 雷康福, 严哲. 福寿螺纤溶酶的分离纯化及其性质研究. 温州医学院学报, 2005, 35(6): 461- 463.
[16] 陈明军, 谭竹钧, 刘兵, 李穗晶, 张冬梅. 福寿螺纤溶活性蛋白的纯化及性质研究. 食品工业科技, 2009, 30(6): 76- 79.
[17] 赵颖, 丁明, 高如丽, 许根俊, 赵辅昆. 福寿螺多功能纤维素酶(EGXA)的结构功能研究. 浙江理工大学学报, 2008, 25(5): 535- 538.
[18] Imjongjirak C, Amparyup P, Sittipraneed S. Cloning, genomic organization and expression of two glycosyl hydrolase family 10 (GHF10) genes from golden apple snail (Pomaceacanaliculata). DNA Sequence, 2008, 19(3): 224- 236.
[19] 徐建荣, 程东成, 李波. 福寿螺消化酶的活力测定研究及其酶解效果分析. 水产养殖, 2007, 28(3): 3- 5.
[20] 孙振中. 中国圆田螺不同发育阶段神经系统的比较解剖. 动物学报, 1963, 15(4): 499- 521.
[21] 金志良. 中国圆田螺生殖系统的初步研究. 动物学报, 1978, 24(4): 388- 398.
[22] Yasuzumi G, Tsubo I, Matsuzaki W. Electron microscope observations on the chemical component of the sheath of the middle piece of atypical spermatozoa of the pond snail,CipangopaludinamalleataReeve. Archivum Histologicum Japonicum, 1970, 31(3): 283- 289.
[23] Yasuzumi G. Spermatogenesis in animals as revealed by electron microscopy. X. The fine structure and function of endoplasmic reticulum and of peculiar bodies appearing in atypical maturing spermatids and nutritive cells ofCipangopaludinamalleataReeve. The American Journal of Anatomy, 1964, 115(3): 431- 471.
[24] 陆红法, 郑善坚, 方美娟, 潘立新, 陈淑芬. 浙江庆元高山薄壳田螺品种鉴定及营养分析. 食品科学, 2013, (17): 309- 312.
[25] Maoka T, Ochi J, Mori M, Sakagami Y. Identification of carotenoids in the freshwater shellfish Unio douglasiae nipponensis,Anodontalauta,Cipangopaludinachinensislaeta, andSemisulcospiralibertina. The Journal of Oleo Science, 2012, 61(2): 69- 74.
[26] 刘小燕, 李朝品, 王克霞. 中国圆田螺多糖体外抗乙肝病毒的实验研究. 中国中药杂志, 2013, 38(6): 879- 883.
[27] Jiang C X, Jiao Y P, Chen X M, Li X, Yan W J, Yu B, Xiong Q P. Preliminary characterization and potential hepatoprotective effect of polysaccharides fromCipangopaludinachinensis. Food and Chemical Toxicology, 2013, 59: 18- 25.
[28] Deng Z H, Zhang Q M, Lin R X, Huang S Y, Zhang Y, Lü S, Liu H X, Hu L, Pei F Q, Wang J L, Ruan C W. Survey on the focus ofAngiostrongyluscantonensisin Guangdong Province. Chinese Journal of Parasitology and Parasitic Diseases, 2010, 28(1): 12- 16.
[29] Deng Z H, Zhang Q M, Huang S Y, Jones J L. First provincial survey ofAngiostrongyluscantonensisin Guangdong Province, China. Tropical Medicine & International Health, 2012, 17(1): 119- 122.
[30] 段旭, 张晶晶, 朱静, 蔡护华, 陈粉粉, 郭爱伟. 松墨天牛和中国圆田螺体内纤维素酶系的比较研究. 云南农业大学学报, 2009, 24(4): 545- 551.
[31] Haskin H H. Age determination inMolluscs. Transactions of the New York Academy of Sciences, 1954, 16(6): 300- 304.
[32] 涂序堂. 背角无齿蚌消化系统的组织解剖学研究. 江西教育学院学报: 自然科学版, 1994, 15(5): 52- 56, 61- 61.
[33] 王琳, 刘国生, 王林嵩, 张志宏, 侯进怀, 郭惠敏. DNS法测定纤维素酶活力最适条件研究. 河南师范大学学报: 自然科学版, 1998, 26(3): 69- 72.
[34] 黄勃, 王林桂, 李二超. 杂色鲍与九孔鲍消化酶活力的比较. 水产学报, 2003, 27(2): 119- 123.
[35] 赵亚华, 高向阳. 生物化学实验技术教程. 广州: 华南理工大学出版社, 2000: 157- 159.
[36] 黄卓烈. 生物化学实验技术. 北京: 中国农业出版社, 2010: 86- 88.
[37] 费志良, 乔慧, 郝忱, 王喆, 黄成. 3种淡水蚌消化酶活力的初步研究. 淡水渔业, 2006, 36(4): 3- 6.
[38] 刘玉梅, 朱谨钊. 对虾消化酶的研究. 海洋科学, 1984, (5): 46- 50.
[39] 黄建华, 江世贵, 杨其彬, 周发林, 李加儿, 区又君. 不同生长阶段斑节对虾消化酶活性变化. 海洋水产研究, 2007, 28(6): 19- 24.
[40] 余德光, 王广军, 谢骏, 关胜军, 胡朝莹, 乌兰. 斜带石斑鱼消化器官的蛋白酶和淀粉酶活力变化. 浙江海洋学院学报: 自然科学版, 2007, 26(3): 246- 251.
[41] 王宏田, 张培军. 牙鲆体内消化酶活性的研究. 海洋与湖沼, 2002, 33(5): 472- 476.
[42] 张丽丽, 周歧存, 程怡秋, 韦晓丽, 张少平. 不同糖源对方斑东风螺生长、饲料利用和消化酶活性的影响. 广东海洋大学学报, 2009, 29(4): 14- 18.
[43] 敖鑫如. 福寿螺的生活习性及养殖试验. 南昌大学学报: 理科版, 1990, 14(2): 30- 34.
[44] Kolkovski S. Digestive enzymes in fish larvae and juveniles--implications and applications to formulated diets. Aquaculture, 2001, 200(1/2): 181- 201.
Comparative study on the digestive enzyme activities between golden apple snails (Pomaceacanaliculata) and local field snails (Cipangopaludinachinensis)
LUO Mingzhu1,2, ZHANG Jiaen1,2,*, HU Jiulong3, ZHAO Benliang1,2
1CollegeofAgriculture,SouthChinaAgriculturalUniversity,Guangzhou510642,China2InstituteofTropicalandSubtropicalEcology,SouthChinaAgriculturalUniversity,Guangzhou510642,China3CollegeofVeterinaryMedicine,SouthChinaAgriculturalUniversity,Guangzhou510642,China
To investigate the differences of digestive ability between the alien golden apple snails (Pomaceacanaliculata(Lamarck was, 1828)) and local field snails (Cipangopaludinachinensis(Gray, 1832)), and hence to explore the successful invasion mechanism of golden apple snails, we assayed the following digestive enzyme activities: cellulose enzyme activity (carboxymethyl cellulose method), amylase activity (3, 5-2 nitro salicylic acid method) and lipase activity (titration), with the samples taken from liver and stomach of the apple snails and local snails at different ages (from 1 to 4) using local snails as control. The results demonstrated that: 1) The digestive enzyme activities in stomach and liver of golden apple snails of the same age group were significantly higher than those of the local field snails. Among them, the cellulase activity of golden apple snails was 1.00 to 2.11 times and 1.66 to 2.84 times higher than those of local field snails, respectiviely; Amylase activity of golden apple snails was 1.53 to 3.47 times and 1.47 to 1.80 times higher, respectively; Lipase activity was 2.07 to 4.73 times and 6.13 to 9.93 times higher, respectively. 2) The variation amplitudes of different digestive enzyme activities in the stomach and liver of golden apple snails (51.2%—131.2%) were significantly higher than those of local field snails (23.3%—47.1%) during growth and development. 3) There were synergistic effects between digestive enzymes of golden apple snails. For example, the amylase activity of golden apple snails were significant positively correlated with the activity of lipase (r=0.736**in the stomach,r=0.867**in the liver). In addition, the amylase activity in the stomach was significant positively correlated with cellulose enzyme activity (r=0.696*). Accordingly, there was also a significant positive correlation between amylase and lipase activities in the stomach of local field snails (r=0.706*), while the cellulase and lipase activities in the liver were significant negatively correlatied (r=-0.593*). 4) Golden apple snails have strong abilities to digest cellulose and starch, and could digest fatty substances as well. Local field snails could digest cellulose and starch, but the digestion ability for fat was very weak. The cellulase and amylase activities of golden apple snails were 2.42 and 1.88 times higher than those of local field snails, respectively, and the lipase activity even reached 5.66 times. In conclusion, golden apple snails have much higher digestive enzyme activities, and there are positive synergies between various digestive enzymes, which lead to its big appetite and omnivorous predation. This could be one of the important factors that result in the golden apple snails growing very fast and invading successfully.
golden apple snail (Pomaceacanaliculata(Larmack, 1828)); local field snail (Cipangopaludinachinensis(Gray, 1832)); cellulase;amylase; lipase;stomach; liver
国家自然科学基金(U1131006, 30770403, 30900187); 广东省科技计划项目(2011B020309009); 广东省高等学校高层次人才项目(粤教师函【2010】79号)、广东省引进国(境)外高层次人才智力项目(粤外专[2010]51号)
2013- 07- 11;
2014- 10- 14
10.5846/stxb201307111879
*通讯作者Corresponding author.E-mail: jeanzh@scau.edu.cn
罗明珠, 章家恩, 胡九龙, 赵本良.福寿螺和田螺消化酶活性比较.生态学报,2015,35(11):3580- 3587.
Luo M Z, Zhang J E, Hu J L, Zhao B L.Comparative study on the digestive enzyme activities between golden apple snails (Pomaceacanaliculata) and local field snails (Cipangopaludinachinensis).Acta Ecologica Sinica,2015,35(11):3580- 3587.

