三峡水库运行期间原生动物群落的时空异质性
郑金秀, 池仕运, 李 聃, 汪红军, 胡菊香
水利部中国科学院水工程生态研究所, 水利部水工程生态效应与生态修复重点实验室, 武汉 430079
三峡水库运行期间原生动物群落的时空异质性
郑金秀, 池仕运, 李 聃, 汪红军, 胡菊香*
水利部中国科学院水工程生态研究所, 水利部水工程生态效应与生态修复重点实验室, 武汉 430079
于2010年10月—2011年6月三峡水库正常运行周期内对库区干流原生动物进行调查,研究其空间分布及水库周期排蓄期间的变化。共检测到原生动物99种,蓄水后纤毛虫有增多的趋势。水库运行的不同阶段优势种不同,大致演变为:砂壳纤毛虫(蓄水期)—非砂壳类纤毛虫(高位运行期间)—有壳肉足虫(低位运行期间)。不同水域优势种也存在差异,从上游到下游特征指示种变化为:有壳肉足虫(变动回水区)—纤毛虫(湖泊区)。结果表明,三峡水库原生动物的分布具有明显的时空异质性(P<0.05),影响原生动物时空分布的主要因素有透明度、温度、电导率和叶绿素a。原生动物平均密度为952.19 个/L,平均生物量为8.14 μg/L。蓄水期上游现存量高于下游,低位运行期间则低于下游。原生动物Marglef和Shannonn-Weiver多样性指数平均值分别为3.78和2.18,1月份最低,6月份最高。蓄水175 m后上游变动回水区原生动物具有较高的丰度。水库冬蓄夏排的运行模式模糊了河流本身的季节变化,使原生动物的种类和现存量更多的受水库水动力学的影响,使水体理化因子和水文特征呈现明显的时空差异,最终形成原生动物种群的时空异质性分布。
三峡; 原生动物; 运行; 时空异质性
三峡水库2008年进行175 m试验性蓄水,并于2010年10月26日首次蓄水到175 m设计目标,至此,三峡水库年水位落差达30 m。在175 m蓄水水位时,三峡干流回水末端到达重庆。变动回水区从黄草峡至江津红花碛,变动回水区长约146 km。变动回水区的水体滞留时间进一步延长,水体逐渐从河流型转变为过渡型。三峡水库“冬蓄夏排”的周期性蓄水模式,不仅使干流不同区域形成不同类型水体,而且模糊了河流本身的季节变化,使三峡水库浮游生物在季节演变上呈现出与湖泊不同的规律[1]。三峡水库蓄水后,众多学者对水库的生态环境特征[2- 4]、浮游生物群落结构[5- 7]、富营养化问题[8- 9]等开展了研究,但是对三峡水库原生动物的研究较少,龚循举等人在蓄水前对三峡地区的原生动物区系做了研究[10],蓄水后笔者在三峡库区做了初步调查[11]。此外,蓄水后仅见三峡库区小江支流的报道[12]。
本文调查期间正处于三峡水库正常运行初期,水生态系统仍处于不稳定阶段。变动回水区范围改变,水位波动幅度增大,都将对水库水生态系统造成影响。原生动物作为水生态系统食物链中的重要环节,对环境的细微变化敏感,对水生态系统变化响应迅速。通过对原生动物空间分布及水库周期排蓄期间的变化研究,可以反映三峡水库水生态系统的状况及其发展趋势。本文研究不仅旨在探讨三峡水库运行对原生动物种群结构的影响,了解原生动物的演变过程,为阐明三峡水库独特的水生态系统的变化提供有力支持,也希望能为三峡库区的原生动物分布状况积累基础数据,为生态环境保护提供参考。
1 材料与方法
1.1 样品采集
从上游永川起至下游秭归,即从175 m回水区末端至坝前,共设置13个监测断面,依水面宽度及实际采样点状况设左右岸采样点。三峡水库正常蓄水后,枯水期175 m水位回水末端位于江津附近的红花碛,汛期145 m水位回水末端位于涪陵附近。依照水库不同蓄水水位所达到的回水区域,可分为变动回水区和湖泊区两组,即从水位145 m回水区末端至175 m回水区末端区域为变动回水区,该区域由于水位周期变动使生境处于河流-湖泊交替变换状态,包括以下采样点:朱沱(ZT)、鱼洞(YD)、寸滩(CT)、扇沱(ST)、清溪场(QX);湖泊区为水库永久的淹没区,不随水库调度周期变化,主要包括:苏家左(SJL)、苏家右(SJR)、桐园左(TYL)、桐园右(TYR)、苦草沱左(KCTL)、苦草沱右(KCTR)、白帝城左(BDCL)、白帝城右(BDCR)、培石(PS)、黄蜡石(HLS)、屈原祠(QYC)、银杏沱(YXT)(图1)。
根据水库蓄水运行周期,设置3次调查时间,分别为2010年10月(蓄水期),水库蓄水达到175 m,调查期间水位波动在172—174 m;2011年1月(高位运行期),水库在高水位运行,水位维持在174 m左右;2011年6月(低位运行期),水位降为148 m。
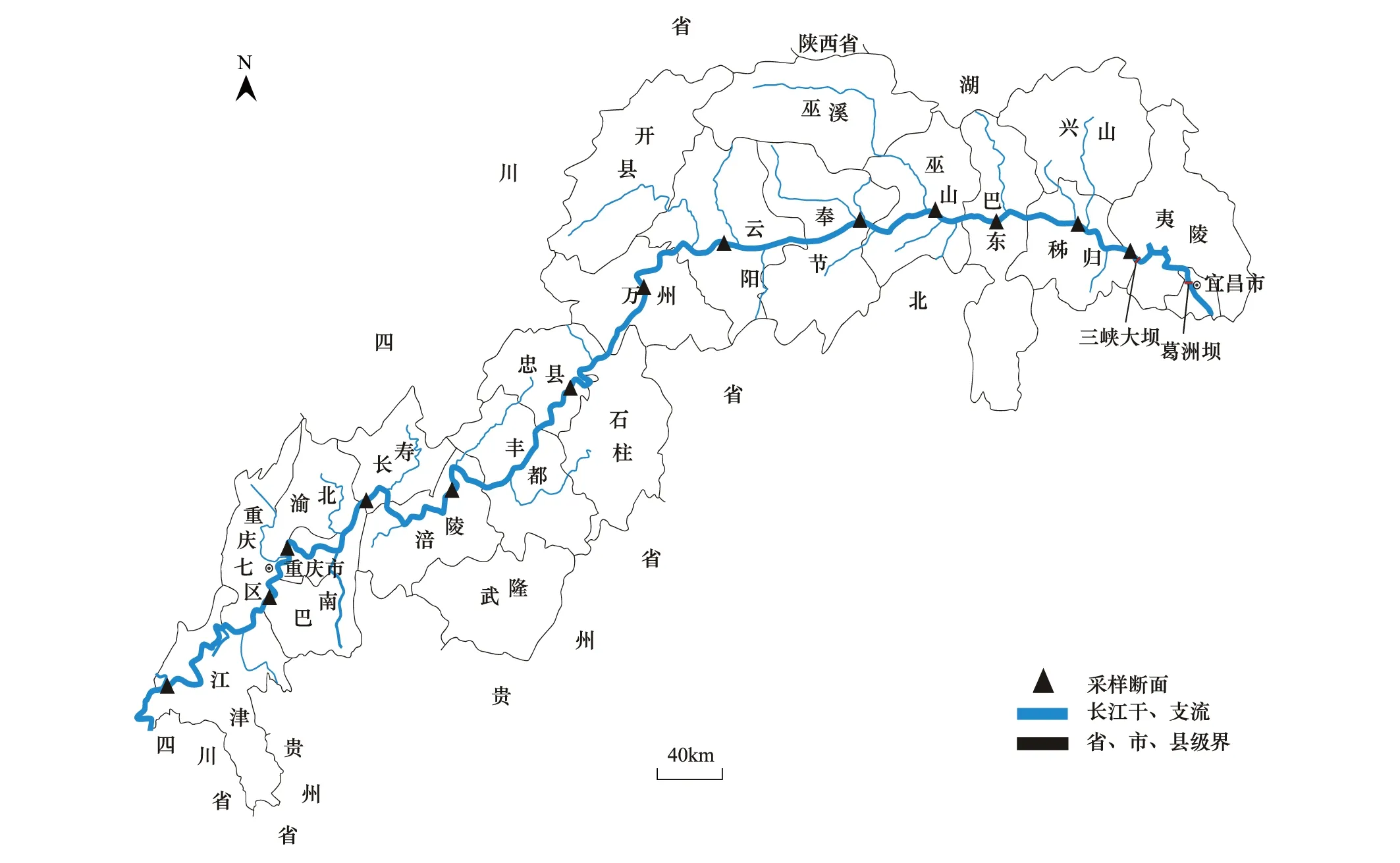
图1 三峡采样点示意图
1.2 样品处理
原生动物定性样品用25号浮游生物网(孔径为64 μm)大范围拖捞获得,取50 mL用5%的福尔马林固定。河流定量样品用2.5 L采水器采水10 L,混合后取2 L水立即用15%的鲁哥氏液固定。三峡水库库区,定量样品用2.5 L采水器于5个深度(0、5、10、20、40 m)各采水5 L,混合后取2 L水用15%的鲁哥氏液固定。所获样品均带回实验室进行分类、鉴定[13- 14]。
用YSI6600水质分析仪同步监测水质参数,包括:水温(T)、pH值、溶解氧(DO)、电导率(Cond)、氧化还原电位(ORP);用赛氏盘测透明度(SD);采集水样,抽滤保存,回实验室测定Chl a等。
1.3 数据处理
原生动物密度用0.1 mL计数框,视野法计算;生物量按体积估算。具体计算参照章宗涉和黄祥飞的方法[15]。
原生动物多样性分析采用Marglef指数(d)和Shannonn-Wiever指数(H′)计算。计算公式如下:
d= (S-1) / lnN
式中,S为原生动物种类数,N为原生动物个体数。
H′ =-∑Pi×log2Pi,Pi=ni/N
式中,Pi为样品中第i种(属)个体所占比例;N为采集样品中原生动物的总个体数;ni为第i种个体数。
采用除趋势对应分析(DCA)对原生动物时空分布进行排序,并采用检验组间差异性的非参数程序多响应置换过程分析(MRPP)法进行不同条件之间的差异性检验。再将DCA轴与环境因子做相关性分析,探讨影响原生动物分布的主要环境因子。
指示种分析采用指示种分析(ISA)检测和描述站点原生动物对不同条件下的指示作用,并用蒙特卡罗检验来决定指示值(IV)的统计显著性。
采用单因素方差分析(One-way ANOVA)对变动回水区和湖泊区原生动物的分布进行差异性分析,多重比较(LSD)分析法检验数据的差异性。
DCA分析、MRPP分析、ISA分析皆用PC-ORD软件进行。One-way ANOVA分析和DCA轴与环境因子的相关性分析用SPSS17.0软件进行。
2 结果与分析
2.1 种类组成
调查期间共检出原生动物99种,其中纤毛虫50种。10月份蓄水期检出49种,纤毛虫占49.98%;1月份高位运行期间检出50种,纤毛虫占56.86%;6月份低位运行期间检出66种,纤毛虫占47.06%。总体来说,肉足虫与纤毛虫种数相当,在不同运行期间比例略有变化,蓄水后纤毛虫有增多的趋势,因而1月份高位运行期间纤毛虫种类多于另两个运行阶段。
原生动物在水库运行的不同阶段优势种组成不同,蓄水期常见种主要有表壳虫(Arcella)、砂壳虫(Difflugia)等有壳肉足虫、旋回侠盗虫(Strobilidiumgyrans)和筒壳虫(Tintinnidium)、似铃壳虫(Tintinnopsis)等砂壳纤毛虫,优势种为旋回侠盗虫和小筒壳虫(T.pusillum),高位运行期间其它种类纤毛虫增多,膜袋虫(Cyclidium)和钟虫(Vorticella)成为常见种,其优势种主要有旋回侠盗虫、小筒壳虫和膜袋虫;低位运行期间则以有壳肉足虫、砂壳纤毛虫和旋回侠盗虫为常见种,优势种是旋回侠盗虫、表壳虫、匣壳虫(Centropyxis)和圆壳虫(Cyclopyxis)。旋回侠盗虫是全年的优势种。为辨别3个时期种类组成上的差异,用PC-ORD软件计算分析3个时期的指示种,取IV(indicator value)值较大且达到显著水平(P<0.05)的为该时期的特征指示种(表1)。可以看出不同时期原生动物特征种类的演替,大致为:砂壳纤毛虫(蓄水期)—非砂壳类纤毛虫(高位运行期间)—有壳肉足虫(低位运行期间)。

表1 不同时期原生动物优势种
原生动物在不同水域种类组成有较大差异,计算分析变动回水区和湖泊区的主要特征指示种(表2)。可以看出变动回水区原生动物特征指示种主要是有壳肉足虫,下游湖泊区纤毛虫种类增多,并以巧刺日虫(Raphidiophryselegans)和陀螺侠盗虫(Strobilidiumvelox)为该水域的特征指示种。

表2 不同水域原生动物优势种
2.2 密度和生物量
干流原生动物平均密度为952.19 个/L,10月份密度754.41 个/L,1月份密度1138.25 个/L,6月份密度963.92 个/L;干流平均生物量为8.14 μg/L,10月份生物量为 6.65 μg/L,1月份为7.95 μg/L,6月份为9.80 μg/L。不同站点原生动物现存量如图2和图3。蓄水期上游变动回水区原生动物现存量明显高于下游湖泊区,但低位运行期间湖泊区的现存量要比变动回水区高许多。高位运行期,变动回水区密度为612 个/L,远低于下游湖泊区1288 个/L,但生物量却比湖泊区高,分别为12.43 μg/L和6.28 μg/L。这是由于高位运行期间湖泊区小个体纤毛虫数量增多,如睥睨虫(体长30—35 μm)、膜袋虫(体长22—30 μm)、蚤中缢虫(Mesodiniumpulex)(体长20—25 μm)、栉毛虫(Didinium)(体长25—60 μm)等大量出现,但变动回水区仍以个体稍大的原生动物为主,如表壳虫(壳长70—150 μm)、睫杵虫(Ophryoglena)(体长120—160 μm)、长圆靴纤虫(Cothurniaoblonga)(鞘长72—80 μm)等。通过One-way ANOVA分析,变动回水区和湖泊区原生动物密度和生物量都达到差异极显著水平(P<0.01)。
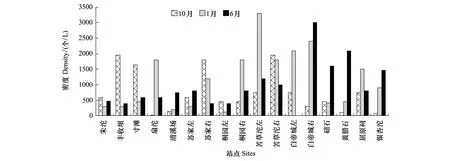
图2 原生动物密度变化

图3 原生动物生物量变化
2.3 理化因子变化及与原生动物的相关性
三峡库区水体理化因子检测结果如表3所示。从表中可看出,除了pH值变化较小外,其余水质参数波动较大,从上游到下游也有很明显的趋势走向。其中透明度、电导率、温度、Chl a呈上升趋势,而溶解氧、氧化还原电位呈下降趋势。各指标在清溪场和苏家之间有明显跃动界限。清溪场以上为变动回水区,苏家以下则是湖泊区,可见两个区域的水质特征有明显的差异。通过One-way ANOVA分析证明,这两个区域的差异达到极显著水平(P<0.01)。叶绿素a含量是表征藻类现存量的重要指标,本文检测出叶绿素a除了苦草沱断面在夏季>10 μg/L,为富营养状态之外,其余断面都处于贫营养-中营养水平,且大部分为贫营养状态。

表3 三峡水库水体理化因子
三峡库区水体理化因子与原生动物的相关性如表4。种类数和多样性指数受透明度、电导率、温度共同影响,呈显著相关(P<0.05,P<0.01)。且在湖泊区,种类数与透明度、温度和电导率的相关性更为显著(P<0.01)。纤毛虫比例与透明度成正相关(P<0.01),与溶解氧成负相关(P<0.05)。而原生动物现存量与理化因子关系不明显。叶绿素a对原生动物的影响不明显,只在过渡区与种类数成负相关(P<0.05)。

表4 水体理化因子与原生动物的相关性
(1)表示过渡区;(2)表示湖泊区
2.4 原生动物多样性
计算Marglef指数(d)和Shannonnn-wiever指数(H′),平均值分别为3.78和2.18。两种多样性指数变化趋势相同,如图4。Marglef指数以1月份高位运行期指数值最低,为3.46,6月份低位运行期最高,为4.22。指数在不同水域不同季节变化较明显,10月份和6月份之间达到差异极显著水平(P<0.01)。蓄水期和高位运行期变动回水区的指数值较高,但低位运行期湖泊区的marglef指数远高于变动回水区。Shannonn-Wiener指数(H′)也是1月份最低,6月份最高,但季节之间差异不大(P>0.05)。蓄水期不同水域之间H′指数也差别不大(P>0.05)。
2.5 原生动物在水库不同运行时期的分布
根据原生动物检出情况,做DCA分析,结果如图5。进行MRPP分析,统计量T=-9.765,A=0.059,P<0.001,达到极显著水平,组间差异分析结果如表5,P值皆小于0.05,表明水库不同运行时期的原生动物分布差异显著。

图4 不同水域多样性指数季节变化

表5 原生动物季节变化的MRPP分析结果

图5 原生动物季节变化的DCA分析
2.6 原生动物的空间分布
根据不同水域原生动物的种类组成,做不同站点的DCA分析,结果如图6。再进行MRPP分析检验差异性,统计量T=-6.1642561,A=0.02614683,P=0.00001544,达到极显著水平。表明三峡水库变动回水区与湖泊区之间原生动物种类组成和分布差异显著。

图6 原生动物空间分布的DCA分析
2.7 理化因子与DCA轴的相关性
将理化参数与DCA轴数值做Spearman相关性检验,相关系数如表6。可见,影响原生动物时空分布的主要因素主要有透明度、温度、电导率和Chl a。轴一主要反映透明度的变化;轴二与Chl a显著相关;轴三与温度和电导率二者相关性显著。 总方差4.3493,第三轴累积贡献率为:(0.3194150031+0.2796075940+0.2058645636)/4.3493=18.5%

表6 理化参数与DCA轴的相关性
3 讨论
3.1 三峡水库原生动物时空分布的异质性
水库特有的形态结构和运行特性导致水库在物理、化学上均存在一个纵向分区,在生境上表现出由激流环境到静水环境的过渡[16],也使得浮游动物在分布上具有显著差异。
随着三峡水库的运行,水文节律发生改变,原生动物种群结构呈现明显的季节性差异。蓄水期水位上升,直至接近175 m,淹没区扩大,上游江段形成新的回水区,水流明显减缓。蓄水后水体滞留时间延长,原生动物密度和生物量上升较快。此时的生境还不稳定,原生动物主要以有壳肉足虫、砂壳纤毛虫和旋回侠盗虫为主。水库蓄水175 m后,在该水位运行数月,至第2年1至2月。第2次采样正处于水库高位运行期间,水库生态系统较蓄水期稳定,原生动物类群发生明显变化,纤毛虫比例上升,并成为优势种,密度和生物量也较蓄水期增多。6月份为三峡水库低位运行期间,水位148 m,此时回水区至万州附近,万州上游江段重新处于河流状态。从物种组成可以看出,此时原生动物表壳科和砂壳科肉足虫明显增多,并成为优势种。低位运行期间原生动物密度有所下降,但生物量继续上升,可见大个体的种类比例上升而小型种类减少。
从空间分布上看,变动回水区和湖泊区之间原生动物的种群分布差异较大,三峡水库正常运行后,上游从朱沱至万州由原来的河流区转变为过渡区,随着水库运行阶段的不同,其生境不断改变,使该水域原生动物种群也处在动态变化过程,并与下游湖泊区呈明显差异。
3.2 环境因子对原生动物种群结构的影响
环境因子(如水温、透明度等)对浮游动物群落演替具有重要作用[17]。本研究中,温度、透明度、电导率和叶绿素a是影响原生动物时空异质性的主要因素。
水温是三峡水库环境特征的控制性因子一[2]。水温以各种形式影响水库水动力、理化和生物过程[18]。原生动物最适温度范围多在10—25 ℃之间[19]。在一定温度范围内,原生动物种群增长率r与水温呈正相关[20]。三峡水库湖泊区原生动物种类数与水温相关性极显著(P<0.01),且由于湖泊区范围远大于变动回水区范围,使得水温的影响在原生动物结构形成过程中起了重要作用。
除水温外,透明度、电导率等理化条件也呈现纵向梯度,共同影响了三峡水库的生态过程[21- 23]。电导率在不同水域间的差异可能和流域的面积有关,电导率一般随流域面积的增大而上升[24]。在同一水域电导率的时间变化则可能是温度及其它环境因子决定的。三峡水库6月夏季水温较高,相应的溶解度大,而可溶性的离子越多,电导率越大。但在上游过渡区,电导率并没有随温度升高而上升,可能和上游蓄水,环境发生改变有关。营养盐主要来自径流的输送,蓄水期上游输送的营养盐及淹没土地释放出的营养盐,都会增大水体的电导率。多样性指数是群落演替的一个重要指标,群落多样性的变化是生物生存环境发生变化的重要标志。三峡原生动物多样性指数受透明度、电导率、温度共同影响,成显著相关(P<0.05)。
叶绿素a大体上能反映水体的营养水平。有研究表明,原生动物群落演变与水体营养水平关系密切[25- 27]。本文研究,原生动物的种类分布受叶绿素a影响,但密度和生物量随叶绿素a的消长不明显,其种群结构应是受生物和非生物因素的共同作用的结果。
在成库初期,水力条件变动是直接影响浮游生物分布的主导因素[28]。三峡水库上游过渡区的水力、水环境条件尚处于变动期,水力条件波动及其引起的水环境改变对该水域的原生动物分布影响较大;而下游库区已成库多年,原生动物经过一定时间的适应,基本上已形成自身的分布和演变规律,受环境因子和生物因子的影响更为明显。因此,是生物因素和非生物因素综合作用,共同影响了三峡水库原生动物的时空分布。
3.3 水库运行对原生动物种群结构的影响
一般来说,水库成库后要经过4—5年的波动后水生生物群落结构才趋于稳定[29]。水库运行的特点之一就是对流量的调节。受径流的影响,河流区原生动物的种类和数量相对较少。由河流向水库过渡后,由于水力滞留时间的延长,流速减缓,环境趋于稳定,给浮游动物提供了良好的栖息环境,因此,库区内浮游动物的种类及现存量上要高于上游原河流区(即过渡区朱沱至清溪江段)。然而,水库过渡区浮游动物却具有较高丰度[30]。从图2,图3可知,蓄水期,河流区转变为过渡区后原生动物丰度明显高于中下游库区。这可能是由蓄水期入库水流携带的大量有机物质造成的。当水大量流入水库时,由于水动力学原理以及悬浮物的浓度的增加,会引起浮游动物种群的波动[31- 32]。比较而言,原生动物中的有壳肉足虫比纤毛虫对悬浮物更为敏感[33],因此,过渡区原生动物的种类组成中,有壳肉足虫占有更大的比重。此外,外来的悬浮物还带来了大量碳源,对过渡区的食物网造成影响,进而影响了原生动物的种群结构[30]。黄海强[34]对蓄水后三峡库区浮游生物与泥沙沉降的关系进行研究,认为泥沙沉降有利于浮游生物的生长。Kirt的研究[35]表明,悬浮泥沙可以改变浮游动物的群落结构。
除了形成空间上的不同分区外,水库流量调节在洪水季蓄水削峰和枯水季补充水量也对原生动物造成了较大影响。通过调节,三峡水库可以对营养物质、藻类组成和现存量等进行调控[36],从而影响原生动物的结构变化。与丹江口水库[37],陆水水库[38]等供水水库相比,三峡水库浮游动物在季节变化上并没有遵循夏秋季高峰,冬季较少的规律。三峡水库原生动物在1月份枯水季的现存量高于10月份平水季节,1月份原生动物的密度甚至比6月份丰水季节的密度高。可见,三峡水库运行,对水量的调节使水体在较短时期内发生波动,模糊了河流本身的季节变化。吴生桂等人也认为,水库调度蓄洪补枯影响了原生动物的季节变化规律[39]。水库运行,通过改变水动力学条件,进而影响水体物理化学过程,使水体理化因子和水文特征呈现明显的时空差异,最终形成浮游生物群落的时空异质性分布。
[1] 王英才, 邱光胜, 陈水松, 胡圣. 三峡库区试验性蓄水期间浮游生物群落特点研究. 人民长江, 2012, 43(12): 4- 9.
[2] 罗专溪, 张远, 郑丙辉, 富国, 陆兆华. 三峡水库蓄水初期水生态环境特征分析. 长江流域科学与环境, 2005, 14(6): 781- 785.
[3] 胡征宇, 蔡庆华. 三峡水库蓄水前后水生态系统动态的初步研究. 水生生物学报, 2006, 30(1): 1- 6.
[4] 胡念三, 刘德富, 纪道斌, 杨正健. 三峡水库干流倒灌对支流库湾营养盐分布的影响. 环境科学与技术, 2012, 35(10): 6- 11.
[5] 姚建良. 三峡水库蓄水后浮游甲壳动物生态学研究 [D]. 乌鲁木齐: 新疆农业大学, 2007.
[6] 冯坤, 万成炎, 彭建华, 张志永, 郑志伟, 胡莲, 邹曦. 三峡库区26条支流浮游甲壳动物的群落结构. 水生态学杂志, 2012, 33(4): 40- 48.
[7] 朱爱民, 乔晔, 梁友光, 郑志伟, 周莲凤, 邹清, 汪红军. 三峡水库支流童庄河拟多甲藻水华的监测. 水生态学杂志, 2012, 33(4): 49- 53.
[8] 李斌, 卢伟, 闫海. 长江三峡库区湖北段水华发生情况及成因分析. 环境科学与技术, 2012, 35(6I): 214- 216.
[9] 邓春光, 龚玲. 三峡库区富营养化发展趋势研究. 农业环境科学学报, 2007, 26(增刊): 279- 282.
[10] 龚循矩, 肖化忠, 沈韫芬. 长江三峡地区的原生动物区系研究. 水生生物学报, 1990, 14(4): 289- 297.
[11] 郑金秀, 胡菊香, 周连凤, 马沛明, 王翔, 吴生桂. 长江上游原生动物的群落生态学研究. 水生态学杂志, 2009, 2(2): 88- 93.
[12] 陈小娟, 潘晓洁, 冯坤, 郑志伟, 彭建华, 万成炎, 赵秀兰. 小江回水区原生动物和轮虫群落结构特征研究. 水生态学杂志, 2012, 33(5): 31- 35.
[13] 沈韫芬,章宗涉,龚循矩,顾曼如,施之新,魏印心. 微型生物监测新技术. 北京: 中国建筑工业出版社, 1990.
[14] 蒋燮治,沈韫芬,龚循矩.西藏水生无脊椎动物. 北京: 科学出版社, 1983.
[15] 章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社, 1991.
[16] 林秋奇, 韩博平. 水库生态系统特征研究及其在水库水质管理中的应用. 生态学报, 2001, 21(6): 1034- 1040.
[17] Sommer U. Plankton Ecology: Succession in Plankton Communities. Berlin: Spring-Verlag, 1989: 253- 296.
[18] 蔡庆华, 孙志禹. 三峡水库水环境与水生态研究的进展与展望. 湖泊科学, 2012, 24(2): 169- 177.
[19] 沈韫芬. 原生动物学. 北京: 科学出版社, 1999.
[20] 徐润林, 沈韫芬, 顾曼如. 武汉东湖浮游原生动物的生产量 // 第四次中国海洋湖沼科学会议论文集. 北京: 科学出版社, 1991: 164- 173.
[21] 田佳玉. 原生动物生长和分布的影响因子. 哈尔滨师范大学自然科学学报, 2012, 28(4): 61- 63, 70- 70.
[22] Patterson D J, Hedley S. Free-Living Freshwater Protozoa: A Colour Guide. London: Manson Publishing Ltd, 1996: 7- 221.
[23] Pratt J R, Cairns J Jr. Functional groups in the protozoa: roles in differing ecosystems. The Journal of Protozoology, 1985, 32(3): 415- 423.
[24] Kalff J. 湖沼学——内陆水生态系统. 古滨河, 刘正文, 李宽意, 等译. 北京: 高等教育出版社, 2011.
[25] Graham J M, Kent A D, Lauster G H, Yannarell A C, Graham L E, Triplett E W. Seasonal dynamics of phytoplankton and planktonic protozoan communities in a northern temperate humic lake: Diversity in a dinoflagellate dominated system. Microbial Ecology, 2004, 48(4): 528- 540.
[26] Li F C, Kang X J, Yang W B, Guan Y Q, Zhang X H, Liu W W, Shen G M, Li J L, Wang H W. Protozoan community character in relation to trophic level in the Beijing section of the Juma River. Biodiversity Science, 2006, 14(4): 327- 332.
[27] 胡菊香, 吴生桂, 唐会元, 邹清, 胡望斌, 陈金生. 巢湖的原生动物及其对富营养化的响应. 水利渔业, 2007, 27(1): 76- 79.
[28] 张晟. 三峡库区水体中营养盐与浮游生物量分布特征 [D]. 重庆: 西南农业大学, 2005.
[29] Ioriya T, Inoue S, Haga M, Yogot N. Change of chemical and biological water environment at a newly constructed reservoir. Water Science and Technology, 1998, 37(2): 187- 194.
[30] Nogueira M G. Zooplankton composition, dominance and abundance as indicators of environmental compartmentalization in Jurumirim Reservoir (Paranapanema River), São Paulo, Brazil. Hydrobiologia, 2001, 455(1/3): 1- 18.
[31] Arruda J A, Marzolf G R, Faulk R T. The role of suspended sediments in the nutrition of zooplankton in turbid reservoirs. Ecology, 1983, 64(5): 1225- 1235.
[32] McCabe G D, O′Brien W J. The effects of suspended silt on feeding and reproduction of Daphnia pulex. American Midland Naturalist, 1983, 110(2): 324- 337.
[33] Jack J D, Gilbert J J. The effect of suspended clay on ciliate population growth rates. Freshwater Biology, 1993, 29(3): 385- 394.
[34] 黄海强. 三峡库区泥沙沉降对浮游生物的影响研究 [D]. 重庆: 西南大学, 2008.
[35] Kirk K L, Gilbert J J. Suspended clay and the population dynamics of planktonic rotifers and cladocerans. Ecology, 1990, 71(5): 1741- 1755.
[36] 韩德举, 胡菊香, 高少波, 常秀林, 彭建华, 吴生桂, 胡传林. 三峡水库135 m蓄水过程坝前水域浮游生物变化的研究. 水利渔业, 2005, 25(5): 55- 58.
[37] 韩德举, 彭建华, 简东, 邹清, 邬红娟. 丹江口水库的饵料生物资源及水体营养状态评价. 湖泊科学, 1997, 9(1): 57- 62.
[38] 韩德举, 吴生桂, 邹清, 彭建华, 胡菊香. 陆水水库的浮游生物及营养类型. 湖泊科学, 1996, 8(4): 351- 358.
[39] 吴生桂, 简东, 曾强, 张晓敏. 东江水库对耒水中下游原生动物的影响. 长江流域资源与环境, 2000, 9(1): 124- 128.
Spatio-temporal heterogeneity of protozoan communities during the period of Three Gorges Reservoir operation
ZHENG Jinxiu, CHI Shiyun, LI Dan, WANG Hongjun, HU Juxiang*
KeyLaboratoryofEcologicalImpactsofHydraulic-ProjectsandRestorationofAquaticEcosystemofMinistryofWaterResources,InstituteofHydroecology,MinistryofWaterResourcesandChineseAcademyofSciences.Wuhan430079,China
Three Gorges Reservoir was impounded to 175 m for the first time in October 2010, of which the backwater area arrived in Chongqing, and the upstream water retention time extended further and the reaches changed to transitional waters. The heterogenrity of protozoan communities was studied in the main stem of Three Gorges Reservoir during the period of Three Gorges Reservoir normal operation (October 2010—June 2011). The spatial variations in community structure and species distribution were observed during reservoir drainage and storage. A total of 99 protozoan species were identified. Of these taxa, ciliates represented an increasing tendency after impoundment. The dominant species differed in operating stages, with the indicator species generally evolved from tintinnids (impounding period), ciliates (high water level period) to testate amoebae (low water level period). The dominant species varied in different reservoir areas, while the indicator species testate amoebae (transition zone) were changed into ciliates (lake zone) from upstream to downstream.Detrended correspondence analysis (DCA) and multi-response permutation procedure (MRPP) analysis showed that protozoan community structures and species distributions showed a clear spatio-temporal heterogeneity in Three Gorges Reservoir. The temporal heterogeneity peaked during impounding stage (P<0.05). The statistical analysis showed that the spatio-temporal variations in community pattern and species distribution were significantly correlated to environmental variables, especially transparency, temperature, conductivity and chlorophyll a. The average density and biomall of protozoa were 952.19 ind./L and 8.14 g/L, respectively. The standing crops of protozoa in upstream were higher than that in downstream during impounding stage, but lower than that during low water level period. The mean values of Marglef′s and Shannon-Weiner diversity indices were 3.78 and 2.18, respectively, with minimum value in January and maximum in June. The abundance of protozoa in transition zone was high after 175 m impoundment. It may be due to large amount of organic matter brought by water flow during the first impounding stage. Reservoir operation pattern of “drainage in winter and storage in summer” “blurs” seasonal variation of the river. Protozoan species composition and standing crops are mainly affected by reservoir hydrodynamic. Physic-chemical factors and hydrological characteristics showed different spatio-temporal variations, and resulted in the heterogeneity in community pattern and species distribution of protozoa on both temporal and spatial scales.
Three Gorges Reservoir; protozoa; operation; spatio-temporal heterogeneity
国家自然科学基金面上项目(51279112); 水利部公益性行业科研专项(201001001- 03)
2013- 07- 24;
2014- 06- 12
10.5846/stxb201307241942
*通讯作者Corresponding author.E-mail: hujuxiang2005@163.com
郑金秀, 池仕运, 李聃, 汪红军, 胡菊香.三峡水库运行期间原生动物群落的时空异质性.生态学报,2015,35(11):3569- 3579.
Zheng J X, Chi S Y, Li D, Wang H J, Hu J X.Spatio-temporal heterogeneity of protozoan communities during the period of Three Gorges Reservoir operation.Acta Ecologica Sinica,2015,35(11):3569- 3579.

