甘肃省中部沿黄灌区轮作和连作马铃薯根际土壤真菌群落的结构性差异评估
刘 星, 邱慧珍,*, 王 蒂, 张俊莲, 沈其荣
1 甘肃农业大学资源与环境学院,甘肃省干旱生境作物学重点实验室, 兰州 730070 2 甘肃农业大学农学院, 兰州 730070 3 南京农业大学资源与环境科学学院, 南京 210095
甘肃省中部沿黄灌区轮作和连作马铃薯根际土壤真菌群落的结构性差异评估
刘 星1, 邱慧珍1,*, 王 蒂2, 张俊莲2, 沈其荣3
1 甘肃农业大学资源与环境学院,甘肃省干旱生境作物学重点实验室, 兰州 730070 2 甘肃农业大学农学院, 兰州 730070 3 南京农业大学资源与环境科学学院, 南京 210095
甘肃省中部沿黄灌区是西北地区乃至全国重要的加工型马铃薯生产基地, 然而因集约化种植带来的连作障碍问题已经严重影响到当地马铃薯种植业的可持续发展。采用大田试验与PCR-DGGE(Polymerase Chain Reaction-Denaturing Gradient Gel Electrophoresis)技术相结合的方法, 并通过真菌的18S rDNA序列分析, 评估轮作(未连作)和连作条件下马铃薯根际土壤真菌群落在组成结构上的差异, 以期为甘肃省中部沿黄灌区马铃薯连作的土壤障碍机理研究提供新证据。结果表明, 同轮作相比, 连作显著降低了马铃薯块茎产量和植株生物量, 并且随着连作年限的延长, 连作障碍也愈加严重。长期连作(6a)也导致马铃薯根冠比显著增加和植株收获指数的显著下降。在根际土壤真菌的种群数量和多样性上, 连作和轮作间无显著差异, 但在群落组成结构上差异明显。真菌18S rDNA测序分析进一步表明, 马铃薯连作较轮作相比增加了Fusariumsp.和Fusariumsolani以及Verticilliumdahliae的种群或个体数量,而这些真菌是导致马铃薯土传病害的主要致病菌类型。根际土壤真菌群落组成结构的改变特别是与土传病害有关的致病菌滋生可能是导致当地马铃薯连作障碍的重要原因。
马铃薯; 轮作和连作; 真菌群落结构; 微生物多样性
Evaluation on fungal community structure of rhizosphere soils of potato under
rotation and continuous cropping systems in Yellow River Irrigation Areas of
甘肃省中部沿黄灌区是西北地区乃至全国重要的加工型马铃薯生产基地, 当地马铃薯种植主要呈现规模化、机械化和集约化的特点, 经营销售模式通常以订单农业为主。随着近年来农产品价格的不断走高和马铃薯消费逐步向高附加值产品转变, 当地农垦企业在满足旺盛的订单需求的同时也造成种植结构相对单一、倒茬困难和马铃薯的多年连作[1]。这导致了植株生长发育受阻, 块茎产量和品质下降, 特别是土传病害猖獗等一系列的问题, 严重影响企业的种植效益。因而探明马铃薯种植的连作障碍机理, 进而寻求缓解和克服马铃薯连作障碍的有效途径对于促进该地区马铃薯生产的可持续发展具有重要的理论意义和实践价值。良好的土壤环境是作物高产稳产的基础, 有关于连作土壤障碍因素的研究也已成为全球性热点[2]。连作系统下土壤的生物相特别是微生物群落结构的变化受到众多研究者的关注。微生物是土壤生态系统的重要组成部分, 其在结构和功能上具有高度的多样性, 因而在能量传递, 养分循环, 矿质化和腐殖化, 以及污染物的降解等土壤一系列重要的生化过程中起着重要作用[3- 4]。早前的报道已经证明[5- 7], 微生物群落结构是表征健康高产土壤的重要因子, 同时也对于土传病害的抑制具有重要的作用。结合现代分子生物学的技术手段, 在甘蔗[8]、大豆[9]和黄瓜[10]上的研究已证明, 连作显著影响根际土壤的微生物群落结构, 这可能是导致连作障碍产生的重要原因, 但在具体的微生物种类对连作的响应特征上存在着不一致的结果, 可能是受作物品种和供试条件的差异所致。Lang等[11]在棉花上的研究证明连作条件下微生物群落结构变化与土传病害发生存在直接关系, Larkin等[12]在连作马铃薯的研究中也得到了相似的结论。然而, 连作系统下土壤微生物群落行为特征受作物品种、施肥、土壤、气候条件等影响显著[13- 17], 目前在国内特别是西北主栽区有关于马铃薯连作的此类研究仍然缺乏, 且微生物群落结构在马铃薯连作条件下的演变特征仍不明确。针对当地因长期连作而导致的诸如立枯病、干腐病和黄萎病等真菌类土传病害严重的现象, 将土壤真菌群落结构作为我们研究的重点。将轮作即未连作作为对照, 利用PCR-DGGE技术并结合真菌的18S rDNA基因测序, 比较轮作和连作条件下的马铃薯根际土壤真菌群落结构差异, 旨在探明和揭示马铃薯连作障碍的土壤原因, 以期克服和消除连作障碍, 为该地区马铃薯生产的可持续发展提供科学依据。
1 材料与方法
1.1 试验区概况
田间试验地点位于甘肃省中部沿黄灌区的白银市景泰县条山农场, 当地有充足的水源和良好的农业灌溉条件。地理坐标处于东经103°33′—104°43′, 北纬36°43′—37°38′之间, 境内海拔1274—3321 m, 属温带大陆干旱气候, 年平均气温为9.1 ℃, 无霜期在141 d左右。年平均降水量为185.6 mm, 年平均蒸发量为1722.8 mm。年平均日照时数2713 h, 全县光热资源丰富, 日照百分率62%, 太阳年平均辐射量147.8×4.184 kJ/m2, 年≥0 ℃的活动积温3614.8 ℃, ≥10 ℃的有效积温3038 ℃, 是我国除青藏高原外光热资源最丰富的地区之一。供试土壤为灰钙土, 质地为砂壤。
1.2 试验设计与方法
在条山农场马铃薯种植区域内选择连作3a(CP3)和6a(CP6)的马铃薯种植地块进行田间试验, 以玉米-马铃薯轮作地块(即连作0a, 用RP表示)作为对照, 所选地块均匀平坦整齐, 具有当地代表性, 土壤基础农化性状见表1。马铃薯栽培种植和施肥量均保持一致, 采用宽垄双行覆膜种植, 播种前一天切种薯, 并用高锰酸钾浸泡消毒, 垄宽1.35 m, 行距70 cm, 株距17 cm, 种植密度5605株/667m2。氮肥用量为210 kg N/hm2, N∶P2O5∶K2O比例为1.4∶1.0∶2.0, 化肥分别用15- 15- 15的复合肥、尿素和硫酸钾。播种和施肥过程均采用机械化一次进行, 而后由人工覆膜。不施用有机肥, 且所有化肥均在播种时一次性基施, 无追肥, 其余栽培、灌溉和田间管理措施均按农场习惯方法统一进行, 各地块保持一致。4月25日播种, 8月30日收获。供试材料为当地主栽的加工型马铃薯品种大西洋, 由条山农场提供。

表1 供试土壤耕层农化性质Table 1 Detailed description of 0—20cm topsoil agro-chemical properties before sowing of 2011 potato growing season in this study
1.3 样品采集与分析
2011年马铃薯播种前采集土壤基础土样, 测定耕层土壤的基本农化性状。在马铃薯收获时, 采用样方取样法, 在每个连作地块随机划取3个样方, 分别代表3次重复, 每个采样方内选择健壮程度和长势一致的无病害马铃薯植株5株, 使用铁锹在尽量不破坏根系的前提下将植株整株挖出, 采集根际土壤样品。采用抖土法取样[18- 19], 每个样方的5株马铃薯根际土壤样品混合均匀, 每个处理得到3个混合样本, 代表3次重复, 密封好后贮存于-80 ℃冰箱中待提取土壤DNA。成熟收获时, 进行实测计产, 调查农艺性状, 而后将植株整株挖出, 分根、茎、叶和块茎四部分在105 ℃下杀青30 min, 80 ℃烘干, 称量干物质。
1.4 PCR-DGGE技术研究土壤真菌群落结构1.4.1 土壤DNA提取
采用美国Mobio Laboratories公司生产的Mobio核酸纯化试剂盒提取土壤DNA, 称取0.25 g混匀土壤装入提取柱中, 按照产品说明书上的步骤提取100 μL土壤DNA。同时采用1%琼脂糖凝胶电泳进行DNA提取效果的检测, 提取的土壤DNA总量大约在23 Kb左右。
1.4.2 真菌的PCR反应条件
真菌的PCR反应采用18S r DNA基因特异性通用引物: GC-Fungi (5′>CGCCCGCCGCGCCCCGCGCCCGGCCCGCCGCCCCCGCCCCATTCCCCGTTACCCGTTG<3′) 和NS- 1 (5′>GTAGTCATATGCTTGTCTC<3′)[20]。PCR反应体系为25 μL, 其中1 μL模板, 2 μL 2 mmol/L dNTPs, 2.5 μL10× PCR-buffer, 2.5 μL 25 mmol/L Mg2+, 0.3 μL Taq DNA polymerase, 引物各0.5 μL, ddH2O为15.7 μL。 PCR反应条件: 预变性94 ℃ 5 min, 继而94 ℃ 45 s, 58 ℃ 30 s, 72 ℃ 45 s, 32个循环, 最后72 ℃延伸5 min, 10 ℃保温。所得产物于1%琼脂糖凝胶电泳进行检测, 真菌DNA的PCR产物片段长度在370 bp左右。
1.4.3 土壤真菌群落结果的DGGE分析
真菌PCR产物通过浓度为8%的聚丙烯酰胺凝胶, 变性梯度为25%—40%, 在D-Code DGGETM系统(Bio-Rad)中进行电泳, 条件为80 V, 恒温60 ℃, 在1× TAE中电泳16 h。电泳结束后进行银染, 胶片用加拿大产的Win RHIZOTM扫描系统成像, 所得图像分辨率为14159×23279。谱带分析采用Bio-Rad公司的凝胶定量软件Quantity One (4. 6. 2版)。
1.4.4 真菌多样性指数计算
多样性指数H的计算方法如下[11]:
式中,Pi=ni/N,ni为DGGE泳道第i条泳带亮度峰值高度,N为泳道中所有泳带亮度峰值高度的总和。
1.4.5 真菌DGGE图谱的条带测序及分析
将DGGE胶上的DNA条带用无菌解剖刀切下后, 加入50 μL无菌水, 4 ℃静置过夜。然后用不含GC夹子的引物进行PCR扩增, 扩增体系同1.4.2的描述, 扩增后的PCR产物用AxyprepTMDNA Gel Extraction Kit(中国浙江)纯化试剂盒进行纯化。采用PMDTM19-T Vector(TaKaRa Biotechnology Dalian Co., Ltd.)连接纯化后的PCR产物。而后制备EscherichiacoliDH5α感受态细胞。取200 μL感受态细胞与10 μL连接好的DNA混匀, 冰浴放置30 min, 不时轻柔摇动。42 ℃静止水浴90 s, 迅速放回冰中继续冰浴2 min, 加入800 μL的LB液体培养基, 于37 ℃摇床上100 r/min培养1 h, 在含有终浓度为100 μg/mL氨苄青霉素和40 μg/mL X-GAL的LB培养基平板上, 吸取100 μL培养液涂布, 共涂布3个平板, 37 ℃培养12—16 h, 观察蓝白斑, 白色菌落为阳性。挑取白色阳性克隆, 在含有100 μg/mL氨苄青霉素的LB液体试管中37 ℃培养过夜, 采用PMD19RV-M (5′-GAGCGGATAACAATTTCACACAGG- 3′)和PMD19M13- 47(5′-CGCCAGGGTTTTCCCAGT CACGAC- 3′)进行菌液PCR扩增。扩增体系为: 10× Buffer 2.5 μL, dNTP(2.5 mmol/L) 2 μL, 引物(2.5 mmol/L)各 0.5 μL, MgCl2(25 mmol/L) 1.5 μL, 模板(菌液) 2 μL, Taq DNA聚合酶0.5 U, 加ddH2O补足至总体积25 μL。反应条件: 95 ℃预变性10 min, 进入热循环, 95 ℃变性1 min, 54 ℃退火1.5 min, 72 ℃延伸2 min, 共35个循环, 72 ℃保持10 min。PCR产物送南京金斯瑞生物科技有限公司进行测序, 将测序结果在http://www.ncbi.nlm.nih.gov在线查询分析, 利用Blast软件在GenBank中与其它的18S rDNA序列进行同源性比较。
1.5 数据处理
用SPSS 19.0数据处理软件对试验数据进行统计分析, 不同处理之间数据的多重比较采用Duncan新复极差方法完成; 图表绘制在Excel 2007软件上进行。
2 结果与分析
2.1 马铃薯块茎产量和植株田间农艺性状
马铃薯收获时, 对块茎产量和产量构成因素以及植株的农艺性状进行调查, 结果如表2所示。可以看出, 同RP相比, 连作显著降低了马铃薯块茎产量, CP3和CP6分别降低47.83%和83.62%, 而CP6较CP3也显著下降了68.60%。单株结薯数、单株结薯重量和平均单薯重是表征马铃薯块茎产量的重要指标。从表2可以看出, RP和CP3之间单株结薯数无显著差异, 而CP6的单株结薯数较RP显著下降了39.56%; 在单株结薯重量上, CP3和CP6较RP均有显著的下降, 降幅分别为31.30%和70.23%; 而在平均单薯重量上, CP3和CP6较RP也分别显著下降了35.00%和55.00%。统计分析表明, 本试验中马铃薯块茎产量的大幅度下降是3个产量构成要素共同下降造成的。3个处理的块茎产量与单株结薯数(R2=0.3524,P=0.0419)、单株结薯重量(R2=0.9226,P<0.0001)和平均单薯重量(R2=0.7454,P=0.0011)均有着显著或极显著的线性相关关系。马铃薯植株田间生长也受连作影响, 但其影响程度因连作历史不同而异。在植株的株高和主茎数上, CP3较RP均无显著差异, 而CP6在这两项指标上较RP分别显著下降了27.67%和30.07%。而在植株茎围上, 3个处理间无显著差异。
表2 轮作和连作条件下马铃薯块茎产量和植株农艺性状的比较
Table 2 Comparison on tuber yield and field agronomic characteristics of potato plants under rotation and continuous monocropping system

同列不同字母表示差异5%显著水平
2.2 马铃薯植株生物量
表3为3个处理马铃薯植株整株和不同器官的生物量以及根冠比和收获指数的比较。可以看出, 同轮作相比, 连作马铃薯显著降低了植株生产力。同RP相比, CP3和CP6的整株生物量均有显著的下降, 降幅分别高达39.52%和74.57%; 而就不同器官而言, 其生物量较RP也均有不同程度的下降, 特别是块茎的生物量, CP3和CP6较RP分别显著下降了41.37%和77.79%, 表明马铃薯植株的经济生产力受连作影响严重。同时从表3中可看出, 植株的根冠比和收获指数也受连作影响, 但其影响程度同样也因连作历史不同而异。CP3的植株根冠比和收获指数同RP相比无显著差异; 而CP6的根冠比较RP和CP3则分别显著增加74.29%和43.53%, 收获指数较RP和CP3也分别显著下降13.25%和9.69%, 表明同轮作相比, 长期的马铃薯连作导致了植株干物质分配上的差异。另外, 3个处理的块茎产量与根冠比(R2=0.6704,P=0.0011)和收获指数(R2=0.7108,P=0.0006)均有着极显著的线性相关关系。
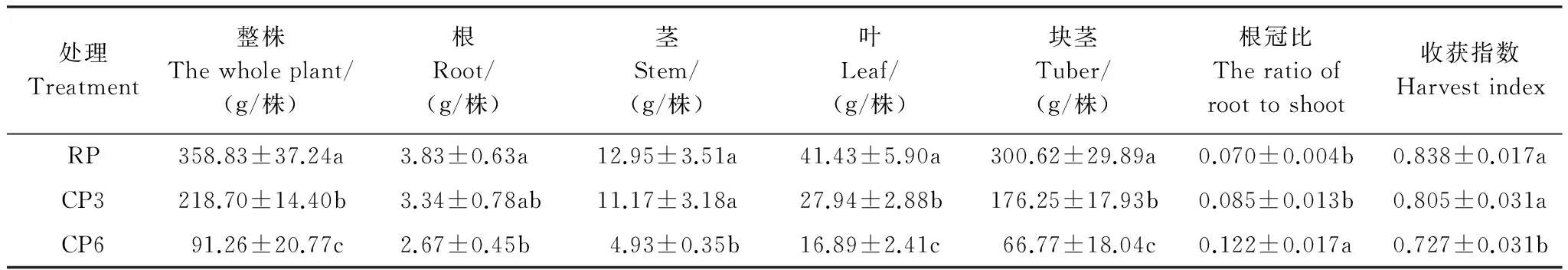
表3 轮作和连作条件下马铃薯植株生物量的比较Table 3 Comparison on biomass of potato plants under rotation and continuous monocropping system
表中生物量数据均为干重,根冠比为根系生物量与地上茎和叶片的生物量之和的比值,收获指数为块茎生物量与植株整株生物量的比值
2.3 马铃薯根际土壤真菌DGGE图谱分析
微生物是反映土壤质量的重要指标, 土壤功能的发挥与微生物群落组成和结构联系密切[21- 22]。本研究应用DGGE技术分离真菌18S rDNA片段的PCR产物, 不同DNA片段迁移为若干条带, 其DGGE图谱如图1所示。采用Bio-Rad公司的凝胶定量软件Quantity One对真菌DGGE图谱进行生物信息学分析发现, CP3和CP6根际土壤样本的真菌条带数量和多样性指数较RP均无显著性差异(表4)。尽管3个处理在块茎产量和植株生物量上存在显著差异, 但根际土壤真菌的种群数量和多样性特征并未因连作而产生显著的改变。聚类分析的结果如图2所示, 表明RP根际土壤的真菌群落与CP6有着更高的相似性。
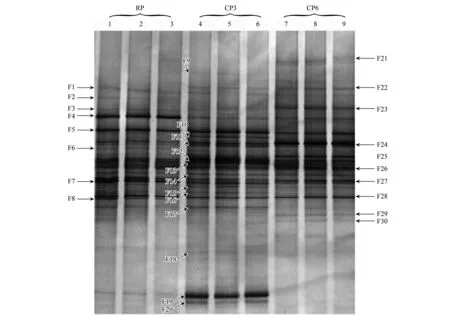
图1 马铃薯根际土壤真菌18S rDNA片段的PCR产物DGGE图谱
2.4 马铃薯根际土壤真菌条带的基因测序分析
相同迁移位置的DGGE条带在明暗程度上的差异能够直接地反映土壤中特定种或属的微生物的生长趋势变化[23]。受相同土壤质地和气候类型及环境因子的影响, 不同土壤样本之间具有的许多共同的DGGE条带, 这是因为供试土壤存在一些共有的微生物类型, 然而这些公共条带的亮度也不相同; 另外, 一些非公共条带也在特定泳道中出现, 表明较同轮作相比, 连作马铃薯对根际土壤真菌群落结构的改变在DNA水平上已有所体现, 并且真菌种群间的协同演替机制也受连作影响。为了进一步地判断不同种属的真菌在轮作和连作条件下的行为特征, 我们对DGGE图谱上的条带进行了割胶回收并测序, 详细结果如表5所示。条带F1、F4、F5、F7、F10、F12、F14和F20被鉴定为不可培养未知真菌。F9和F29被鉴定为不可培养的烧瓶状属未知真菌。F13和F17被鉴定为不可培养的未知真核生物。条带F2被鉴定与内生根毛霉具有较高的同源性(99%)。F6被鉴定为艾美虫科的原生生物(同源性98%)。F8被鉴定为栗色单格孢(同源性99%)。条带F11代表的微生物与白鼻症真菌具有100%的同源性。条带F15代表的真菌种类在数据库比对中与罗耳阿太菌具有最相近的亲源关系, 但是同源性相对较差, 只有90%。条带F16代表的微生物与Cladosporiumbruhnei(Accession no. GU999983)具有100%的同源性, 其为枝孢霉属真菌的一种。F27被鉴定为棕色枝顶孢(同源性98%)。条带F18和F30均被鉴定为大丽轮枝菌(Accession no. DQ016556, 同源性均为99%), 为土虫兆属节肢动物的一种。另外, 与马铃薯病害有关的一些真菌致病菌也在基因测序鉴定中被发现。条带F21和F22被鉴定为镰刀属的某些真菌(Accession no. FJ613599, 同源性分别为100%和99%), 镰刀菌是引起马铃薯干腐病、枯萎病的主要土传病害病原菌。F23被鉴定为茄病镰刀菌(Accession no. JN166424, 同源性为99%)。条带F24-F26均被鉴定为大丽轮枝菌(Accession no. AF104926, 同源性为97%—99%)。马铃薯黄萎病俗称“早死病”, 即是主要由轮枝菌属的大丽轮枝菌(Verticilliumdahliae)引起的一种严重的土传及种传病害, 寄主范围达160种植物[24- 25]。
表4 轮作和连作条件下马铃薯根际土壤真菌DGGE图谱条带数量和多样性指数的比较
Table 4 Comparison on band number and diversity index within fungal DGGE profiles of rhizosphere soils under rotation and continuous monocropping system

处理Treatment条带数量Bandnumber多样性指数DiversityindexRP23±1.53ab3.19±0.06abCP326±0.78a3.26±0.02aCP623±1.15b3.10±0.05b
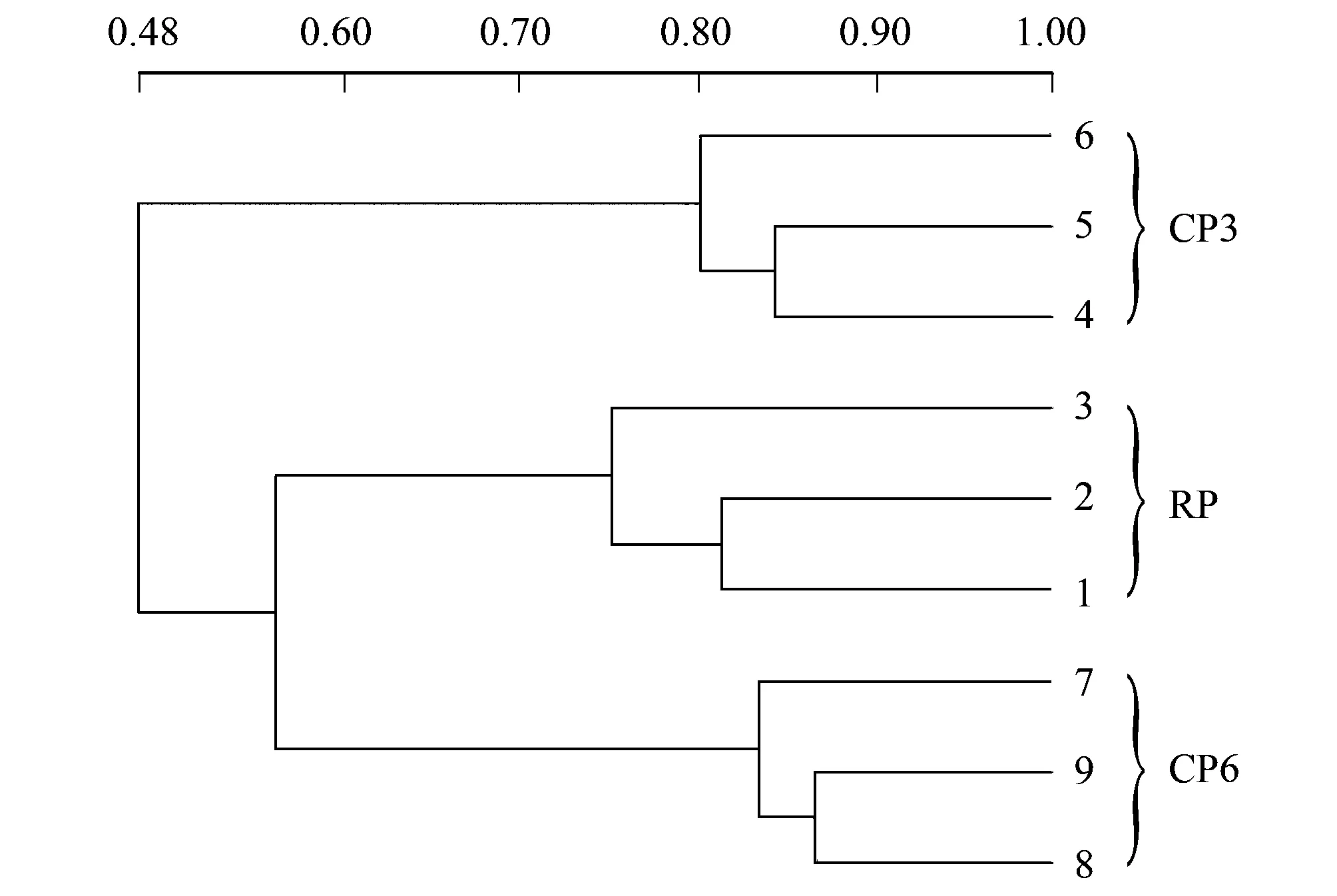
图2 马铃薯根际土壤样本的18S rDNA 条带图谱的聚类分析
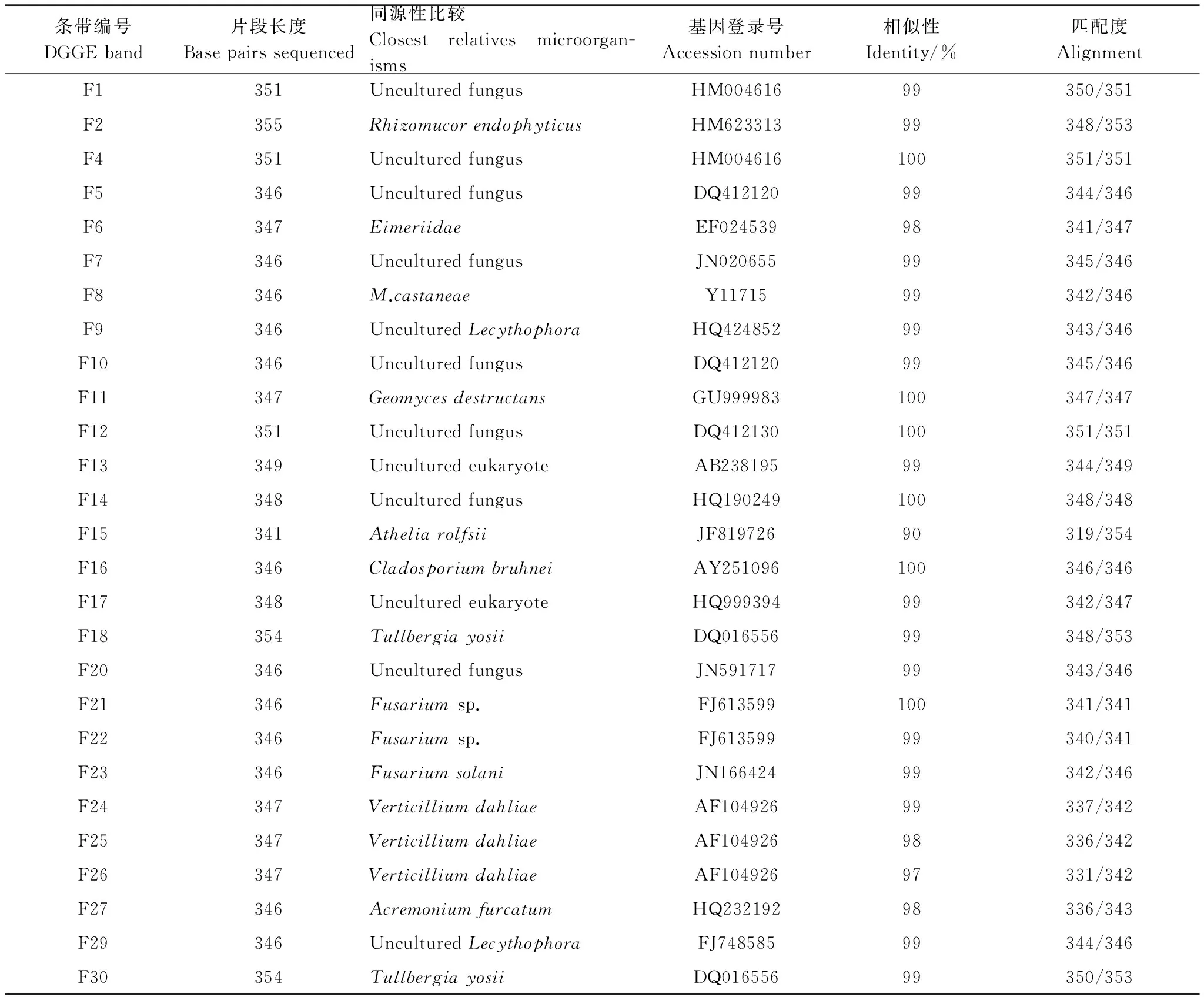
表5 真菌18S rDNA片段测序结果Table 5 The sequences of 18S rDNA fragments for selected bands within DGGE profile
从DGGE图谱中可以看出, 在总共的9个泳道中, F21—F26所对应的相同迁移位置的条带在亮度上均有所变化, 表明这些微生物的生长受轮作和连作影响明显, 为了进一步了解其在数量上变化, 使用Quantity One软件将不同条带的亮度峰值高度提取出来并作为该种微生物数量的相对表征量, 进而统计分析, 结果如表6所示。RP的3个根际土壤样本的DGGE泳道中对应Fusariumsp.和Fusariumsolani的3个DNA迁移位置均未检测到条带; 在CP3的泳道中只在一个DNA迁移位置检测到条带出现; 而在CP6的泳道中3个DNA迁移位置均检测到条带且具有不同的亮度峰值高度, 这表明同轮作相比, 长时间的连作增加了马铃薯根际土壤中镰刀属真菌的种群数量及其个体数量。统计分析显示, F24和F25所对应的DGGE条带的亮度峰值高度均表现为连作显著高于轮作, 表明马铃薯连作较轮作相比能够显著增加两种不同Verticilliumdahliae的数量; 而F26对应的DGGE条带的亮度峰值高度在3组供试的马铃薯根际土壤样本间无显著变化, 该结果表明马铃薯的连作在微生物个体水平上对Verticilliumdahliae产生影响, 而这种影响具有种间选择性, 推测这可能与供试土壤在理化性状上的局部空间异质性和Verticilliumdahliae的种间生理差异有关。

表6 供试土壤的真菌DGGE图谱F1—F26条带的亮度峰值高度的比较Table 6 Comparison on OD value of F1—F26 bands within fungal DGGE profile of rhizosphere soils
3 讨论
田间试验的结果表明, 同轮作相比, 连作显著降低了马铃薯的块茎产量和植株生物量, 并且随着连作年限的延长, 连作障碍的表现也愈加突出。同RP相比, CP3的块茎产量和植株整株生物量分别下降48.73%和39.52%; 而CP6的块茎产量和植株整株生物量较CP3进一步下降68.60%和58.27%。另外, 长期的连作也造成马铃薯植株在根冠比和收获指数上的显著变化, CP6植株的根冠比较RP显著增加74.29%, 而其收获指数较RP则显著下降13.25%, 表明马铃薯植株的干物质分配受连作影响, 这同王晶英等[26]在连作大豆和吴正锋等[27]在连作花生上的研究结果一致。根冠比的调整被认为是作物应对生物或非生物逆境的最基本的适应策略之一, 而因长期连作而引起的土壤在理化或生物学性质上的改变应是导致根冠比出现受迫性变化的直接原因。作物连作障碍的原因传统上被认为是土壤的颓败所导致, 这常常被描述为作物的忌地现象。在早前的报道中, 大量的学者从土壤理化性质入手开展研究, 目前已取得一些共性的结论, 证明连作后会造成土壤酸化加剧, 土壤结构破坏严重, 表现为容重增大, 土壤通气孔隙比例相对降低, 土壤含盐量逐渐增加, 有次生盐渍化的倾向, N、P、K的比例失调甚至根际亏缺, 同时土壤酶活性也显著下降[28- 32], 这些结果从本试验的供试土壤基础农化性质中也有所体现。
随着认识的加深和学科间的交叉融合, 学者们将根际微生态的概念应用到连作障碍的研究中来, 而微生物作为根际微生态系统的重要组成部分因此受到格外地关注。本试验采用PCR-DGGE的手段研究连作土壤的真菌群落结构特征, 将分子生物学技术引入到马铃薯连作障碍的研究中, 目前在西北地区尚属首次。结果表明, 同轮作相比, 连作并未造成马铃薯根际土壤真菌种群数量和多样性的显著变化, 这与Li等[9]使用同样的方法在东北地区连作大豆的研究结果一致。但Yao等[10]连作大棚黄瓜的研究表明连作种植较轮作相比显著降低了微生物的丰富度和多样性, 并认为这种多样性的降低可能是土壤有机质的数量和质量及分配上的差异所造成的。尤孟阳等[33]关于大豆、玉米和小麦的研究已证实, 连作导致土壤有机碳组分在空间上的重新分配, 改变了土壤碳的赋存特征, 特别是连作与自然恢复相比显著降低了土壤游离态轻组有机碳的含量。Eskelinen等[34]的研究进一步证明土壤有机质的质量显著影响微生物的群落组成和结构, 二者之间具有良好的线性相关关系。然而就本试验而言, 微生物群落结构对马铃薯连作的响应行为是否直接与土壤有机质的变化有关, 特别是与对种植管理方式较敏感且转化速度相对较快的的土壤轻组有机质有关尚需进一步地研究。而之所以会出现以上不一致的研究结果, 一方面可能受供试土壤类型和试验区生态环境条件影响, 因为二者直接决定了作物根际的土著微生物的种类, 不同种属或功能型的微生物对连作的敏感性和耐受性也截然不同; 另一方面应与供试作物品种有关, 这直接体现在根系分泌物种类和数量上, 根系分泌物能够显著影响根际微生物的活性和组成结构, 其任何细微的改变均能对根际微生物产生深远影响[35- 36], 尽管目前研究者对根系分泌物和微生物之间的互馈机理仍然缺乏足够的认识。
本研究表明, 尽管轮作和连作条件下马铃薯根际土壤真菌在种群数量和多样性上无显著差异, 但DGGE图谱分析也充分证明二者在真菌群落组成结构上差异明显, 这可以从各条泳道的条带亮度差异上体现出来。表明同轮作相比, 连作能够显著影响作物根际真菌群落结构, 而早前在不同作物上的相关报道[8- 10]也证实了这个结论, 并认为这可能与作物连作障碍的产生有关。通过对DGGE条带进行割胶测序分析, 与马铃薯土传病害有关的致病菌被鉴定出来, 如Fusariumsp.和Fusariumsolani以及Verticilliumdahliae。不同条带的亮度峰值高度统计结果表明, 马铃薯的连作较轮作相比导致了镰刀属真菌在根际土壤中的富集, 而这在种群数量和个体数量上均有所体现。由镰刀菌引起的干腐病是马铃薯贮藏期常见的真菌性病害之一, 在病薯中该病害所占比例较高[37]。牛秀群等[38]在与本试验相同的研究区域采用微生物平板培养的方法也得出了类似的结果, 同时也证明随着连作年限的增加, 马铃薯根际土壤不同镰刀菌种的数量变化趋势各异, 尖孢镰孢、茄病镰孢呈上升趋势, 黄色镰孢、再育镰孢呈下降趋势, 木贼镰孢变化较为平稳。尖孢镰孢和茄病镰孢一般都具有强寄生能力, 生活适应性也较广, 在澳大利亚、南非、美国等地都有严重发病的报道, 是致病力强的土传病害病原[39]。由于DGGE技术的固有特点和DNA序列比对的精准度问题, 本研究结果只能将微生物准确定义到属的水平, 因而在下一步的研究当中, 将传统微生物平板培养和定量PCR甚至高通量的土壤基因组测序等精准的分子生物学技术相结合能有助于人们在更细微的微生物分类学水平上来理解连作和轮作马铃薯根际土壤的真菌群落的结构性差异。
Verticilliumdahliae是导致植物黄萎病的主要致病菌。本试验结果同时表明, 同轮作相比, 马铃薯的连作也导致了根际土壤Verticilliumdahliae(Accession no. AF104926, 同源性为98%—99%)数量的增加。有关于Verticilliumdahliae拮抗菌的筛选和应用研究目前也有较多的报道, 主要以Bacillussubtilis为主, Luo等[20]和Lang等[11]通过将筛选到Bacillussubtilis经二次固体发酵结合到有机类肥料中进而施用到作物根际达到了较好的抑制作物土传病害的目的。类似的研究如Zhang等[40]在黄瓜的枯萎病和Zhao等[41]在甜瓜的枯萎病上均有积极的报道, 这种将外源拮抗微生物引入到作物根际并结合充足的有机碳氮源补给实现其在根表的有效定殖的对土传病害的生防策略也为我们在甘肃省中部沿黄灌区的马铃薯连作障碍土壤机理研究和连作障碍的防控研究中提供了新的思路。马铃薯的长期连作是否也会导致植株根际土著的有益微生物在种群数量或个体数量上的减少, 功能多样性的衰退? 另外, 本研究中通过DGGE技术和DNA测序观察到的一些与马铃薯土传病害有关的致病菌数量的增加是否对应着根际有益微生物数量的减少, 二者是否存在协调一致的关系? 这些猜测均需进一步地研究核实。
4 结论
马铃薯的连作种植较轮作显著降低了块茎产量和植株的生物量以及经济生产力, 也改变了植株干物质在地上和地下器官的分配。与轮作相比, 连作马铃薯根际真菌的种群数量和多样性无显著差异, 但真菌群落结构上发生了显著地变化, 这可能造成试验区马铃薯连作障碍产生的原因之一。此外, 马铃薯连作增加了一些与土传病害有关的真菌致病菌的种群或个体数量, 如Fusariumsp.和Fusariumsolani以及Verticilliumdahliae, 但其作用机制尚需进一步地研究。
[1] 沈宝云, 余斌, 王文, 张俊莲, 王蒂. 腐植酸铵、有机肥、微生物肥配施在克服甘肃干旱地区马铃薯连作障碍上的应用研究. 中国土壤与肥料, 2011, (2): 68- 70.
[2] 凌宁, 王秋君, 杨兴明, 徐阳春, 黄启为, 沈其荣. 根际施用微生物有机肥防治连作西瓜枯萎病研究. 植物营养与肥料学报, 2009, 15(5): 1136- 1141.
[3] Kennedy A C, Stubbs T L. Soil microbial communities as indicators of soil health. Annals of Arid Zone, 2006, 45(3/4): 287- 308.
[4] Omirou M, Rousidou C, Bekris F, Papadopoulou K K, Menkissoglou-Spiroudi U, Ehaliotis C, Karpouzas D G. The impact of biofumigation and chemical fumigation methods on the structure and function of the soil microbial community. Microbial Ecology, 2011, 61(1): 201- 213.
[5] Thirup L, Johansen A, Winding A. Microbial succession in the rhizosphere of live and decomposing barley roots as affected by the antagonistic strainPseudomonasfluorescensDR54-BN14 or the fungicide imazalil. FEMS Microbiology Ecology, 2003, 43(3): 383- 392.
[6] Garbeva P, van Veen J A, van Elsas J D. Assessment of the diversity, and antagonism towardsRhizoctoniasolaniAG3, ofPseudomonasspecies in soil from different agricultural regimes. FEMS Microbiology Ecology, 2004, 47(1): 51- 64.
[7] Pedersen B S, Mills N J. Singlevs. multiple introduction in biological control: the roles of parasitoid efficiency, antagonism and niche overlap. Journal of Applied Ecology, 2004, 41(5): 973- 984.
[8] Savario C F, Hoy J W. Microbial communities in sugarcane field soils with and without a sugarcane cropping history. Plant and Soil, 2011, 341(1/2): 63- 73.
[9] Li C G, Li X M, Kong W D, Wu Y, Wang J G. Effect of monoculture soybean on soil microbial community in the Northeast China. Plant and Soil, 2010, 330(1/2): 423- 433.
[10] Yao H Y, Jiao X D, Wu F Z. Effects of continuous cucumber cropping and alternative rotations under protected cultivation on soil microbial community diversity. Plant and Soil, 2006, 284(1/2): 195- 203.
[11] Lang J J, Hu J, Ran W, Xu Y C, Shen Q R. Control of cotton Verticillium wilt and fungal diversity of rhizosphere soils by bio-organic fertilizer. Biology and Fertility of Soils, 2012, 48(2): 191- 203.
[12] Larkin R P, Honeycutt C W. Effects of different 3-year cropping systems on soil microbial communities and rhizoctonia diseases of potato. Phytopathology, 2006, 96(1): 68- 79.
[13] Wang Y, Marschner P, Zhang F S. Phosphorus pools and other soil properties in the rhizosphere of wheat and legumes growing in three soils in monoculture or as a mixture of wheat and legume. Plant and Soil, 2012, 354(1/2): 283- 298.
[14] Griffiths B S, Ritz K, Ebblewhite N, Dobson G. Soil microbial community structure: effects of substrate loading rates. Soil Biology and Biochemistry, 1998, 31(1): 145- 153.
[15] Steenwerth K L, Jackson L E, Calderón F J, Stromberg M R, Scow K M. Soil microbial community composition and land use history in cultivated and grassland ecosystems of coastal California. Soil Biology and Biochemistry, 2002, 34(11): 1599- 1611.
[16] Marschner P, Kandeler E, Marschner B. Structure and function of the soil microbial community in a long-term fertilizer experiment. Soil Biology and Biochemistry, 2003, 35(3): 453- 461.
[17] Tabuchi H, Kato K, Nioh I. Season and soil management affect soil microbial communities estimated using phospholipid fatty acid analysis in a continuous cabbage (Brassicaoleraceavar.capitata) cropping system. Soil Science and Plant Nutrition, 2008, 54(3): 369- 378.
[18] Ames R N, Reid C P P, Ingham E R. Rhizosphere bacterial population responses to root colonization by a vesicular-arbuscular mycorrhizal fungus. New Phytologist, 1984, 96(4): 555- 563.
[19] Bakker A W, Schippers B. Microbial cyanide production in the rhizosphere in relation to potato yield reduction andPseudomonasspp-mediated plant growth-stimulation. Soil Biology and Biochemistry, 1987, 19(4): 451- 457.
[20] Luo J, Ran W, Hu J, Yang X M, Xu Y C, Sheng Q R. Application of bio-organic fertilizer significantly affected fungal diversity of soils. Soil Science Society of America Journal, 2010, 74(6): 2039- 2048.
[21] 卜洪震, 王丽宏, 尤金成, 肖小平, 杨光立, 胡跃高, 曾昭海. 长期施肥管理对红壤稻田土壤微生物量碳和微生物多样性的影响. 中国农业科学, 2010, 43(16): 3340- 3347.
[22] 张晶, 张惠文, 李新宇, 苏振成, 张成刚. 土壤微生物生态过程与微生物功能基因多样性. 应用生态学报, 2006, 17(6): 1129- 1132.
[23] 罗佳, 蒋小芳, 孟琳, 黄启为, 徐阳春, 沈其荣, 杨兴明. 不同堆肥原料的有机无机复合肥对油菜生长及土壤供氮特性的影响. 土壤学报, 2010, 47(1): 97- 106.
[24] Uppal A K, El Hadrami A, Adam L R, Tenuta M, Daayf F. Biological control of potatoVerticilliumwilt under controlled and field conditions using selected bacterial antagonists and plant extracts. Biological Control, 2008, 44(1): 90- 100.
[25] Gazendam I, Oelofse D, Berger D K. High-level expression of apple PGIP1 is not sufficient to protect transgenic potato againstVerticilliumdahliae. Physiological and Molecular Plant Pathology, 2004, 65(3): 145- 155.
[26] 王晶英, 郑桂萍, 张红燕, 李国兰. 连作大豆根冠比增大原因的研究. 大豆科学, 1997, 16(2): 136- 142.
[27] 吴正锋, 成波, 王才斌, 郑亚萍, 刘俊华, 陈殿绪, 高新华. 连作对花生幼苗生理特性及荚果产量的影响. 花生学报, 2006, 35(1): 29- 33.
[28] 马海燕, 徐瑾, 郑成淑, 孙霞, 束怀瑞. 非洲菊连作对土壤理化性状与生物性状的影响. 中国农业科学, 2011, 44(18): 3733- 3740.
[29] 刘建国, 张伟, 李彦斌, 孙艳艳, 卞新民. 新疆绿洲棉花长期连作对土壤理化性状与土壤酶活性的影响. 中国农业科学, 2009, 42(2): 725- 733.
[30] 吕卫光, 余廷园, 诸海涛, 沈其荣, 张春兰. 黄瓜连作对土壤理化性状及生物活性的影响研究. 中国生态农业学报, 2006, 14(2): 119- 121.
[31] 张瑞明, 朱建华, 高善民, 李珍珍, 林天杰, 陆利民, 杨忠, 唐纪华. 沪郊设施菜地连作土壤盐分积累及离子组成变化的研究. 上海农业学报, 2011, 27(4): 76- 79.
[32] 贡璐, 张海峰, 吕光辉, 杜东伟. 塔里木河上游典型绿洲不同连作年限棉田土壤质量评价. 生态学报, 2011, 31(14): 4136- 4143.
[33] 尤孟阳, 韩晓增, 李海波, 芦思佳, 梁尧. 作物连作与自然恢复下黑土密度组分中碳、氮分布特征. 中国生态农业学报, 2011, 19(6): 1301- 1306.
[34] Eskelinen A, Stark S, Männistö M. Links between plant community composition, soil organic matter quality and microbial communities in contrasting tundra habitats. Oecologia, 2009, 161(1): 113- 123.
[35] Bais H P, Weir T L, Perry L G, Gilroy S, Vivanco J M. The role of root exudates in rhizosphere interactions with plants and other organisms. Annual Review of Plant Biology, 2006, 57: 233- 266.
[36] Nelson D R, Mele P M. Subtle changes in rhizosphere microbial community structure in response to increased boron and sodium chloride concentrations. Soil Biology and Biochemistry, 2007, 39(1): 340- 351.
[37] Du M R, Ren X Y, Sun Q H, Wang Y, Zhang R F. Characterization ofFusariumspp. Causing potato dry rot in China and susceptibility evaluation of chinese potato germplasm to the pathogen. Potato Research, 2012, 55(2): 175- 184.
[38] 牛秀群, 李金花, 张俊莲, 沈宝云, 柴兆祥, 王蒂. 甘肃省干旱灌区连作马铃薯根际土壤中镰刀菌的变化. 草业学报, 2011, 20(4): 236- 243.
[39] 樊少华, 李敏权. 定西地区小麦根部镰刀菌及其致病性研究. 甘肃农业大学学报, 2007, 42(4): 71- 74.
[40] Zhang S S, Raza W, Yang X M, Hu J, Huang Q W, Xu Y C, Liu X H, Ran W, Shen Q R. Control of Fusarium wilt disease of cucumber plants with the application of a bioorganic fertilizer. Biology and Fertility of Soils, 2008, 44(8): 1073- 1080.
[41] Zhao Q Y, Dong C X, Yang X M, Mei X L, Ran W, Shen Q R, Xu Y C. Biocontrol ofFusariumwilt disease forcucumismelomelon using bio-organic fertilizer. Applied Soil Ecology, 2011, 47(1): 67- 75.
Middle Gansu Province
LIU Xing1, QIU Huizhen1,*, WANG Di2, ZHANG Junlian2, SHEN Qirong3
1CollegeofResourcesandEnvironmentalSciences,GansuProvincialKeyLabofAridlandCropScience,GansuAgriculturalUniversity,Lanzhou730070,China2CollegeofAgronomy,GansuAgriculturalUniversity,Lanzhou730070,China3CollegeofResourcesandEnvironmentalSciences,NanjingAgriculturalUniversity,Nanjing210095,China
The yellow river irrigation areas of middle Gansu Province is one of the main processing potato growing regions in the Northwest China. Potato is often grown continuously by Gansu farmers and planting enterprises eager to maximize consecutive payoffs. This practice results in the severe decline in tuber yield and loss of tuber chemical qualities. Field studies was conducted to evaluate the differences in fungal community structure of rhizosphere soils of potato between rotation and continuous cropping systems in order to find the new evidence for the study on continuous cropping obstacle in Yellow River Irrigation Areas of Middle Gansu Province. In experimental site, three potato planting plots nearby each other were selected for this research, one is the rotation plot, namely, non continuous potato cropping, and two other plots had been continuously planted potato over 3 and 6 years, respectively. Rhizosphere soil samples were collected at 2011 potato harvest time, and then soil DNA was extracted. Subsequently, polymerase chain reaction (PCR)-denaturing gradient gel electrophoresis (DGGE) was performed to analyse fungal community structure. The results revealed that continuous potato cropping significantly decreased tuber yield and plant biomass compared with potato rotation, and more seriously with the continuous potato cropping duration. In addition, continuous potato cropping over long-term significantly increased the ratio of root to shoot and also caused the decline in economic productivity of potato crop. There were no significant differences in fungal population quantity and diversity indices of rhizosphere soils between rotation and continuous cropping systems, whereas the obvious shift in community structure occurred. Sequence analysis of fungal 18S rDNA gene confirmed that continuous potato cropping increased population quantity or individual number ofFusariumsp. andFusariumsolanias well asVerticilliumdahliae. Our results suggested that the decline of tuber yield and plant biomass in continuous potato cropping system might be associated with the change in fungal community structure of rhizosphere soils of potato, especially the increase in pathogen dynamic.
potato; rotation and continuous cropping; fungal community structure; microbial diversity
公益性行业(农业)科研专项(201103004); 国家科技支撑计划(2012BAD06B03); 国家马铃薯产业技术体系(CARS- 10-P18); 甘肃省科技重大专项(1102NKDA025)
2013- 08- 21;
2014- 07- 02
10.5846/stxb201308212122
*通讯作者Corresponding author.E-mail: hzqiu@gsau.edu.cn
刘星, 邱慧珍, 王蒂, 张俊莲, 沈其荣.甘肃省中部沿黄灌区轮作和连作马铃薯根际土壤真菌群落的结构性差异评估.生态学报,2015,35(12):3938- 3948.
Liu X, Qiu H Z, Wang D, Zhang J L, Shen Q R.Evaluation on fungal community structure of rhizosphere soils of potato under rotation and continuous cropping systems in Yellow River Irrigation Areas of Middle Gansu Province.Acta Ecologica Sinica,2015,35(12):3938- 3948.

