轴向取代可溶性硅酞菁衍生物制备与性能测试
朱赛江,周宇扬*,王筱梅*,戚守善
(1.江苏省环境功能材料重点实验室,江苏苏州215009;2.苏州科技学院化学生物与材料工程学院江苏苏州215009)
轴向取代可溶性硅酞菁衍生物制备与性能测试
朱赛江1,2,周宇扬1,2*,王筱梅1,2*,戚守善1,2
(1.江苏省环境功能材料重点实验室,江苏苏州215009;2.苏州科技学院化学生物与材料工程学院江苏苏州215009)
制备了一系列烷氧基轴向取代硅酞菁,改善了硅酞菁在有机溶剂中的溶解性;轴向取代的金属酞菁配合物相对于周边取代的金属酞菁配合物更易于制备。对这3个化合物进行了系统的结构表征(核磁氢谱、红外光谱、液相色谱-质谱联用),证实了这3个化合物是目标产物,并在不同溶剂中对它们进行紫外光谱、荧光光谱测试。
硅酞菁;轴向取代;溶解性
酞菁化合物自被发现以来,由于其具有独特的结构和优良的性能,引起了各国化学工作者的极大兴趣[1-5]。人们对于酞菁及其衍生物进行了大量研究,发现其具有良好的热和化学稳定性以及独特的光、电、磁和催化等性能[6-14],因而在颜料染料、化学传感器、电致变色、液晶显示材料、太阳能电池和医学等许多领域应用广泛。但是,由于溶解度差、提纯难等因素,极大地限制了酞菁在上述领域的应用。
笔者制备了一系列烷氧基轴向取代硅酞菁,改善了硅酞菁在有机溶剂中溶解性;轴向取代的金属酞菁配合物相对于周边取代的金属酞菁配合物来说,易于制备。轴向引入配体,可使Q带的吸收峰红移。更重要的是,由于酞菁配合物本身固有的大环共轭体系,不可避免地产生分子间聚集现象而大大缩短激发态寿命和降低光敏化效率。在中心金属上引入轴向配体,酞菁分子中心金属离子与一些配体形成轴向配合物,从平面构型向立体构型转化后,阻碍酞菁芳环之间的相互作用,可减少聚集,提高光敏化效率。
1 实验部分
1.1 试剂及仪器
1,3-二亚氨基异吲哚啉(98%J&K);四氯化硅(98%J&K);正丁醇、正己醇、正辛醇购自百灵威公司;其余药品、溶剂为市购分析纯试剂。1H核磁谱由400 MHz Bruker Avance III型核磁共振谱仪测量。红外光谱由傅里叶变换红外光谱仪(Nicolet,Nexus 670,美国Perkin公司)进行表征,采用KBr压片法,扫描范围400~4 000 cm-1,分辨率为2 cm-1。紫外-可见吸收光谱在UV-7504 PC紫外分光光度计上测定。
1.2 实验步骤
实验步骤如图1所示。
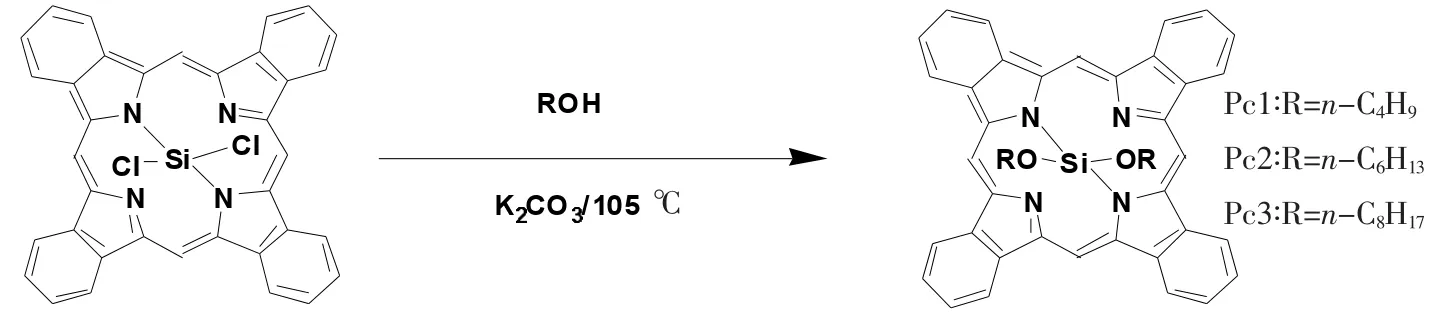
图1 轴向取代反应示意图
1.2.1 二氯硅酞菁的合成
在装有搅拌和回流装置的100 mL四口烧瓶中加入1,3-二亚氨基异吲哚啉3 g、四氯化硅4.2 mL和喹啉42.0 mL。在220℃回流30 min,降温至80℃时将生成物倾入80.0 mL甲醇中,打浆后趁热过滤,滤饼依次用喹啉、甲苯、甲醇和丙酮洗涤,干燥后可得紫红色二氯硅酞菁晶体2.2 g,收率为58%。
1.2.2 轴向取代硅酞菁的合成
在装有回流装置的50 mL三口烧瓶中加入n-C4H9OH 20 mL,酞菁二氯化硅0.1 g,碳酸钾0.5 g,升温至105℃反应72 h。反应中,正丁醇作为溶剂也作反应物。待反应结束,取出反应液,过滤,用蒸馏水和乙醇反复冲洗,真空干燥得正丁醇取代硅酞菁(Pc1)蓝色粉末0.097 g,产率为78.5%Pc1:1H NMR(CDCl3,400 MHz,TMS):δ,ppm-2.12~-2.09(m,4H,CH2-H),-1.72~-1.68(m,4H,CH2-H),-1.36~-1.30(m,4H,CH2-H),-0.67~-0.63(m,6H,CH3-H),8.35~8.37(m,8H,Ar-H),9.65~9.67(m,8H,Ar-H)。
其余两种化合物的合成与之类似,得到正己醇轴向取代硅酞菁(Pc2)蓝色粉末0.076 g,产率为57.3% Pc2:1H NMR(CDCl3,400 MHz,TMS):δ,ppm-2.11~-2.08(m,4H,CH2-H),-1.69~-1.66(m,4H,CH2-H),-1.44~-1.40(s,4H,CH2-H),-0.47~-0.44(s,4H,CH2-H),0.21~0.23(m,10H,CH2-H,CH3-H),8.34~8.36(m,8H,Ar-H),9.64~9.67(m,8H,Ar-H);得到正辛醇轴向取代硅酞菁(Pc3)蓝色粉末0.068 g,产率为54.2% Pc3:1H NMR(CDCl3,400 MHz,TMS):δ,ppm-2.11~-2.08(m,4H,CH2-H),-1.70~-1.65(m,4H,CH2-H),-1.43~-1.39(m,4H,CH2-H),-0.39~-0.35(m,4H,CH2-H),-0.13~-0.10(m,4H,CH2-H),0.88~0.91(-0.13~-0.10(m,4H,CH2-H),1.27(s,10H,CH2-H,CH3-H),8.34~8.37(m,8H,Ar-H),9.65~9.67(m,8H,Ar-H)。
1.3 化合物表征
1.3.1 液相色谱质谱联用
采用液相色谱质谱联用的方法对化合物进行检测,测得的实际分子量与目标产物实际分子量见表1,虽然有少许误差,但结合后边的核磁与红外表征结果,可以初步证实合成的化合物确实为目标产物。
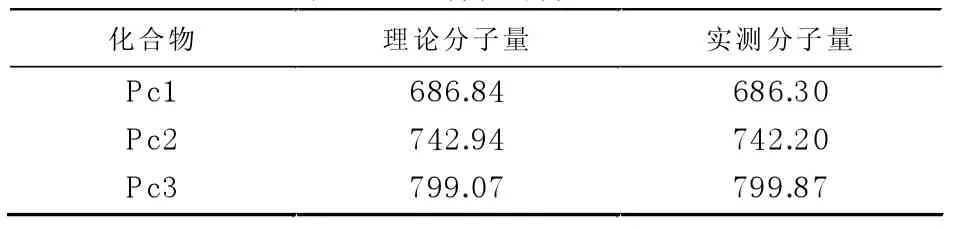
表1 目标产物分子量
1.3.2 傅里叶-红外光谱
化合物Pc1-Pc3红外光谱图如图2所示。由图2可以看出,合成的3个物质都具有酞菁化合物的特征振动。3 044 cm-1处的峰对应的是酞菁分子芳环上C-H键的伸缩振动,1 611 cm-1与1 518 cm-1附近的峰为芳环上C-C键和C-N键的伸缩振动引起,在710~830 cm-1附近为-CH2-的摇摆振动引起。在波数为500~1 500 cm-1范围内的峰随着酞菁化合物轴向烷基链的增加而增多。

图2 化合物Pc1-Pc3红外光谱图
2 性能表征
2.1 硅酞菁溶解性的改善
没有取代基的二氯硅酞菁在THF中微溶,在其他有机溶剂中几乎不溶解。笔者所制备的几种烷氧基取代的硅酞菁均具有较好的脂溶性,并且随着烷氧基碳链的增长,溶解能力逐渐提高,均可完全溶解于THF、氯仿、二氯甲烷等有机溶剂,不溶于水。如图3、4、5、6所示。
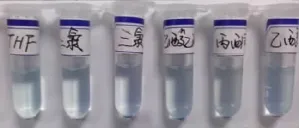
图3 无取代基的二氯硅酞菁溶解能力实物图

图4 正丁醇取代硅酞菁溶解能力实物图

图5 正己醇取代硅酞菁的溶解能力实物图
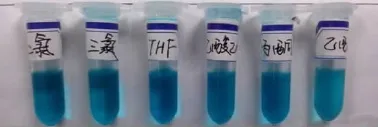
图6 正辛醇取代硅酞菁的溶解能力实物图
硅酞菁衍生物的烷氧基长链分别位于酞菁环平面的上下两侧,由于烷氧基的空间位阻作用,使得酞菁分子间的聚集作用明显降低,并且随着烷氧基链长的增加,这种空间位阻作用更明显,因此,硅酞菁衍生物的溶解能力随着烷氧基碳链的增长而增加。
2.2 紫外-可见吸收光谱
紫外-可见吸收光谱如图7、8、9所示。3种化合物在不同溶剂中吸收峰位汇总见表2。
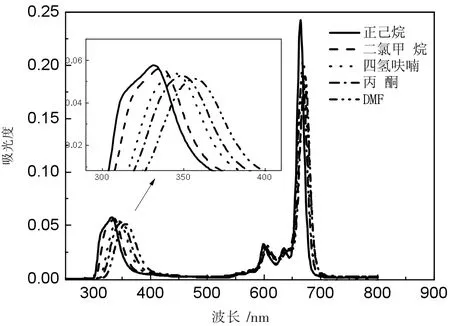
图7 化合物Pc1在不同溶剂中的吸收图
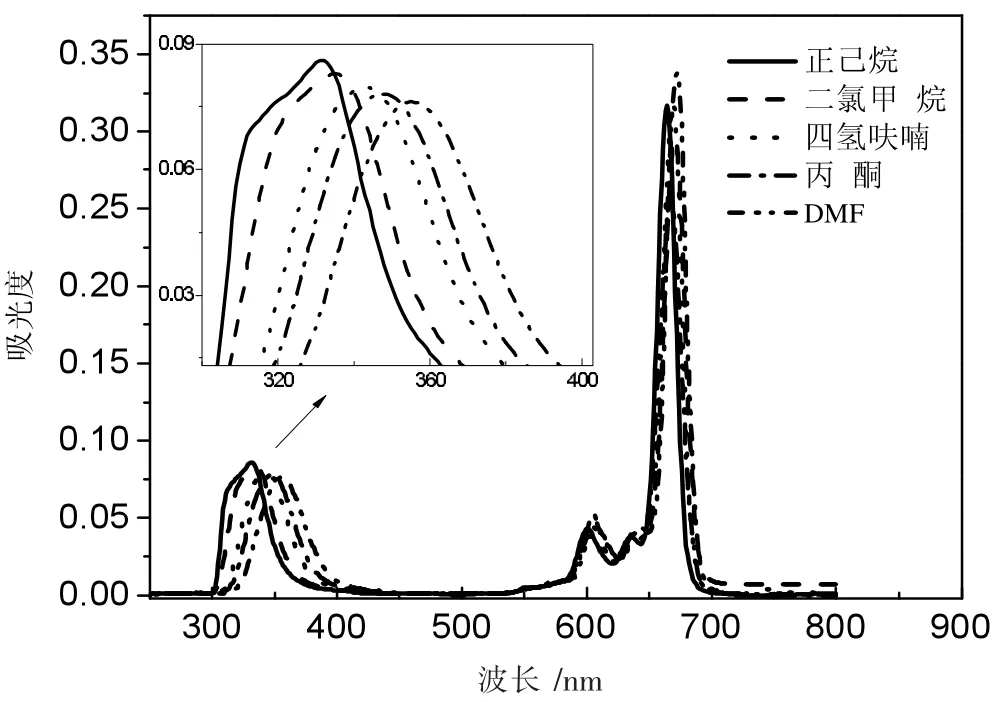
图8 化合物Pc2在不同溶剂中的吸收图

图9 化合物Pc3在不同溶剂中的吸收图

表2 3种化合物在不同溶剂中吸收峰位汇总表
上述3个图分别用环己烷、二氯甲烷、四氢呋喃、丙酮、DMF五种溶剂,配制成浓度为10-6mol·L-1的溶液进行测试。酞菁化合物的紫外吸收有两个特征明显的吸收,分别是吸收波长在300~400 nm的B带吸收和吸收波长在650~700 nm的Q带吸收。3种化合物在不同的溶剂中表现出同样的性质,随着溶剂极性的增加,紫外吸收峰发生红移。
2.3 荧光光谱
荧光光谱如图10、11、12所示。荧光测试的溶液浓度都为10-6mol·L-1,激发波长都为620 nm。
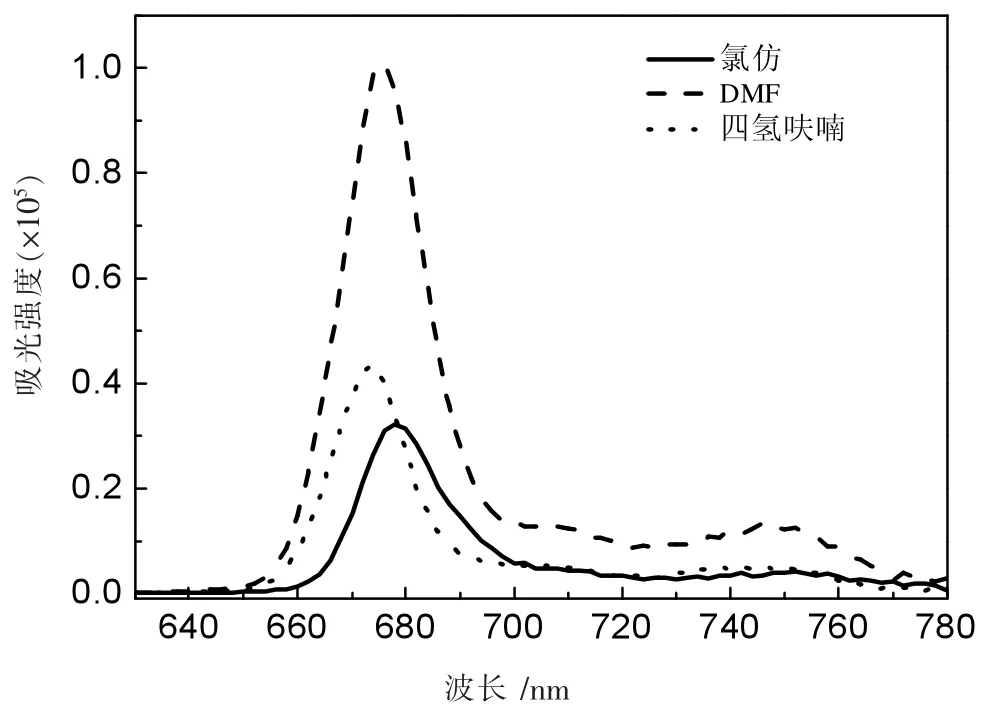
图10 化合物Pc1荧光图

图11 化合物Pc2荧光图

图12 化合物Pc3荧光图
从图10、11、12中可以看出3个化合物在3种不同溶剂中的发光峰位不尽相同,3种化合物在二氯甲烷中的荧光发光峰位都在678 nm,在四氢呋喃中的荧光峰位于674 nm,在N,N-二甲基甲酰胺(DMF)中的发光峰位于676 nm。
3 结语
合成了3个轴向取代硅酞菁的化合物,对这3个化合物进行了系统的结构表征,证实是目标产物。并对产物进行了紫外光谱、荧光光谱测试。3个轴向取代的化合物,溶解性得到了很大的改善,为下一步应用打下了坚实的基础。
[1]H R Stadelmann.Investigation of the fluorescence of H2-phthalocyanine[J].Journal of Luminescence,1972,5(3):171-186.
[2]Rafik O Loutfy.Ricardo Aroca.Interaction of indium metal with phthalocyanine molecules:Luminescence enhancement[J].Journal of Luminescence,1982,26(4):359-366.
[3]Tanya N Singh-Rachford,Felix N Castellano.Pd(II)Phthalocyanine-Sensitized Triplet-Triplet Annihilation from Rubrene[J].J Phys Chem,A,2008,112(16),3550-3556.
[4]M Isaacs,M J Aguirre,A Toro-Labbe,et al.Comparative study of the electrocatalytic activity of cobalt phthalocyanine and cobalt naphthalocyanine for the reduction of oxygen and the oxidation of hydrazine[J].Electrochimica Acta,1998,43(12-13):1821-1827.
[5]Wu M,Yang Z H,Jiang Y H,et al.Improvement of dye-sensitized solar cell performance through electrodepositing a close-packed TiO2film[J]. Journal of Solid State Electrochemistry,2010,14(5):857-863.
[6]Dou k,Zhang J S,Xu W,et al.Luminescence and relaxation of the excited states in covalent-linked tetratolylporphyrin-phthalocyanine[J].Journal of Luminescence,1994,60,465-468.
[7]Imakita K,Ito M,Fujii M,et al.Nonlinear optical properties of Phosphorous-doped Si nanocrystals embedded in phosphosilicate glass thin films[J].Optics Express,2009,17(9):7368-7376.
[8]Sheng C X,Norwood R A,Wang J F,et al.Nonlinear optical transmission of lead phthalocyanine-doped nematic liquid crystal composites for multiscale nonlinear switching from nanosecond to continuous wave[J].Applied Optics,2009,48(14):2731-2734.
[9]Yamane H,Kikuchi H,KajiyamaT.Laser-addressing rewritable optical information storage of(liquid crystalline side chain copolymer/liquid crystals/photo-responsive molecule)ternary composite systems[J].Polymer,1999,40(17):4777-4785.
[10]Esselbach M,Cedilnik G,Kiessling A.Optical information storage using refresh via phase conjugation[J].Optics&Laser Technology,1999,31(8):579-582.
[11]Gan F X,Hou L S,Wang G B,et al.Optical and recording properties of short wavelength optical storage materials[J].Materials Science and Engineering,B,2000,76(1):63-68.
[12]Lee H K,Doi K,Kanazawaa A,et al.Light-scattering-mode optical switching and image storage in polymer/liquid crystal composite films by means of photochemical phase transition[J].Polymer,2000,41(5):1757-1763.
[13]Xu G,Yang Q G,Si J,et al.Application of all-optical poling in reversible optical storage in azopolymer films[J].Optics Communications,1999,159(1-3):88-92.
[14]He C J,Chen Y,Nie Y X,et al.Third order optical nonlinearities of eight-β-octa-octyloxy-phthalocyanines[J].Optics Communications,2007,271(1),253-256.
[15]Torre G D L,Vazquez P,Agullo-Lopez F,et al.Phthalocyanines and related compounds:organic targets for nonlinear optical applications[J]. Journal Materials Chemistry,1998,8:1671-1683.
[16]Komatsu T,Ohta K,Fujimotob T,et al.Liquid-crystalline behaviour and electrochromism in bis(octakis-n-alkylphthalocyaninato)lutetium(III)complexes[J].Journal of Materials Chemistry,1994,4:533-536.
Preparation and investigation of axially substituted soluble silicon phthalocyanine complexes
ZHU Saijiang1,2,ZHOU Yuyang1,2,WANG Xiaomei1,2,QI Shoushan1,2
(1.Jiangsu Key Laboratory for Environment Functional Materials,Suzhou 215009,China;2.School of Chemistry,Biology and Material Engineering,SUST,Suzhou 215009,China)
In this paper,a series of alkoxy phthalocyanine with axially substituted silicon were prepared and synthesized,and their solubility in common organic solvent was improved.Compared with the preparation of peripherally substituted metal phthalocyanine complexes,that of these axially substituted metal phthalocyanine complexes was easier.Their chemical structures were characterized by1H NMR,IR,LC mass.Furthermore,their UV spectra and fluorescence spectra in different solvents were investigated.
silicon phthalocyanine;axial substitution;solubility
TB333
A
1672-0687(2015)02-0047-05
责任编辑:李文杰
2014-10-31
国家自然科学基金资助项目(51273141);江苏省环境功能材料重点实验室开放课题(SJHG1305);苏州科技学院校基金项目(XKQ201419)
朱赛江(1990-),男,江苏海门人,硕士研究生,研究方向:光电功能材料。
*通信联系人:周宇扬(1986-),男,讲师,博士,E-mail:zhouyuyang@mail.usts.edu.cn。王筱梅(1958-),女,教授,博士生导师,E-mail:wangxiaomei@mail.usts.edu.cn。

