芴液相催化氧化制取9-芴酮
赵 明,辛燕平,许春建
(天津大学化工学院,化学工程联合国家重点实验室,天津300072)
9-芴酮,亦称次联苯甲酮,俗称芴酮,分子式为C13H8O,黄色斜方晶体,不纯时有荧光,不溶于水,溶于乙醇、丙酮、苯,易溶于乙醚、甲苯等[1]。9-芴酮用途非常广泛,是重要的有机合成原料[2],同时也是一种价格昂贵的精细化工中间体。在医药工业,9-芴酮是合成抗痉挛药物2-羟氨乙酰芴酮的重要中间体;在农业领域,用于合成杀虫剂和植物生长调节剂等;在染料工业,用于合成芳香二胺染料;在塑料工业,由9-芴酮合成的双酚芴产品是广泛用作新型工程塑料的重要单体与改性剂[3]。
芴是煤焦油主要组分之一,价格便宜,主要从煤焦油的洗油中提取。从洗油中分离芴,并以其为原料制取9-芴酮,将显著提高煤焦油的附加值,所以受到各国学者的广泛关注。
以芴为原料制取9-芴酮的工艺方法主要有3种:第1种是直接氧化法,采用高价金属氧化物或高价金属盐做氧化剂,如CrO3[4]、Na2Cr2O7
[5]等,该方法存在反应速率慢、环境污染严重、产物的选择性低和分离难等问题。第2种是气相氧化法[6],在高温下将芴气化,空气催化氧化制取9-芴酮,此法无废液产生,是理想的制取9-芴酮的工业方法,但此法所需催化剂的制备过程复杂,而且容易发生深度氧化。第3种是液相氧化法[7-10],芴直接参与反应或将其溶解在有机溶剂中,催化氧化制取9-芴酮,此法反应条件温和,设备投资少,9-芴酮收率高,特别适合9-芴酮的小批量生产。所以文献报道越来越趋向于研究芴液相催化氧化体系。
随着环保意识的增强和绿色有机合成化学的发展,研究者不断寻求对环境无污染的新型催化工艺。固体碱催化剂具有催化活性高、使用寿命长、分离性能好、产物选择性高、环境友好等诸多优点,在有机合成中被广泛使用。然而,固体碱催化剂由于造价高、不易保存、易变质和对设备要求较高等劣势,发展比较缓慢,因此,开发新型的固体碱催化剂是今后重点研究内容之一。
由于芴结构式中两苯环的存在,使两环之间的亚甲基显“酸性”,在碱性催化剂作用下,可以实现芴的催化氧化反应[11]。本研究使用固体碱来催化氧化制取9-芴酮,考察了催化剂种类、催化剂用量、溶剂种类、氧气流量、温度、反应时间和搅拌速率等因素对反应的影响,同时考察了催化剂回收再利用情况。
1 实验部分
1.1 实验装置及流程
芴液相催化氧化反应实验装置如图1所示。
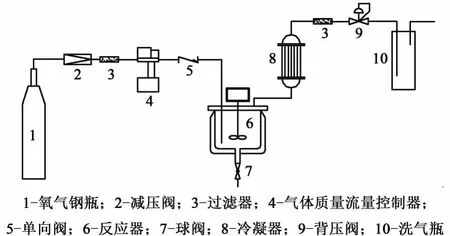
图1 实验装置示意图Fig.1 Schem atic diagram of experim ental equipm ent
芴液相催化氧化反应装置主要包括反应体积为0.2 L的反应釜和精确控制气体流量的质量流量控制器。
分别称取溶剂与固体芴置于烧杯中搅拌,使芴充分溶解,第1次取样分析,将反应液移入反应釜内,加入催化剂,开启加热装置,升到指定温度后,启动搅拌装置,打开氧气阀门,将氧气流量设定在指定的数值,每间隔30 m in取样分析,反应达到平衡后,停止反应,分离出催化剂,对9-芴酮溶液进行常压蒸馏操作,蒸出溶剂,得到粗9-芴酮产品。
1.2 分析方法
本实验采用安捷伦7890A气相色谱仪进行分析,色谱条件为:1)载气为 N2,流速 30 m L/min,氢火焰检测器,氢气流速 30 m L/min,空气流速300 m L/min;2)进样室温度:300℃;检测室温度:300℃;柱温采用程序升温,初温 150℃,保持5 min,然后以20℃/min升到250℃,保持2 min。
采用校正因子归一化法计算反应产物各组分的含量。
2 实验结果与讨论
2.1 催化剂种类对反应的影响
本实验考察了催化剂与芴质量比为0.06∶1.00,溶剂用量为30 m L,氧气流量12 m L/min,温度40℃,反应时间4 h,转速300 r/m in的条件下,催化剂种类对反应的影响,结果见表1。

表1 催化剂种类对反应的影响Table 1 In fluence of catalyst species on the reaction
从表1可以看出,没有催化剂参与,反应不能发生。NaOH的催化效果最佳,芴的转化率高达99.26%,9-芴酮收率为95.35%。催化剂的碱性越强,芴结构式中两环之间亚甲基的氢越容易失去,反应越容易进行。实验用到的4种催化剂,在相同的质量条件下,NaOH碱性最强,所以芴的转化率和9-芴酮的收率最高。同时,从经济角度考虑,以NaOH作催化剂最适宜。
2.2 催化剂用量对反应的影响
本实验考察了溶剂用量为30 m L,芴9.97 g,氧气流量12 m L/min,温度40℃,反应时间4 h,转速300 r/m in的条件下,催化剂用量对反应的影响,结果见图2。

图2 催化剂用量对反应的影响Fig.2 In fluence of catalyst am ount on the reaction
从图2看出,没有催化剂参与时,反应几乎不能发生,加入催化剂后,芴的转化率和9-芴酮的收率增幅明显,当催化剂用量与原料质量比为0.06时,芴的转化率和9-芴酮的收率都达到最适宜,继续增加催化剂用量,对芴的转化率和9-芴酮的收率不会产生明显影响。其原因在于:当催化剂用量较少时,催化活性中心不多,反应速率较慢,芴的转化率和9-芴酮的收率都不高,增大催化剂用量有利于促进了芴基阴离子的形成,该芴基阴离子与氧气结合形成大量芴过氧自由基,从而使反应速率大大加快,芴的转化率和9-芴酮的收率得到提高。故在本实验中,选择催化剂NaOH的用量与原料芴质量比为0.06较为合适。
2.3 溶剂种类对反应的影响
本实验考察了催化剂与芴质量比为0.06∶1.00,溶剂用量为30 m L,氧气流量12 m L/min,温度40℃,反应时间4 h,转速300 r/min的条件下,溶剂种类对反应的影响,结果见表2。

表2 溶剂种类对反应的影响Table 2 In fluence of different solven ts on the reaction
在液相催化氧化反应中,溶剂的作用不仅仅使反应物溶解,更主要的是能够实现溶剂、催化剂和反应底物的相互作用。如果能找到合适的溶剂,不仅可以促进反应的进行,还可能会抑制副反应的发生。溶剂可分为质子溶剂和非质子溶剂,非质子溶剂又可分为极性非质子溶剂和非极性非质子溶剂。实验中所用的溶剂,既有质子性溶剂,比如乙醇、冰乙酸等,又有极性非质子溶剂,如喹啉、吡啶、DMSO、DMPU等,还有非极性非质子溶剂,如对二甲苯等。经过实验比较,我们发现,当采用非质子极性溶剂时,芴的转化率和9-芴酮收率明显高于其他两类溶剂,在有催化剂参与的芴氧化反应,非质子极性溶剂对反应有明显的加速作用,可以促进芴结构式中的亚甲基失去质子形成芴基阴离子,使反应得以顺利进行。在参与的4种非质子极性溶剂中,DMPU作溶剂时的芴转化率和9-芴酮收率最高,所以选取DMPU作为反应的溶剂。合适的溶剂用量有利于反应物和反应产物在溶剂中的扩散,对于溶剂的用量,以充分溶解芴为宜,本实验选取的溶剂用量为30 m L。
2.4 氧气流量对反应的影响
本实验考察了催化剂与芴质量比为0.06∶1.00,溶剂 DMPU为 30 mL,温度 40℃,反应时间4 h,转速300 r/m in的条件下,氧气流量对反应的影响,结果见图3。

图3 氧气流量对反应的影响Fig.3 In fluence of oxygen flow on the reaction
氧气作为反应的氧化剂,其用量的多少对反应至关重要。由图3可以看出,在氧气流量小于12 mL/min时,随着氧气流量的增大,芴的转化率和9-芴酮收率增幅明显,在氧气流量为12 m L/min时,9-芴酮收率达到最高,继续增大氧气流量,芴的转化率几乎不变,而9-芴酮的收率却有下降的趋势。其原因在于:当气体流量较小时,单位时间内参与氧化的气体量较少,与溶液中的溶质不能充分接触,传质效果较差,芴的转化率和9-芴酮收率都不高,随着气体流量的增大,单位时间内参与氧化的气体量增多,与溶液中的溶质能够进行充分接触,芴的转化率和9-芴酮收率随之增大。当气体流量超过最适宜流量时,由于反应溶液可溶解得气体量是一定值,而且溶液中溶质是有限的,芴的转化率已达到极值,如果气体流量过大,9-芴酮还有可能发生进一步氧化,从而造成9-芴酮收率降低。故在本实验中,氧气流量为12 m L/min。
2.5 温度对反应的影响
本实验考察了催化剂与芴质量比为0.06∶1.00,溶剂DMPU为30 m L,氧气流量12 m L/m in,反应时间4 h,转速300 r/min的条件下,芴的转化率和9-芴酮收率随温度的变化情况,结果见图4。
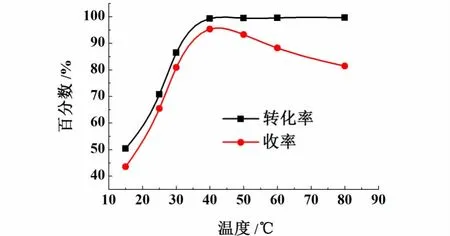
图4 温度对反应的影响Fig.4 In fluence of tem perature on the reaction
对于芴氧化反应来说,温度是重要的影响因素之一。由于芴氧化反应是放热反应,反应温度较低时对反应是有利的,但温度过低时,反应又不易发生,所以探究合适的反应温度至关重要。从图4可以看出,对于芴催化氧化反应来说,温度对芴的转化率和9-芴酮的收率影响都特别大。温度低于40℃时,随着温度的升高,芴的转化率和9-芴酮的收率增加趋势明显;在40℃时,和9-芴酮的收率达到最高;在40℃之后,芴的转化率增加不明显,而9-芴酮的收率则迅速降低,因为温度过高容易发生深度氧化,导致9-芴酮的选择性降低,使其收率减少。故本实验选择40℃作为反应的温度。
2.6 反应时间对反应的影响
本实验考察了催化剂与芴质量比为0.06∶1.00,溶剂DMPU为30 mL,氧气流量12 m L/min,温度40℃,转速300 r/m in的条件下,反应时间对反应的影响,结果见图5。

图5 时间对反应的影响Fig.5 In fluence of tim e on the reaction
由图5看出,在很短的时间内,反应就可以发生,随着反应时间的增加,芴的转化率和9-芴酮收率几乎呈直线增长,并在反应时间为4 h时9-芴酮收率达到峰值,继续增加反应时间,芴的转化率增幅不明显,但9-芴酮的收率却在降低。其原因是:该反应几乎不存在诱导期,在有一定量氧气和催化剂参与下,反应就可以发生。随着反应时间的增加,芴与氧气接触机会增大,从而使芴的转化率和9-芴酮收率增大,当反应时间为4 h时,芴的转化率高达99%,9-芴酮的收率已达到最大值,反应时间继续增加后,由于芴含量极少,氧气与9-芴酮接触几率大大增加,更容易造成9-芴酮的深度氧化,使9-芴酮收率降低。因此,最适宜的反应时间为4 h。
2.7 搅拌速率对反应的影响
一般来说,反应器的搅拌速率对反应结果影响较小,搅拌的目的主要是为了加快气体的溶解,使反应液能够与氧气充分接触,克服扩散等因素对反应的影响。本实验考察了催化剂与芴质量比为0.06∶1.00,溶剂 DMPU为 30 mL,氧气流量 12 mL/min,温度40℃,反应时间4 h的条件下,搅拌速率对反应的影响,结果见图6。
由图6所示,搅拌速率对芴的转化率和9-芴酮收率影响较小。搅拌速率增大,芴的转化率和9-芴酮的收率增大,300 r/m in达到最大值,搅拌速率继续增大,芴的转化率和9-芴酮的收率基本不变。增大搅拌速率,反应物与气体在单位时间内接触机会增加,反应速率加快,缩短反应到达平衡的时间。但是搅拌速率过高会加快设备的损耗,缩短设备的使用寿命,故选择300 r/min为反应的搅拌速率。

图6 搅拌速率对反应的影响Fig.6 Influence of stirring rate on the reaction
2.8 催化剂回收再利用实验
为了考察回收催化剂的催化性能,进行了催化剂的回收再利用实验,操作如下:反应结束后,将反应液冷却,将其倾倒在分液漏斗中,待分液后,取出下层NaOH溶液,迅速投入到反应器中,重复上述催化氧化反应的实验步骤,待反应结束后,记录反应结果,实验结果见表3。
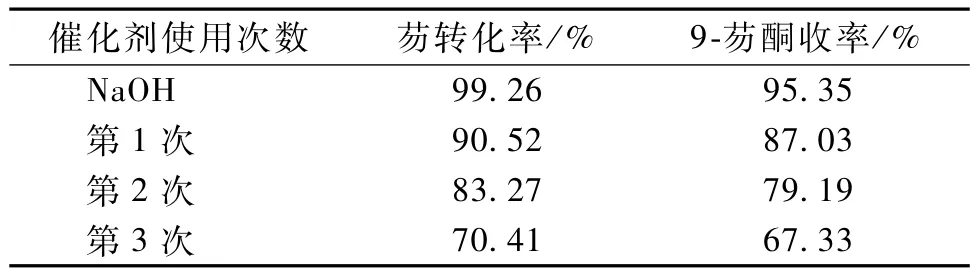
表3 回收催化剂的催化性能Table 3 Catalytic perform ance of recovery catalyst
由表3看出,催化剂经过多次使用,仍具有较好的催化活性,可以取得较好的效果。但是NaOH重复次数越多,芴的转化率和9-芴酮收率都相应降低,原因在于:反应中会有水生成,随着催化剂重复次数的增多,体系的含水量对反应结果影响较大,含水量的增加导致NaOH浓度逐渐降低,造成芴的转化率和9-芴酮收率的减小。
3 结论
在芴液相氧化法制取9-芴酮实验中,采用半连续釜式反应器进行氧化反应,通过控制变量法来考察各相关因素对反应的影响,同时考察了催化剂回收再利用情况,得出以下结论。
1)选取NaOH为反应的催化剂,且催化剂与芴质量比为 0.06∶1.00。
2)采用DMPU为反应溶剂,溶剂用量为30 m L。
3)最适宜的氧气流量为12 mL/min。
4)温度对反应结果影响最大,选择40℃为反应温度。
5)经过探究得出最适宜反应时间为4 h。
6)搅拌速率对芴的转化率影响较小,本实验的搅拌速率为300 r/m in。
7)NaOH重复使用后仍具有较好的催化活性,但重复次数不要超过3次。
[1]黄荣茂,王禹文.化学化工百科词典[M].台北:晓园出版社,1992
[2]胡连梅,张昭.2,7-二溴芴酮的合成研究[J].山西大学学报:自然科学版,2006,29(1):58-59 Hu Lianmei,Zhang Zhao.Study on synthesis of 2,7-dibromofluorenone[J].Journal of Shanxi University(Nat Sci Ed),2006,29(1):58-59(in Chinese)
[3]胡鑫,肖瑞华,赵雪飞.液相氧化法制取芴酮的研究[J].鞍山钢铁学院学报,2002,25(6):427-430
[4]Rangarajan R,Eisenbraun E J.Chromic acid oxidation of Indans and Tetralins to 1-indanones and 1-tetralones using Jones and other Cr(Ⅵ)reagents[J].The Journal of Organic Chemistry,1985,50(14),2 435-2 438
[5]Huntress E H,Hershberg E B,Cliff IS.The preparation of fluorenone from fluorene and from diphenic acid[J].Journal of the American Chemical Society,1931,53(7):2 720-2 724
[6]M leczko L,Pannek U,Baerns M.Reaction engineering simulations of a fluidized-bed reactor for selective oxidation of fluorene to 9-fluorenone[J].Chemical Engineering&Technology,1994,17(3):169-178
[7]Telvekar V N,Sasane K A.Simple and facile benzylic C-H oxidation using(diacetoxyiodo)benzene and catalytic sodium azide[J].Synthetic Communications,2012,42(9):1 325-1 329
[8]Xu Y,Hu J,Yan J.An environmentally benign benzylic oxidation catalyzed by hypervalent iodine intermediate in water[J].Chinese Chemical Letters,2012,23(8):891-894
[9]Burange A S,Kale SR,Jayaram R V.Oxidation of alkyl aromatics to ketones by tert-butyl hydroperoxide on manganese dioxide catalyst[J].Tetrahedron Letters,2012,53(24):2 989-2 992
[10]Hsu S F,Plietker B.PNNP-Ligated RuIIcomplexes as efficient catalysts for mild benzylic C-H oxidation[J].Chem Cat Chem,2013,5(1):126-129
[11]Harvey R G,Abu-Shqara E,Yang C.Synthesis of ketone and alcohol derivatives of methylene-bridged polyarenes,potentially new classes of active metabolites of carcinogenic hydrocabons[J].The Journal of Organic Chemistry,1992,57(23):6 313-6 317

