阿昔洛韦原料药变更药品包装规格可行性研究
刘芳馨,李军鸽,王文龙,于智莘
长春中医药大学,吉林长春 130117
阿昔洛韦具有抗病毒作用[1],机制是干扰DNA聚合酶,从而抑制DNA的复制[2],对多种疱疹病毒有选择抑制作用,如 HSV-1、HSV-2、VZV、CMZ 病毒等。该品能改善肝功能的作用,可用于治疗慢性乙型肝炎[3]。阿昔洛韦原料药以管制抗生素瓶包装,现有1g/瓶和2g/瓶两种规格[4],考虑到制剂单位在生产过程中需要原料药量较大,进行后续处理时需要首先开启抗生素瓶,为减少开启次数及操作工人操作步骤,节省管制抗生素瓶用量,提高用药安全,产品拟在保留原规格的基础上,增加5g/瓶规格的阿昔洛韦产品。
为证明单瓶药品装量变更的合理性,为了保证药品安全,需进行相关研究。经检验,药品规格变更后生产的阿昔洛韦符合质量标准中的要求[5],生产工艺稳定。
1 试药与仪器
阿昔洛韦(英联公司);娃哈哈纯净水(市售);日本岛津STP-10AVP型高效液相色谱仪(浙大N2000色谱工作站);分析天平(SartoriusBPZ110);超声提取器(KQ2200);数显鼓风干燥箱GZX-9000;电热恒温水浴锅DK-S26型;UV-2450紫外分光光度计。
2 方法与结果
2.1 堆密度试验
该次变更为减少不确定性,拟采用原厂家生产的同种材质抗生素管制西林瓶。为确定所需西林瓶的规格,首先进行了堆密度试验。
该试验采用传统量筒法进行测量:取阿昔洛韦原料药粉末约3 g,精密称定,置10 mL量筒中,振摇数次,测量药粉体积,记录药粉体积,由质量和体积之比求出堆密度。重复操作3次。见表1。
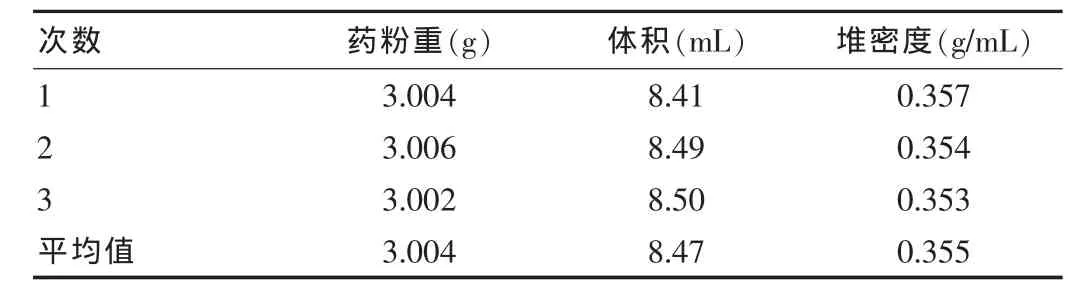
表1 堆密度试验数据
该品粉末平均堆密度为0.355 g/mL,5 g阿昔洛韦原料药粉末体积约为14 mL。公司原包装抗生素瓶规格为10 mL,采用原规格抗生素瓶无法承装。根据实际情况,结合生产实践,拟采用20 mL规格的管制抗生素瓶[6]。
2.2 装样试验
英联公司在生产阿昔洛韦原料药时,采用手动装样[7],即在D级洁净区内用不锈钢勺将原料药装入管制抗生素瓶中。
在原生产环境下,取经过预处理的管制抗生素瓶3支,置于电子天平上,去皮,用不锈钢勺将阿昔洛韦装入瓶内,每瓶5 g,精密称定,轻轻振荡;装入足够量的药粉后,观察药粉能否被倒出以及瓶内阿昔洛韦残留量;加水溶解瓶内残留药粉,观察。

表2 阿昔洛韦倾出及溶解情况
表2结果显示,在不改变直接接触药品的包装材料的前提下,改变管制抗生素瓶的体积,增加阿昔洛韦原料药的装量,不影响其被倒出的情况,瓶内仅有微量阿昔洛韦粉末残留,可用注射用水溶解。
2.3 工艺验证研究
为确认变更阿昔洛韦药品规格是否会对产品质量产生影响,药厂进行了三批中试产品工艺验证,验证过程如下。
首先对阿昔洛韦生产系统要素(操作间和设备、生产环境的洁净度、温湿度、空气压力、生产用水、人员、原辅料等)生产工艺变量进行了评价,确认无误后按照确定的工艺参数进行验证,生产三批中试规模、规格为5 g的阿昔洛韦,并依照质量标准对其进行测定,结果如表3所示。
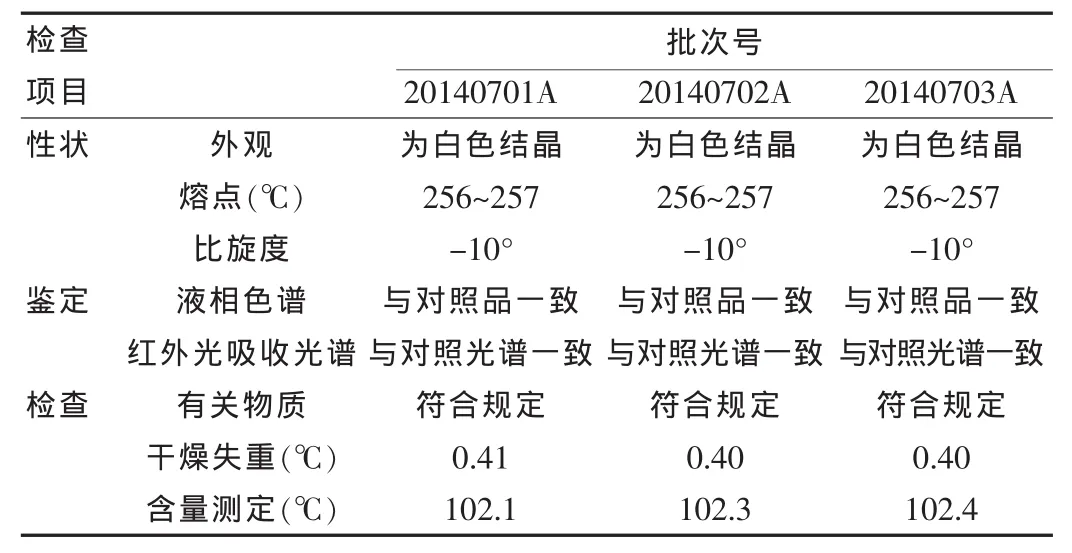
表3 中试试验产品检验结果汇总表
三批工艺验证产品检验结果表明,改变管制抗生素瓶体积和装药量后,按照确定的工艺参数生产出的产品各项检查指标均符合质量标准要求,药品装量变更对产品质量没有影响。
2.4 初步稳定性考察
加速试验 取供试样品,置于温度(40±2)℃,RH70%~80%环境条件下(干燥器置于电热恒温培养箱中,干燥器中放入 Na2CrO4饱和溶液), 按放置时间 0、1、2、3、6个月取样,检验。
长期试验:取供试样品,置于温度(25±2)℃,RH 50%~70%环境条件下(干燥器置于电热恒温培养箱中,干燥器中放入 Na2CrO4饱和溶液),按放置时间 0、3、6、9、12个月取样检验,剩余样品继续留样考察。
影响因素试验:高温试验、高湿试验、光照试验为影响因素稳定性研究的一般要求,在之前的申报材料中已经提交了相关试验数据。
因该次变更是药品规格的变更,不涉及合成工艺的改变,对阿昔洛韦原料药本身的理化性质不产生影响,故该次不进行影响因素试验[8]。
试验项目:规格变更前后考察项目均为为外观、熔点、比旋度、液相鉴别、红外鉴别、有关物质、干燥失重和含量测定。
试验方法依据中国药典2010年版二部,“阿昔洛韦”质量标准。见表4、表5。

表4 20140701批阿昔洛韦加速稳定性结果
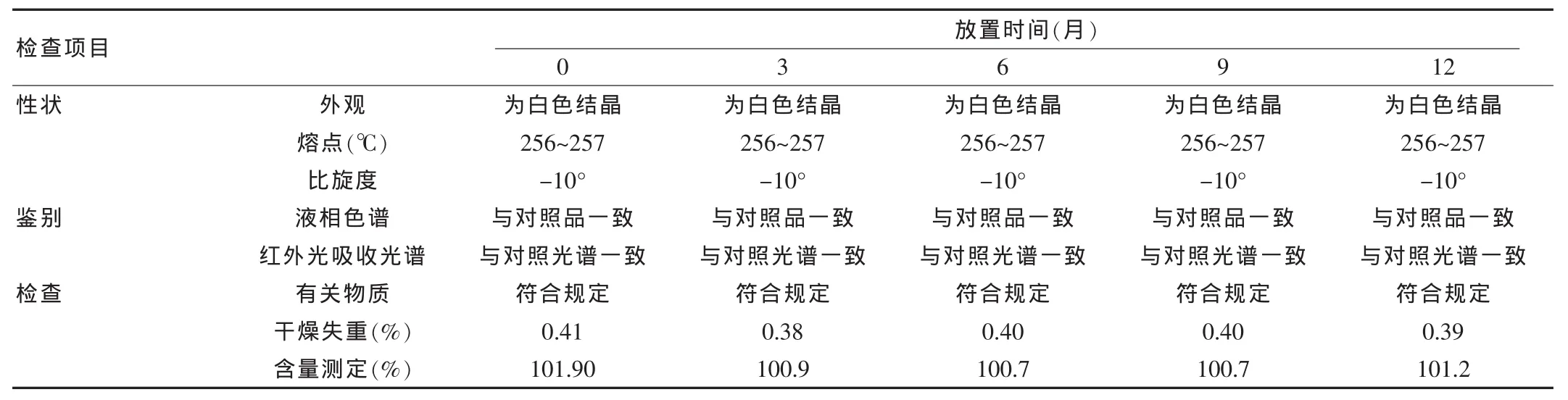
表5 20140701批阿昔洛韦长期稳定性结果
观察规格变更后三批产品的稳定性试验结果进行分析,在温度温度(40±2)℃,RH70%~80%环境条件下进行加速稳定性考察6个月和温度(25±2)℃,RH50%~70%环境条件下进行长期稳定性考察12个月,各项质量指标均未见明显变化。
3 讨论
该次变更仅包装用管制抗生素瓶体积的变化和每个抗生素瓶中原料药装量的增加,直接接触药材的包装材料、包装材料的前处理、装样方法等均未发生变化。为了保证药品安全,按照《中国药典》2010年版二部中阿昔洛韦的质量标准对变更后的产品进行检查,结果表明所有供试品均符合标准,证明包装材料体积和装药量的变化对阿昔洛韦的质量不产生影响。
[1]国家药典委员会.中华人民共和国药典(2015年版二部)[M].北京:中国医药科技出版社,2015.
[2]杨永芳.阿昔洛韦搽剂的制备及质量控制[J].海峡药学,2013,25(12):45.
[3]黄胜炎.国外新批准上市的药物新制剂新剂型(187)[J].中国制药信息,2013(8):13-16.
[4]国家食品药品监督管理局.药品生产质量管理规范(2010年修订版)[M].北京:中国医药科技出版社,2011.
[5]陈淑花,张晶,于池,等.阿昔洛韦脂质体超临界流体逆向蒸发制备研究[J].材料导报,2014(28):260-262.
[6]杨光.药品包装用复合膜材料中的溶剂残留和检验规定[J].中国包装,2015(6):61-63.
[7]罗文卿,柴妙琳,候佳朋,等.乳化-溶媒萃取法制备阿昔洛韦生物黏附缓释微球及其工艺影响因素[J].中国医药工业杂志,2013,44(3):242-248.
[8]王书玉,王磊,窦佳,等.乳离心分配色谱法测定阿昔洛韦乳膏中主成分的含量[J].中国药房,2015,26(18):2567-2568.

