CT肺栓塞指数联合右心功能参数对急性肺栓塞严重程度评价临床研究
周磊 陈成水
肺栓塞是由于内源性或外源性栓子堵塞肺动脉引起的一系列肺循环功能障碍的临床及病理生理综合征。在西方国家,急性肺栓塞(APE)发病率仅次于肿瘤和冠状动脉粥样硬化性心脏病(冠心病)。有资料表明,我国该病的发病率仅次于冠心病及高血压病,其中,未治疗的APE患者短期病死率高达20%~30%,确诊后经积极抢救治疗患者病死率可下降至2% ~8%[1]。有专家指出,右心功能不全是APE患者死亡的独立高危因素[2]。因而,确诊APE后,早期评价右心功能及危险分层,尽早开展抗凝、溶栓等治疗,可改善预后,降低APE患者的病死率。本研究针对我院CT肺动脉成像(CTPA)确诊APE患者,依据CT肺栓塞指数(PAOI)联合右心功能参数评价肺栓塞严重程度,现报告如下。
对象与方法
一、研究对象
选取浙江省舟山医院2011年1月至2014年1月收治的APE患者43例(科室包括呼吸科、急诊科、ICU、骨科、泌尿外科、普外科),均符合2008年中华医学会呼吸分会制定的《肺血栓栓塞症的诊断与治疗》的诊断标准,急诊或入院后48 h内完成64层CTPA检查,直接征象为肺动脉内的充盈缺损,作为确诊肺栓塞的依据。包括以下任一征象:完全性阻塞、中心性充盈缺损、偏心性充盈缺损、附壁血栓。其中,男26例,女17例;年龄36~81岁,平均年龄(58.2±14.5)岁。同期选取与肺栓塞组年龄、性别等基本情况无明显差异的怀疑肺栓塞,但CTPA阴性的患者25例作为对照组,其中,男15例,女10例,年龄44~77岁,平均年龄(61.5±5.4)岁。并排除具有以下任一情况的患者:ASC、急性脑血管意外、既往有严重的基础心肺疾病(包括风湿性心脏病、心肌梗死、先天性心脏病、心肌病及其他可能引起肺动脉高压的心肺疾病)、肾功能不全、慢性肺栓塞肺动脉高压、中重度的COPD、孕妇。
二、方 法
1.CTPA和PAOI检查
CTPA使用德国西门子公司的64层螺旋CT,造影剂为碘帕醇,剂量60~100 ml,速度为4 ml/s,0.5 mm层厚。PAOI使用Qanadli评分,根据肺动脉内栓塞的位置和程度,系统评分肺动脉的栓塞情况。每侧肺动脉分10段,1支肺段动脉或孤立出现的亚段动脉栓子记1分,出现在肺段动脉以上的栓子,则记总分,每例肺栓塞患者肺动脉栓子的阻塞位置的最大评分不超过20分。另评价栓子远端的肺组织所残存的灌注情况,不完全阻塞为1分,完全阻塞为2分,未阻塞为0分。Qanadli CT阻塞指数计算的表达公式: [2(n×d)/40]×100%(n为肺动脉栓子阻塞位置的评分,d为阻塞程度的评分)。计算入选 APE患者 PAOI,按PAOI﹤ 30%、30%≤PAOI﹤ 50%和 PAOI≥50%[3],将APE患者分为轻、中和重度3组,其中轻度组30例,中度组9例,重度组4例,3组的PAOI中位数分别为13.4%,34.5%,62.2%。
2.右心功能参数
依据《2011年AHA大面积肺栓塞与次大面积肺栓塞、髂股静脉血栓及慢性血栓栓塞性肺动脉高压的治疗指南》,肺栓塞患者合并右心功能障碍可表现具有以下征象:右心扩大(心脏四腔心切面),右心室短轴最大直径/左心室短轴最大直径(RVd/LVd) >0.9;脑钠肽升高(>90 pg/ml);肌钙蛋白 I(cTnI) > 0.4 g/ml等[4]。故选取RVd/LVd、脑钠肽及cTnI作为评价右心功能参数。取CTPA四腔心层面,RVd:室间隔和右心室游离壁内面之间的最大距离。LVd:室间隔和左心室游离壁内面之间的最大距离。RVd/LVd:根据RVd和LVd,计算比值。血液指标为急诊或入院后24 h内检查结果,若24 h内该项目大于1次,则入选异常程度最高者,但必须是在抗凝或溶栓前的检查结果。脑钠肽使用雅培公司的i2000全自动免疫化学发光分析仪及原厂试剂盒检测。脑钠肽参考范围0~100 pg/ml,cTnI使用 Beckman公司的 DXI800型化学发光分析仪及原厂试剂盒检测。cTnI≥0.01 ng/ml为阳性。血气分析为急诊或入院后不吸氧下第一次采血结果,使用丹麦雷度公司血气分析仪型号Abl 800及原厂试剂。
三、统计学处理
采用SPSS 17.0统计软件对实验数据进行分析,计量资料以±s表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t法,P﹤0.05为差异有统计学意义。
结 果
一、APE组与对照组右心功能参数比较
与对照组比较,随着 PAOI分组级别升高,RVd、RVd/LVd明显升高,而LVd则随着PAOI分组级别升高而呈显著下降,且APE患者各组间的RVd、LVd、RVd/LVd比较差异均具有统计学意义(P﹤0.05),见表1。
表1 APE组与对照组右心功能参数比较±s)

表1 APE组与对照组右心功能参数比较±s)
注:与对照组比较,aP﹤0.05;与轻度组比较,bP﹤0.05;与中度组比较,cP﹤0.05
组 别 RVd(mm)LVd(mm)RVd/LVd对照组(n=25)29.8±3.54 48.4±1.10 0.74±0.12轻度组(n=30)36.5±5.30a 44.09±1.02a 0.95±0.19a中度组(n=9)46.38±3.46ab 39.43±0.74ab 1.21±0.22ab重度组(n=4)51.40±3.92abc 35.12±0.91abc 1.45±0.38abc F值48.929 312.691 26.017
二、APE组与对照组脑钠肽、cTnI、PaO2比较
与对照组比较,随着PAOI分组级别升高,脑钠肽、cTnI明显升高,而PaO2则随着PAOI分组级别升高而显著下降,且APE患者各组间的脑钠肽、cTnI、PaO2值比较差异均有统计学意义(P﹤0.05),见表2。
表2 APE组与对照组脑钠肽、cTnI、PaO2比较 ±s)
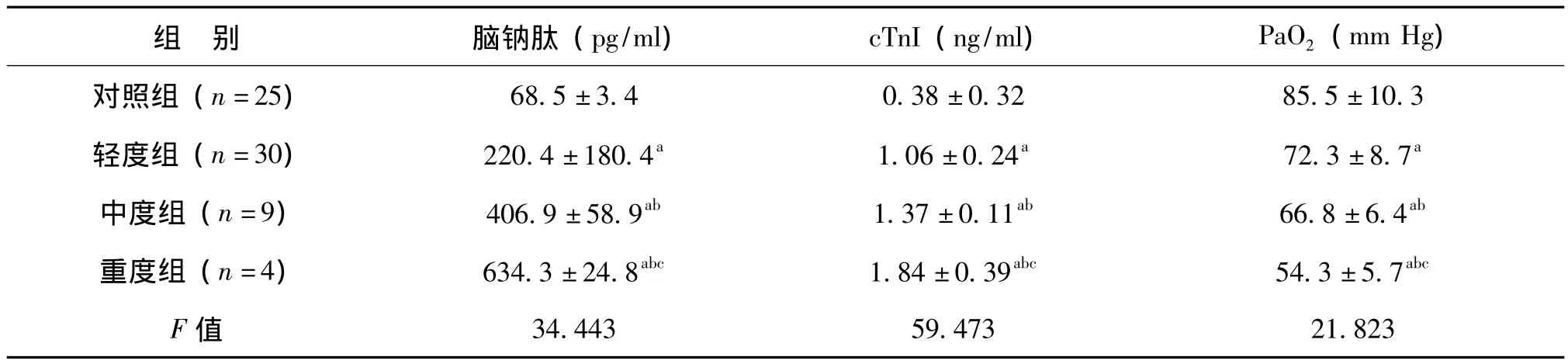
表2 APE组与对照组脑钠肽、cTnI、PaO2比较 ±s)
注:与对照组比较,aP﹤0.05;与轻度组比较,bP﹤0.05;与中度组比较,cP﹤0.05
组 别 脑钠肽(pg/ml)cTnI(ng/ml)PaO2(mm Hg)对照组(n=25)68.5±3.4 0.38±0.32 85.5±10.3轻度组(n=30)220.4±180.4a 1.06±0.24a 72.3±8.7a中度组(n=9)406.9±58.9ab 1.37±0.11ab 66.8±6.4ab重度组(n=4)634.3±24.8abc 1.84±0.39abc 54.3±5.7abc F值34.443 59.473 21.823
讨 论
APE是临床上常见的疾病,其发病突然,误诊率高。临床症状差异大,可表现为晕厥、胸痛、呼吸困难,甚至猝死,但也有部分患者症状轻微。肺栓塞症状轻重主要取决于肺动脉内栓子的大小、数量、栓塞形成及溶解速度、基础心肺疾病、个体差异等因素。有研究表明,肺栓塞引起肺血管床面积减少25%~30%,肺动脉平均压(PAP)轻度升高;肺血管床面积减少40% ~50%,PAP可达40 mm Hg(1 mm Hg=0.133 kPa),右心室压升高,心脏功能减退;减少至50% ~70%,出现持续性肺动脉高压;当肺血管床面积减少>85%时,可出现猝死。因此,可通过CTPA计算APE患者PAOI,定量评价栓塞程度,PAOI数值越高,则APE患者肺动脉栓塞越严重,预后越差[5]。
CTPA作为一种非侵入性检测方法,具有无创、成像速度较快,检测结果可保存、不良反应相对少等优点。有研究报告,CTPA对肺栓塞诊断的敏感度可达53% ~100%,特异度达80%以上[6]。很大程度上已经取代了有创性的肺动脉造影及放射性核素肺通气/肺血流灌注扫描,成为临床上认可的肺栓塞诊断手段[7]。CTPA不仅可直观显示栓塞程度、范围、部位,而且通过计算机成像可显现栓子的形态,提高对肺栓塞的诊断价值,精确临床诊断,减少误诊、漏诊。近些年,国内外专家深入研究发现CTPA可更为精确、客观的评估APE患者的右心功能及严重程度,具有独特的优势[8]。基于血流动力学是否稳定来分级APE危险度,操作简单,但存在着对于大部分血流动力学稳定的次大面积栓塞不能进一步细化分层,且部分患者一过性的血流动力学不稳定,难以分类、评价等缺陷。而PAOI可以对APE的栓塞程度量化,具有客观性、可探讨性及可比性。同时结合心血管结构的测量,进行右心功能评价,早期评估疾病的严重程度,指导临床及时、合理地治疗及评估预后有着重大作用。
APE栓子阻塞肺动脉主干及其分支达一定程度后,机械阻塞、神经、体液及低氧因素共同作用引起肺动脉收缩,导致肺循环阻力增加,肺动脉压升高,右心室后负荷增高,右心室壁张力增高,直接导致右心功能降低。有报告称严重的APE患者,右心压力可至50~60 mm Hg,右心室急剧扩张致室间隔左移,心肌耗氧量增加,右冠状动脉灌注明显下降,出现右心室心肌急性缺氧缺血损害可致右心功能失代偿改变[9]。影像学上可表现为右心室结构、甚至位置改变,出现右心室容积增大,RVd/LVd>0.9。且随着梗塞的血管增多,肺动脉压升高,RVd/LVd比值增大,出现右心功能进一步的退化、衰竭。流行病学调查发现,血流动力学稳定的APE患者早期病死率低,当患者合并有右心室功能不全、休克时,其病死率可上升至50%以上[10]。因此,是否存在右心功能障碍是对 APE患者的严重程度及预后评估的一个重要因素。
联合检测心肌损伤及氧合指标,即同时检验cTnI、脑钠肽、PaO2更能准确分层APE严重程度。肺栓塞后进行性的右心室功能衰竭和心肌受损,可致心肌损伤标志物升高。脑钠肽是一种32个氨基酸的多肽,为心室肌特有,以脉冲形式分泌入血,当心室壁张力增大时,脑钠肽生成、分泌增多,通过利尿、排钠减低心脏负担,通常用于判断心力衰竭的严重程度及预后。肺栓塞后出现肺动脉压力增高,右心室扩大,心室壁细胞合成分泌脑钠肽升高。近年来研究发现,APE患者发生右心功能不全时,血浆中脑钠肽水平升高,且增高程度与心功能衰竭相关。一项Meta分析显示,脑钠肽升高患者的休克、低氧血症等不良临床事件及死亡的发生率明显升高[11]。脑钠肽与APE患者的不良预后密切关联,可作为评估肺栓塞严重程度的一项指标。
cTnI是一反映心肌细胞损伤指标,在临床上具有较高的敏感度及特异度。APE后cTnI增高原因可能是肺栓塞后出现右心室的急剧扩张,继发冠状动脉压迫、痉挛,心肌缺血坏死或部分患者合并心源性的休克,冠状动脉低灌注相关,且升高程度与心肌损伤呈正相关。近年研究发现cTnI测定可定量评价右心室受损程度。合并右心功能不全、血肌钙蛋白升高的APE患者,短期内死亡风险显著升高[12]。其中对于血流动力学稳定的APE患者,cTnI水平增高者死亡风险显著增高(OR=5.90,95%CI 2.68 ~12.90)[13]。肌钙蛋白被认为是 APE患者早期死亡的独立预测指标,其水平影响肺栓塞患者的危险分层,与肺栓塞的严重程度相关。
动脉血气分析PaO2是评价肺栓塞患者氧合的重要指标。部分肺栓塞患者以呼吸困难,难以纠正的低氧血症为首发症状,对于栓塞引起的低氧血症主要与以下机制相关:①肺栓塞引起肺血流减少,通气血流比例失调,肺泡无效气腔量增大,肺内血流重新分布;②栓塞引起的神经体液因素引起支气管痉挛,肺通气减少;③栓塞部位肺泡表面活性物质分泌减少,毛细血管通透性增高,间质和肺泡内液体增多,肺换气功能下降;④肺动脉高压传递至右房压升高、部分患者出现卵圆孔开放,产生心内右向左分流。低氧的严重程度取决于肺动脉栓塞程度、速度以及基础心肺功能等因素。也有研究表明低氧血症与肺栓塞患者的全因死亡率相关,对评价肺栓塞严重程度具有独立的预测价值[14]。
此外,本研究尚有不足之处,病例样本量不足,重度组、中度组与轻度组例数悬殊,存在着部分大面积肺栓塞患者以猝死为临床表现,或因病情危重、血流动力学不稳定,无法完善相关检查,未列入研究样本等客观因素,但肺栓塞患者3组间数据比较的统计分析结果与Collomb等[15]及国内刘芬[16]的研究相似。
本研究提示,APE患者随着PAOI分组级别升高,RVd、RVd/LVd呈升高趋势,且高危组较低危组明显升高,同时LVd随着PAOI分组级别升高下降,右心室容积增大,并有心肌损伤和氧合功能影响出现脑钠肽、cTnI升高、PaO2下降。APE越严重,PAIO级别越高,右心功能降低越明显。因此,CT栓塞指数联合右心功能参数对于评价APE患者严重程度、指导危险分层及治疗、改善预后具有临床意义。
[1]殷凯生.呼吸疾病诊断流程与治疗策略.北京:科学出版社,2008:232.
[2]Ocak G,van Stralen KJ,Rosendaal FR,et al.Mortality due to pulmonary embolism,myocardial infarction,and stroke among incident dialysis patients.J Thromb Haemost,2012,10:2484-2493.
[3]周新卫,王建国,刘冬,等.CT肺栓塞指数评价急性肺栓塞患者右心功能.中国医学影像技术,2011,27:69-73.
[4]Jaff MR,McMurtry MS,Archer SL,et al.Management of massive and submassive pulmonary embolism,iliofemoral deep vein thrombosis,and chronic thromboembolic pulmonary hypertension:a scientific statement from theAmerican HeartAssociation. Circulation,2011,123:1788-1830.
[5]温绍君,张维君,房芳.肺栓塞的病理生理.中华心血管病杂志,2001,29:259-260.
[6]Hogg K,Brown G,Dunning J,et al.Diagnosis of pulmonary embolism with CT pulmonary angiography:a systematic review.Emerg Med J,2006,23:172-178.
[7]Agnelli G,Becattini C.Acute pulmonary embolism.N Engl J Med,2010,363:266-274.
[8]Nural MS,Elmali M,Findik S,et al.Computed tomographic pulmonary angiography in the assessment of severity of acute pulmonary embolism and right ventricular dysfunction.Acta Radiol,2009,50:629-637.
[9]Wood KE.Major pulmonary embolism:review of a pathophysiologic approach to the golden hour of hemodynamically significant pulmonary.Chest,2002,121:877-905.
[10]Quinlan DJ,McQuillan A,Eikelboom JW.Low-molecular-weight heparin compared with intravenous unfractionated heparin for treatment of pulmonary embolism:a meta-analysis of randomized,controlled trials.Ann Intern Med,2004,140:175-183.
[11]Klok FA,Mos IC,Huisman MV.Brain-type natriuretic peptide levels in the prediction of adverse outcome in patients with pulmonary embolism:a systematic review and meta-analysis.Am J Respir Crit Care Med,2008,178:425-430.
[12]Walter T,Apfaltrer P,Weilbacher F,et al.Predictive value of high-sensitivity troponin I and D-dimer assays for adverse outcome in patients with acute pulmonary embolism.Exp Ther Med,2013,5:586-590.
[13]吴晓华,刘冬梅.肌钙蛋白I检测对急性肺栓塞患者的诊断和预后评价价值.心血管病学进展,2012,33:507-510.
[14]刘秀叶.肺栓塞严重程度评估方法.心血管病学进展,2013,34:780-784.
[15]Collomb D,Paramelle PJ,Calaque O,et al.Severity assessment of acute pulmonary embolism:evaluation using helical CT.Eur Radio,2003,13:1508-1514.
[16]刘芬.CT肺栓塞指数对急性肺栓塞患者右心功能评价.昆明:昆明医科大学,2013.

