从生物质到火炸药:含能材料的生物合成
咸 漠,曹玉锦
(中国科学院青岛生物能源与过程研究所生物基材料重点实验室,山东青岛266101)
引 言
含能材料是一类能独立进行化学反应并输出能量的化合物或混合物,它们在武器装备中完成毁伤、推进、抛射等军事目的,决定着武器装备的威力、安全性、可靠性和实用性等技术指标,是提升武器装备作战能力的关键。传统的含能材料制备技术通常是以石油及其衍生产品为原料采用化学法进行合成,在世界特别是我国石油资源短缺的情况下,原料供给及稳定性方面存在安全性问题;化学法制备含能材料过程中普遍使用酸、碱、贵金属、重金属催化剂,对环境污染严重;化学催化存在选择性差的问题,产生大量的副产品,是含能材料工业污染严重及终产品性能不佳的重要原因;化学合成过程反应往往比较剧烈,不易控制,过程安全性差;这些都制约着含能材料化学合成技术的应用。
绿色生物合成作为颠覆性技术,是含能材料制备领域技术变革的共性迫切需求。它使用葡萄糖、木糖等碳水化合物作为原料,是生物质可再生资源,地球上每年制造量巨大,对解决我国资源短缺的问题具有战略意义;生物催化剂产生自生命体,对环境污染低;生物催化过程选择性高,产生的副产物少,减少了分离成本,同时也减少了杂质带入含能材料终产品的可能性,对武器装备的可靠性提升有重要意义;生物反应过程条件温和,易于控制,多在常温常压下进行,对人和设备造成损失的可能性小。因此,生物合成是含能材料制备领域的重要研究方向。本文综述了近年来生物合成技术用于含能材料及其前驱体制备的研究进展,重点介绍了多元醇类和芳香族类含能材料前体的生物合成路线及目前的技术水平,初步探讨了生物硝化技术的现状,并对未来生物法制备含能材料的发展方向进行了展望。
1 多元醇类
多元醇的多硝酸酯是火炸药和推进剂的重要成分,它们在不同的领域具有不同的用途。这些硝酸酯的制备通常以相应的多元醇为底物,通过硝化完成。目前的生物法虽然不能直接合成这些多元醇硝酸酯,但是已经形成了较为成熟的生物法合成多元醇的技术。在常见的甘油三硝酸酯(硝化甘油,NG)和季戊四醇四硝酸酯(PETN)之外,采用生物法合成的可用作含能材料前驱体的多元醇包括乙二醇、1,2-丙二醇,1,2,4-丁三醇、赤藓醇、木糖醇、甘露醇等。
1.1 乙二醇
乙二醇二硝酸酯(EGDN)作为一种常用的胶质炸药,爆炸性能与NG 相似,可以部分或全部替代NG,其感度和黏度优于NG,同时凝固点较低,可在较为寒冷的地区使用,但挥发性更强,毒性更大[1]。为了提高EGDN 的化学安定性并降低其毒性,开展了多聚乙二醇硝酸酯如二乙二醇二硝酸酯(DEGDN)、三乙二醇二硝酸酯(TEGDN)已在混合硝酸酯发射药的应用研究。生物法合成乙二醇以自然界中广泛存在的木糖为原料,经氧化得到木糖酸,经脱水得到3-脱氧-D-甘油-戊酮糖酸,经裂解得到乙醇醛,再经还原最终得到乙二醇(图1)。在补料分批发酵的条件下,乙二醇的产量可以达到11.7g/L[2]。然而,考虑到化学技术生产乙二醇成熟的工艺以及相对低廉的成本,生物基乙二醇目前并不具备明显的竞争力。
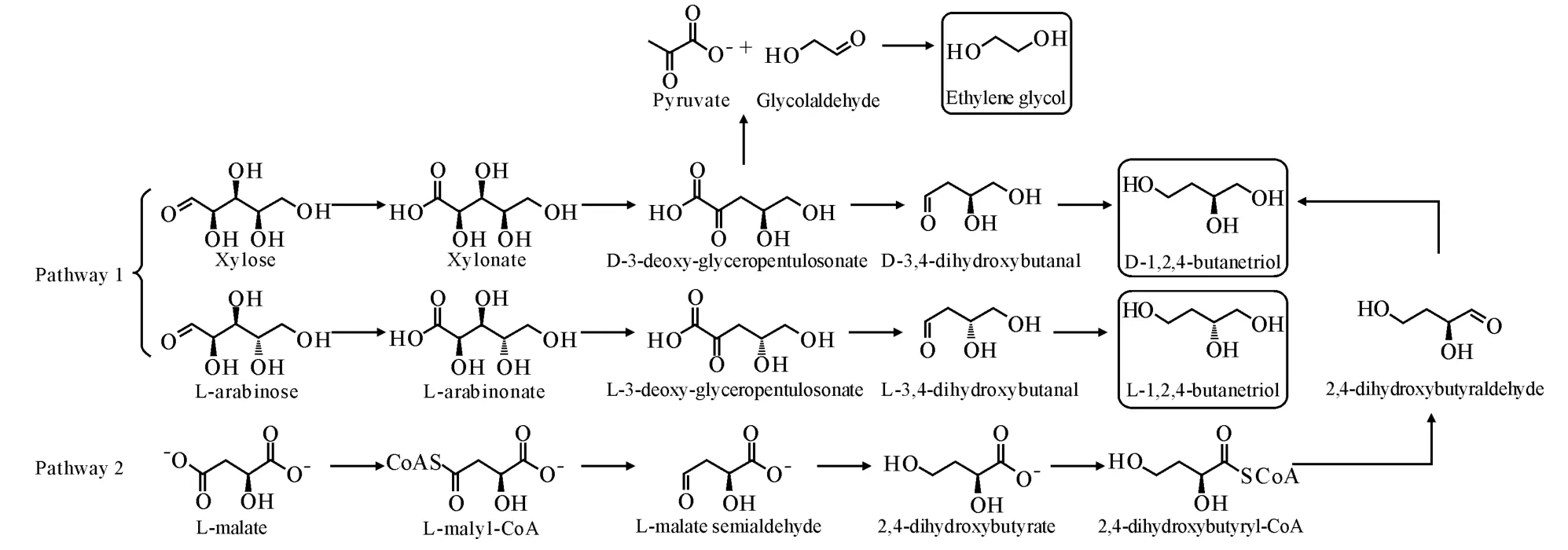
图1 乙二醇和1,2,4-丁三醇的生物合成途径Fig.1 Biosynthetic pathways of ethylene glycol and 1,2,4-butanetriol
1.2 1,2-丙二醇
1,2-丙二醇二硝酸酯(PGDN)是奥托燃料Ⅱ(Otto fuelⅡ)的主要成分(质量分数占76%),被用作美国海军Mk46和Mk48型鱼雷的推进剂[3-4],其前驱体1,2-丙二醇可通过生物法合成。自然界中存在广泛的微生物能够将糖类转化为1,2-丙二醇,它们多属于嗜热厌氧杆菌和梭状芽孢杆菌。此外,大肠杆菌、酿酒酵母、毕赤酵母等模式生物也通过基因工程改造用于合成1,2-丙二醇[5]。以糖类为原料合成1,2-丙二醇,首先通过糖酵解生成磷酸二羟丙酮,磷酸二羟丙酮进一步代谢得到关键中间代谢物丙酮醛,丙酮醛经两步还原得到丙酮醇或甲基乙二醛,然后被还原生成1,2-丙二醇(见图2)。葡萄糖作为底物,经基因工程大肠杆菌转化,1,2-丙二醇的最高发酵浓度可达4.5g/L,从葡萄糖到1,2-丙二醇的产率达0.19g/L[6]。甘油作为生产生物柴油的副产物,也是一种合成1,2-丙二醇的廉价底物。与以糖类为原料合成1,2-丙二醇的途径类似,甘油也首先转化成磷酸二羟丙酮,再进一步代谢得到1,2-丙二醇(图2)。以甘油为原料合成1,2-丙二醇的工程菌株,其产量可达5.6g/L,质量转化率为21.3%[7]。
1.3 1,2,4-丁三醇
丁三醇三硝酸酯(BTTN)是一种性能良好的含能增塑剂,与NG 相比,其凝固点、挥发性、热安定性和感度等指标均有一定优势,能够改善推进剂的低温力学性能[8],并提高使用安全性,已被用于高能硝酸酯增塑聚醚(NEPE)推进剂中[9-10]。尽管目前已具备多条1,2,4-丁三醇的化学合成路线,包括苹果酸二甲酯加氢法、3-丁烯-1-醇氧化水合法、2-丁烯-1,4-二醇酸催化法等[11],但这些生产工艺普遍存在污染严重、反应条件苛刻、产品分离困难、过程安全性差的问题。近年来,研究者正在开展1,2,4-丁三醇生物合成技术研究,目前已建立两条不同的合成路线(见图1)。路线一以木糖或阿拉伯糖作为起始原料,经生物转化首先得到木糖酸[12]或阿拉伯糖酸,这两种糖醛酸再进一步通过脱水、脱羧和还原三步生物催化反应最终得到1,2,4-丁三醇。最初的研究以木糖作为起始原料,1,2,4-丁三醇的产量达到1.6g/L,而以阿拉伯糖作为起始原料,1,2,4-丁三醇的产量可以达到2.4g/L[13]。进一步整合实现了一步法由木糖到1,2,4-丁三醇的直接转化,1,2,4-丁三醇的产量达到0.88g/L,摩尔转化率为12.82%[14]。将该代谢途径导入模式生物拟南芥中,实现了植物中1,2,4-丁三醇的合成,尽管1,2,4-丁三醇的产量仅达到20μg/g,但该研究代表了一个新的含能材料制备技术的研究方向[15]。路线二以苹果酸为起始原料,经活化得到苹果酰CoA,经两步还原得到2,4-二羟基丁酸,再活化生成2,4-二羟基丁酰CoA,最终再经两步还原生成1,2,4-丁三醇。该途径可进一步与葡萄糖到苹果酸的途径整合,1,2,4-丁三醇的最大理论得率可达0.65g/g葡萄糖,但目前的产量仅达到180ng/L[16]。考虑到葡萄糖相对于木糖和阿拉伯糖更为廉价易得,该途径同样具备很好的发展前景。

图2 1,2-丙二醇的生物合成途径Fig.2 Biosynthetic pathway of 1,2-propanediol
1.4 赤藓醇
赤藓醇四硝酸酯(ETN)是一种典型的固态结晶炸药,其性质与PETN 接近,但摩擦感度和撞击感度较低。ETN 合成技术简单,添加到其他含能材料中可以显著改善混合炸药的性能。随着生物技术的发展,ETN 的前驱体赤藓醇已经较易获得,因此,ETN 重新引起了人们的重视[17]。赤藓醇的生物合成途径主要有两条(见图3):在酵母等真核生物中,通过磷酸戊糖首先合成赤藓糖4-磷酸,再进一步被还原成赤藓醇;在原核生物中,直接裂解糖酵解的中间产物果糖6-磷酸得到赤藓糖4-磷酸,再进一步转化成赤藓醇[18]。

图3 赤藓醇的生物合成途径Fig.3 Biosynthetic pathway of erythritol
目前,赤藓醇的生物合成已经形成了成熟的工业化生产体系,多种酵母和真菌菌株被用于赤藓醇的合成。以葡萄糖为原料,采用酵母菌Pseudozyma tsukubaensis发酵生产赤藓醇,其产量高达245g/L,生 产 强 度 达 到2.86g·L-1·h-1,产 率 达 到61%[19]。以类丝孢酵母作为工程菌株生产赤藓醇,产量达到200g/L 以上[20]。相信随着生物基赤藓醇成本的逐步降低,ETN 将更有希望应用于武器装备系统中。
1.5 木糖醇
木糖醇五硝酸酯(XPN)是一种黏度高、稳定性好的含能材料,其最大优势是生产过程产生的有毒产物少,对操作工人健康影响较小。XPN 的前驱体木糖醇是一种广泛使用的食品添加剂,可通过水解玉米芯、棉籽壳、甘蔗渣等制备木糖,再经化学催化加氢获得。利用微生物转化半纤维素中的木糖制备木糖醇也已经具备比较成熟的技术,其中,重组谷氨酸棒杆菌和热带假丝酵母合成木糖醇的最高产量 分 别 达 到 了166g/L 和275g/L[21-22],国 外Thomson Biotech、zuChem 等公司已开始相关产业化生产的工作[23]。由于木糖醇在食品添加剂中应用广泛,用于制备含能材料并不是其主要用途。
1.6 甘露醇
甘露醇六硝酸酯(MHN)是一种安全性能较好的炸药,在常温下为固体粉末,比NG 更稳定,常被用于雷管中[24]。MHN 可以通过硝化甘露醇制得,而甘露醇又可以通过果糖化学加氢制备,但是其产物通常为山梨醇和甘露醇的混合物,给产物分离造成困难。目前,研究者已发现多种细菌、酵母和真菌可以发酵果糖或果糖与葡萄糖的混合物合成甘露醇。如中间型乳杆菌可以转化果糖生产甘露醇、乳酸和乙酸,在补料分批发酵的条件下,以300g/L的果糖作为底物,甘露醇的产量可以达到202.5g/L[25]。木兰假丝酵母也是一株能够高效合成甘露醇的菌株,其生产甘露醇的最高浓度达到209g/L,对应的产率达到83%,生产强度达到1.03g·L-1·h-1[26]。随着生物法制备甘露醇技术的日趋成熟,将会有力推进其在含能材料中的应用。
2 芳香族类
芳香族化合物苯环上的氢原子被硝基取代后生成的衍生物通常是性能优异的含能材料,它们安定性好,感度较低,能量适中,广泛用于军事及民用爆破工程。同时,这类化合物原料来源广泛,制造方便,成本低廉,是目前用量最大、用途最广的一类单质炸药。常见的芳香族炸药包括2,4,6-三硝基甲苯(TNT)、2,4,6-三硝基苯酚(苦味酸)、2,4,6-三硝苯基-甲基-硝基胺(特屈儿)等。目前,生物法合成芳香族含能材料前驱体的研究主要集中于苯酚、间苯三酚和苔黑酚上。
2.1 苯酚
苯酚是合成多种芳香族含能材料的重要前驱体,但它对微生物生长具有较强的抑制作用,因此,必须选择相应的抗性菌株用于生物合成。通过在具有良好溶剂耐受性的恶臭假单胞菌中表达来自海洋细菌成团泛菌的酪氨酸苯酚裂解酶,首次实现了生物基苯酚的合成,在补料分批发酵水平下,产量为0.47g/L,从葡萄糖到苯酚的产率为2.8%[27]。以正辛醇作萃取剂对恶臭假单胞菌进行原位萃取发酵,显著降低了水相中苯酚的浓度,苯酚的总产量提高了132%[28-29]。此外,大肠杆菌也通过sRNA 技术改造后用来合成苯酚,在以甘油三丁酯作为萃取剂的两相发酵体系中,苯酚的最高产量达到3.79g/L[30]。然而,目前生物基苯酚的合成效率尚不足以与传统的工艺竞争。
2.2 间苯三酚
间苯三酚是合成钝感单质炸药三氨基三硝基苯(TATB)的前驱体,TATB 是目前发现的感度最低的含能材料[31]。生物法合成间苯三酚的报道最早见于2004年,Zha等[32]通过对I型脂肪酸合成酶的理性改造,实现了以葡萄糖为原料合成三乙酸内酯,而三乙酸内酯可进一步通过化学催化制得间苯三酚。进一步的研究直接以葡萄糖为原料合成了间苯三酚(见图4),该技术在大肠杆菌中表达了来自荧光假单胞菌的聚酮合酶基因phlD,所构建的工程菌株间苯三酚的产量达到了780mg/L[33]。在此基础上,研究者采用不同的技术对间苯三酚生物合成体系进行了改进:通过对聚酮合酶PhlD 的底物特异性研究以及定向进化改造,大幅度提高其催化性能和发酵液中间苯三酚的浓度[34-35];通过对间苯三酚合成途径的理性设计并增强宿主菌对间苯三酚的耐受性,进一步提高了间苯三酚的产量和产率[36-37];通过对聚酮合酶表达系统中的启动子、质粒拷贝数、宿主体系的选择,有效降低了生物基间苯三酚的生产成本[38]。间苯三酚生物合成技术是目前研究最为系统的生物基含能材料前驱体制备技术,考虑到间苯三酚化学合成工艺所存在的成本过高、原料来源不稳定、反应步骤多、污染严重的缺陷,生物基间苯三酚取代石化基间苯三酚已经显示了良好的前景。
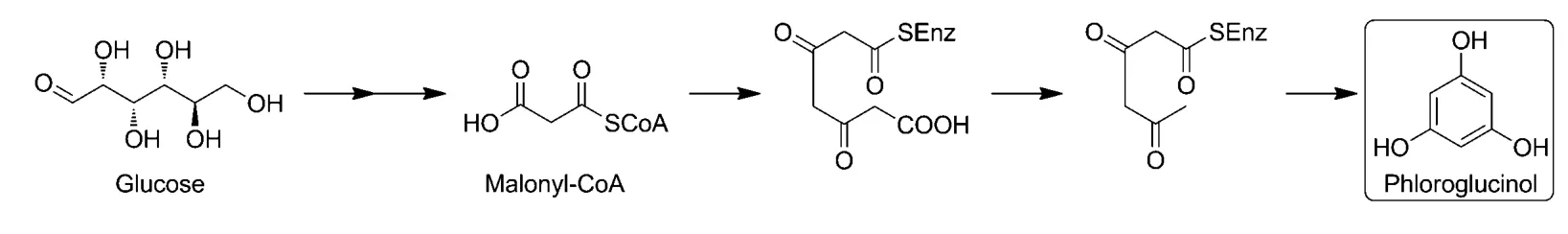
图4 间苯三酚的生物合成途径Fig.4 Biosynthetic pathway of phloroglucinol
2.3 苔黑酚
TNT 的二氨化产物3,5-二氨基-2,4,6-三硝基甲苯(DATNT)是一种性能更加优异的高能钝感炸药,其密度比TNT 高,理论爆速比TNT 高约800m/s。苔黑酚(3,5-二羟基甲苯)是合成DATNT 的前驱体,以苔黑酚为原料,经硝化、烷基化和氨解三步反应可以得到高纯度的DATNT[39]。苔黑酚作为一种细胞代谢产物,其生物合成途径首先在禾谷镰刀菌中得到鉴定,该途径通过聚酮合酶首先合成苔色酸(4,6-二羟-2-甲苯甲酸),苔色酸进一步脱羧得到苔黑酚[40]。此外,在多种植物中也先后监测到苔黑酚作为细胞中间代谢产物,包括苔藓植物[41]、杜鹃花科植物[42]、蔷薇科植物[43]等,但苔黑酚在这些植物中无法积累。目前对于苔黑酚生物合成的研究还处于代谢途径与关键酶的鉴定阶段,尚未有其生物合成的产量报道。
3 生物硝化技术
目前生物技术所能合成的产物主要是各种含能材料的前驱体,需要进一步通过化学催化衍生得到最终产品,尚未有直接通过生物转化制备高能化合物的报道,这是由于含能材料通常含有硝基、叠氮、偶氮等基团,生物催化很难在相应的化合物中引入上述基团。然而,利用微生物降解NG[44]、TNT[45]等含能材料的研究已有报道,其生物降解途径通常是首先脱掉硝基生成相应的多元醇或芳香族化合物,再进一步被细胞代谢掉。对这些含能材料降解过程的分析,解析其生物降解的酶催化机理,将有助于筛选到能够催化合成相应硝酸酯的微生物菌株。此外,文献报道了利用酶催化直接对芳香族化合物进行硝化。例如,微过氧化物酶可以以硝酸根作为硝基供体对苯酚进行硝化,产物中可检测到2-硝基苯酚和4-硝基苯酚[46];大豆过氧化物酶、辣根过氧化酶等在双氧水和亚硝酸钠存在的条件下可以催化4-羟基-3-甲基苯乙酮的硝化生成4-羟基-3-甲基-5-硝基-苯乙酮[47];过氧化氢酶也可以催化亚硝酸介导的4-羟基苯乙酸的硝化[48]。但是,目前生物硝化的效率均比较低,且只能实现底物的单硝化,离实际应用尚有较大差距。
4 展 望
含能材料生物合成技术是近十年来国际上研究的热点,美国等发达国家高度重视含能材料生物合成技术的发展,早在2006年,美国就部署了“工程微生物利用可再生原料制备含能材料”的项目。随着1,2,4-丁三醇、间苯三酚等优异含能材料前驱体生物合成技术的建立,生物技术正逐渐展示出其在含能材料制备领域的优势。未来,生物基含能材料的发展方向集中在高能量密度富氮含能材料(如四嗪类、四唑类、呋咱类等)的合成。与传统的含能材料相比,富氮含能材料具有高的热稳定性和正生成焓,在多种领域具有潜在的应用前景[49]。尽管目前的生物体系尚无法直接合成这些高氮杂环,但嘧啶、吡啶、咪唑类化合物的生物成环机制已经得到了解析,从而为这些富氮含能材料的合成提供了可以借鉴的方案。以四嗪类含能材料3,3′-偶氮双(6-氨基-1,2,4,5-四嗪)(DAAT)为例,生物法不能直接合成DAAT,但国际上已有生物合成DAAT 前驱体的报道,这些技术与原有的化学合成路线相结合,可以使整个工艺路线更环保,同时也为DAAT完整生物合成路线的建立奠定了基础。
含能材料的生物合成是一个全新的技术领域,相关基础研究尚处于起步阶段,但近年来发展迅猛。因此,开展以可再生生物质资源为原料、利用先进生物合成技术制备系列含能材料新工艺的研究,将有助于填补我国在该领域的空白,相信在未来几年内,将会设计出更多品种含能材料的生物合成路线并逐渐取代传统的含能材料化学制备工艺。
[1] Sáiz J,Bravo J C,Ávila E V,et al.Determination of ethylene glycol dinitrate in dynamites using HPLC:Application to the plastic explosive Goma-2ECO[J].Journal of Separation Science,2011,34 (23):3353-3358.
[2] Liu H,Ramos K,Valdehuesa K,et al.Biosynthesis of ethylene glycol in Escherichia coli[J].Applied Microbiology and Biotechnology, 2013, 97 (8):3409-3417.
[3] Cooper J R,Lee L H,Macys D A.Developmental toxicity of OTTO fuel II in the rat and rabbit[J].Journal of Applied Toxicology,1993,13 (4):235-239.
[4] 石飞,王庆法,张香文,等.1,2-丙二醇二硝酸酯的绿色合成[J].火炸药学报,2007,30(2):75-77.SHI Fei,WANG Qing-fa,ZHANG Xiang-wen,et al.The green synthesis of 1,2-propylene glycol dinitrate[J].Chinese Journal of Explosives and Propellants,2007,30(2):75-77.
[5] Bennett G N,San K Y.Microbial formation,biotechnological production and applications of 1,2-propanediol[J].Applied Microbiology and Biotechnology,2001,55(1):1-9.
[6] Altaras N E,Cameron D C.Enhanced production of(R)-1,2-propanediol by metabolically engineered Escherichia coli[J].Biotechnology Progress,2000,16(6):940-946.
[7] Clomburg J M,Gonzalez R.Metabolic engineering of Escherichia coli for the production of 1,2-propanediol from glycerol[J].Biotechnology and Bioengineering,2011,108(4):867-879.
[8] 赖建伟,常新龙,王朝霞,等.固体推进剂低温力学性能的研究进展[J].火炸药学报,2013,36(2):1-8.LAI Jian-wei,CHANG Xin-long,WANG Zhao-xia,et al.Progress of study on low temperature mechanical properties of solid propellant[J].Chinese Journal of Explosives and Propellants,2013,36(2):1-8.
[9] Huang Z,Nie H,Zhang Y,et al.Migration kinetics and mechanisms of plasticizers,stabilizers at interfaces of NEPE propellant/HTPB liner/EDPM insulation[J].Journal of Hazardous Materials,2012,229-230:251-257.
[10]朱一举,常海,丁黎.湿热环境对RDX/AP-NEPE 推进剂热安全性及力学性能的影响[J].火炸药学报,2014,37(6):65-69.ZHU Yi-ju,CHANG Hai,DING Li.Effect of humid and hot environment on thermal safety and mechanical properties of RDX/AP-NEPE propellant[J].Chinese Journal of Explosives and Propellants,2014,37(6):65-69.
[11]李赤峰,徐保国.1,2,4-丁三醇合成工艺述评[J].湖南化工,2000,30(3):9-11.LI Chi-feng,XU Bao-guo.A review on the synthesis of 1,2,4-butantriol[J].Hunan Chemical Industry,2000,30(3):9-11.
[12]Cao Y J,Xian M,Zou H B,et al.Metabolic engineering of Escherichia coli for the production of xylonate[J].Plos One,2013,8(7):e67305.
[13]Niu W,Molefe M N,Frost J W.Microbial synthesis of the energetic material precursor 1,2,4-butanetriol[J].Journal of the American Chemical Society,2003,125(43):12998-12999.
[14]Valdehuesa K N G,Liu H,Ramos K R M,et al.Direct bioconversion of D-xylose to 1,2,4-butanetriol in an engineered Escherichia coli[J].Process Biochemistry,2014,49(1):25-32.
[15]Abdel-Ghany S E,Day I,Heuberger A L,et al.Metabolic engineering of Arabidopsis for butanetriol production using bacterial genes[J].Metabolic Engineering,2013,20:109-120.
[16]Li X,Cai Z,Li Y,et al.Design and construction of a non-natural malate to 1,2,4-butanetriol pathway creates possibility to produce 1,2,4-butanetriol from glucose[J].Scientific Reports,2014,4:5541.
[17]Künzel M,Yan Q L,ŠelešovskýJ,et al.Thermal behavior and decomposition kinetics of ETN and its mixtures with PETN and RDX [J].Journal of Thermal Analysis and Calorimetry,2014,115(1):289-299.
[18]Moon H J,Jeya M,Kim I W,et al.Biotechnological production of erythritol and its applications[J].Applied Microbiology and Biotechnology,2010,86(4):1017-1025.
[19]Jeya M,Lee K M,Tiwari M,et al.Isolation of a novel high erythritol-producing Pseudozyma tsukubaensis and scale-up of erythritol fermentation to industrial level[J].Applied Microbiology and Biotechnology,2009,83(2):225-231.
[20]Sawada K,Taki A,Yamakawa T,et al.Key role for transketolase activity in erythritol production by Trichosporonoides megachiliensis SN-G42[J].Journal of Bioscience and Bioengineering,2009, 108 (5):385-390.
[21]Sasaki M,Jojima T,Inui M,et al.Xylitol production by recombinant Corynebacterium glutamicum under oxygen deprivation[J].Applied Microbiology and Biotechnology,2010,86(4):1057-1066.
[22]Lee J K,Koo B S,Kim S Y.Cloning and characterization of the xyl1gene,encoding an NADH-preferring xylose reductase from Candida parapsilosis,and its functional expression in Candida tropicalis[J].Applied and Environmental Microbiology,2003,69(10):6179-6188.
[23]Su B,Wu M,Lin J,et al.Metabolic engineering strategies for improving xylitol production from hemicellulosic sugars[J].Biotechnology Letters,2013,35(11):1781-1789.
[24]Yan Q L,Künzel M,Zeman S,et al.The effect of molecular structure on thermal stability,decomposition kinetics and reaction models of nitric esters[J].Thermochimica Acta,2013,566:137-148.
[25]Saha B C,Nakamura L K.Production of mannitol and lactic acid by fermentation with Lactobacillus intermedius NRRL B-3693 [J].Biotechnology and Bioengineering,2003,82(7):864-871.
[26]Song K H,Lee J K,Song J Y,et al.Production of mannitol by a novel strain of Candida magnoliae[J].Biotechnology Letters,2002,24(1):9-12.
[27]Wierckx N J P,Ballerstedt H,de Bont J A M,et al.Engineering of solvent-tolerant Pseudomonas putida S12for bioproduction of phenol from glucose[J].Applied and Environmental Microbiology,2005,71(12):8221-8227.
[28]Heerema L,Wierckx N,Roelands M,et al.In situ phenol removal from fed-batch fermentations of solvent tolerant Pseudomonas putida S12by pertraction[J].Biochemical Engineering Journal,2011,53(3):245-252.
[29]Heerema L,Roelands M,Hanemaaijer J H,et al.Insitu phenol removal from fermentation broth by pertraction[J].Desalination,2006,200(3):485-487.
[30]Kim B,Park H,Na D,et al.Metabolic engineering of Escherichia coli for the production of phenol from glucose [J].Biotechnology Journal,2014,9(5):621-629.
[31]付小龙,樊学忠.钝感推进剂配方研究及发展趋势[J].火炸药学报,2014,37(5):1-8.FU Xiao-long,FAN Xue-zhong.Research and development trends of insensitive solid propellant formalation[J].Chinese Journal of Explosives and Propellants,2014,37(5):1-8.
[32]Zha W,Shao Z,Frost J W,et al.Rational pathway engineering of type I fatty acid synthase allows the biosynthesis of triacetic acid lactone from D-glucose in vivo[J].Journal of the American Chemical Society,2004,126(14):4534-4535.
[33]Achkar J,Xian M,Zhao H,et al.Biosynthesis of phloroglucinol[J].Journal of the American Chemical Society,2005,127(15):5332-5333.
[34]Zha W J,Rubin-Pitel S B,Zhao H M.Exploiting genetic diversity by directed evolution:molecular breeding of type III polyketide synthases improves productivity [J]. Molecular Biosystems,2008,4(3):246-248.
[35]Rao G D,Lee J K,Zhao H M.Directed evolution of phloroglucinol synthase PhlD with increased stability for phloroglucinol production[J].Applied Microbiology and Biotechnology,2013,97(13):5861-5867.
[36]Zha W J,Rubin-Pitel S B,Shao Z Y,et al.Improving cellular malonyl-CoA level in Escherichia coli via metabolic engineering[J].Metabolic Engineering,2009,11(3):192-198.
[37]Cao Y J,Jiang X L,Zhang R B,et al.Improved phloroglucinol production by metabolically engineered Escherichia coli[J].Applied Microbiology and Biotechnology,2011,91(6):1545-1552.
[38]Cao Y J,Xian M.Production of phloroglucinol by Escherichia coli using a stationary-phase promoter[J].Biotechnology Letters,2011,33(9):1853-1858.
[39]Marchand A P,Reddy G M.Improved synthesis of 3,5-diamino-2,4,6-trinitrotoluene[J].Synthesis-Stuttgart,1992,3:261-262.
[40]Jørgensen S H,Frandsen R J N,Nielsen K F,et al.Fusarium graminearum PKS14is involved in orsellinic acid and orcinol synthesis[J].Fungal Genetics and Biology,2014,70:24-31.
[41]Culberson C F,Culberson W L.β-Orcinol derivatives in lichens:Biogenetic evidence from Oropogon Ioxensis[J].Experimental Mycology,1978,2(3):245-257.
[42]Harborne J B,Williams C A.The identification of orcinol in higher plants in the family ericaceae[J].Phytochemistry,1969,8(11):2223-2226.
[43]Scalliet G,Lionnet C,Le Bechec M,et al.Role of petal-specific orcinol O-methyltransferases in the evolution of rose scent[J].Plant Physiology,2006,140(1):18-29.
[44]Christodoulatos C,Bhaumik S,Brodman B W.Anaerobic biodegradation of nitroglycerin[J].Water Research,1997,31(6):1462-1470.
[45]Esteve-Núñez A,Caballero A,Ramos J L.Biological degradation of 2,4,6-trinitrotoluene[J].Microbiology and Molecular Biology Reviews,2001,65 (3):335-352.
[46]Ricoux R,Boucher J L,Mansuy D,et al.Microperoxidase 8catalyzed nitration of phenol by nitrogen dioxide radicals[J].European Journal of Biochemistry,2001,268(13):3783-3788.
[47]Budde C L,Beyer A,Munir I Z,et al.Enzymatic nitration of phenols[J].Journal of Molecular Catalysis B-Enzymatic,2001,15(1-3):55-64.
[48]Kono Y,Yamasaki T,Ueda A,et al.Catalase catalyzes of peroxynitrite-mediated phenolic nitration [J].Bioscience,Biotechnology,and Biochemistry,1998,62(3):448-452.
[49]毕福强,樊学忠,许诚,等.1,1′-二羟基-5,5′-联四唑的合成及理论研究[J].火炸药学报,2013,36(4):22-25,36.BI Fu-qing,FAN Xue-zhong,XU Cheng,et al.Synthesis and theoretical study of 1,1′-dihydroxy-5,5′-bitetrazole[J].Chinese Journal of Explosives and Propellants,2013,36(4):22-25,36.

