白色念珠菌对人口腔黏膜上皮角质细胞的作用研究
张辉+俞诚波+张蓓蓓+叶美华+蔡敏秋+许红苗+林敏丽

[摘要] 目的 研究白色念珠菌对人口腔黏膜上皮角质细胞的作用机制。 方法 将培养的口腔黏膜上皮角质细胞分别加入孢子型白色念珠菌(孢子组)和菌丝型白色念珠菌(菌丝组),另将单独培养的口腔黏膜上皮角质细胞作为阴性对照组。比较各组对口腔黏膜上皮角质细胞的黏附作用,并观察白色念珠菌对口腔黏膜上皮角质细胞的凋亡和增殖作用。 结果 菌丝组黏附指数(7.63±1.39)显著高于孢子组(3.47±1.04),差异有统计学意义(P < 0.05);菌丝组凋亡率[(3.49±0.4)%]显著高于孢子组[(2.07±0.15)%]和阴性对照组[(1.98±0.07)%],差异有统计学意义(P < 0.05),而孢子组和阴性对照组凋亡率相比差异无统计学意义(P > 0.05)。菌丝组G0/G1期细胞比例[(38.17±7.83)%]显著低于孢子组[(49.47±11.41)%]和阴性对照组[(57.71±9.39)%],差异有统计学意义(P < 0.05);S期[(8.54±4.03)%]、G2/M期[(20.18±9.59)%]细胞比例上升,且显著高于孢子组[(6.47±2.73)%、(10.71±3.19)%]和阴性对照组[(5.35±2.11)%、(12.38±4.35)%],差异有统计学意义(P < 0.05);PI[(42.79±18.73)%]明显高于孢子组[(28.67±8.79)%]和阴性对照组[(26.87±7.64)%],差异有统计学意义(P < 0.05),而孢子组和阴性对照组PI相比差异无统计学意义(P > 0.05)。 结论 白色念珠菌能够导致口腔黏膜上皮角质细胞发生凋亡和增殖周期改变。
[关键词] 白色念珠菌;人口腔黏膜上皮角质细胞;细胞凋亡;细胞周期
[中图分类号] R781.5 [文献标识码] A [文章编号] 1673-7210(2015)01(a)-0004-04
Study on the mechanism of Candida albicans on human buccal epithelial cells
ZHANG Hui YU Chengbo ZHANG Beibei YE Meihua CAI Minqiu XU Hongmiao LIN Minli
Department of Stomatology, Wenling Hospital Affiliated to Wenzhou Medical College, Zhejiang Province, Wenzhou 317500, China
[Abstract] Objective To explore the mechanism of Candida albicans on human buccal epithelial cells. Methods The oral mucosa keratinocyte cultures were added to spore type of Candida albicans (spores group) and hyphae of Candida albicans (mycelium group), oral mucosal epithelial cells cultured alone as negative control group. Compared adhesion effect of oral mucosal epithelial cells in each group, and observed the apoptosis and proliferation of Candida albicans to buccal epithelial cells. Results Adhesion index of mycelium group (7.63±1.39) was significantly higher than spore group (3.47±1.04), with statistically significant difference (P < 0.05); the apoptosis rate [(3.49±0.4)%] was significantly higher than that in spores group [(2.07±0.15)%] and the control group [(1.98±0.07)%], with statistically significant difference (P < 0.05), while the spores group and the control group had no significant difference (P > 0.05). The proportion of phase G0/G1 in mycelium group [(38.17±7.83)%] was significantly lower than that of spore group [(49.47±11.41)%] and the control group [(57.71±9.39)%], with statistically significant difference (P < 0.05); the proportion of phase S [(8.54±4.03)%] and phase G2/M [(20.18±9.59)%] increased, significantly higher than those of the spores group [(6.47±2.73)%, (10.71±3.19)%] and the control group [(5.35±2.11)%, (12.38±4.35)%], with statistically significant difference (P < 0.05); PI [(42.79±18.73)%] was significantly higher than spore group [(28.67±8.79)%] and the control group [(26.87±7.64)%] , with statistically significant difference (P < 0.05), while the spores group and the control group had no significant difference (P > 0.05). Conclusion Candida albicans can cause oral mucosa keratinocyte apoptosis and proliferation cycle change.
[Key words] Candida albicans; Human oral mucosal epithelial cells; Apoptosis; Cell cycle
白色念珠菌(Canidia albicans)是一种常见的条件致病菌[1-2],正常情况下白色念珠菌不引起疾病,与机体共生,机体发生白色念珠菌感染的主要原因是正常的防御功能受到损害。白色念珠菌普遍存在于人体中,调查显示[3],口腔中白色念珠菌带菌率最高,约为85%。近年来大量广谱抗生素以及免疫抑制剂的使用导致菌群失调和机体免疫力降低,使得非致病性白色念珠菌转化为条件致病菌而引起各组织感染。研究显示[4],口腔白色念珠菌感染属于慢性感染,难以彻底根治,且病情容易反复发作,给患者的日常生活造成严重影响。关于白色念珠菌的致病机制目前仍无明确结论,有报道称[5],黏附作用在白色念珠菌定植、侵袭中发挥着重要作用。口腔黏膜上皮角质细胞是口腔防御的主要物质基础,也是白色念珠菌侵袭的主要靶细胞,但是白色念珠菌是如何侵袭口腔黏膜上皮角质细胞并产生致病作用,目前仍未见相关报道。本研究通过分析白色念珠菌对口腔黏膜上皮角质细胞的黏附作用以及对增殖和凋亡的影响,以期为丰富临床治疗提供理论基础,现将研究成果报道如下:
1 材料与方法
1.1 材料与试剂
白色念珠菌标准菌株(ATCC90029)购自南京便诊生物科技有限公司,人口腔黏膜上皮角质细胞购自中国医学科学院;沙堡(4%)葡萄糖琼脂培养基(SDA)购自广州市齐云生物技术有限公司;其他相关仪器和试剂均由温州医学院附属温岭医院实验室提供。
1.2 方法
1.2.1 白色念珠菌培养 将ATCC90029白色念珠菌标准菌株培养于沙堡培养基中,转种3次后配成菌悬液,浓度设定为3×105 CFU/mL。孢子型白色念珠菌:将白色念珠菌接种于酵母膏胨葡萄糖(YPD)培养基中37℃培养至长出白色乳状菌落,将菌落再转种于含YPD培养基的离心管中,37℃孵育18 h。菌丝型白色念珠菌:将白色念珠菌接种于pH 6.0、含10%磷酸盐缓冲液(PBS)的RPMI 1640培养基中,37℃孵育3~5 h即诱导出菌丝型白色念珠菌。
1.2.2 口腔黏膜上皮角质细胞培养 常规细胞传代培养,选择对数生长期的角质细胞,用含0.02%乙二胺四乙酸二钠(EDTA)的胰蛋白酶(0.25%)消化,将细胞收集并离心,弃去上清液,加入预先配置的冻存液,将细胞吹打混匀。-80℃保存待用。
1.2.3 实验分组 口腔黏膜上皮角质细胞在培养瓶中培养48 h,将细胞贴壁制成单层细胞,弃去培养液后用PBS冲洗3次。将加入菌丝型白色念珠菌的作为菌丝组,加入孢子型白色念珠菌的作为孢子组,单独培养的口腔黏膜上皮角质细胞作为阴性对照组。
1.2.4 黏附试验 生长期口腔黏膜上皮角质细胞用胰蛋白酶消化,将孢子型、菌丝型白色念珠菌分别与口腔黏膜上皮角质细胞共同培养48 h,用滤膜收集口腔黏膜上皮角质细胞,再用PBS洗滤3次,收集悬液离心,并制成涂片;待风干后进行染色,电镜下观测黏附现象。随机选择100个口腔黏膜上皮角质细胞,统计白色念珠菌总数,并计算黏附指数。黏附指数=黏附白色念珠菌数量/细胞总数。所有实验平行测量3次,取3次均值。
1.2.5 细胞凋亡检测 生长期口腔黏膜上皮角质细胞用胰蛋白酶消化,将不同表型白色念珠菌加入培养瓶中感染,并于CO2培养箱中培养48 h,然后胰蛋白酶消化,再用PBS冲洗3次,离心弃上清液。加入10 μL异硫氰酸荧光素混匀,室温避光反应20 min;再加入5 μL碘化丙啶后,采用流式细胞仪上机检测,计算细胞凋亡率,并用软件分析G0/G1期、S期、G2/M期细胞百分数。上述操作平行重复3次,取均值。增殖指数(PI)=[(S+G2/M)/G0/G1+S+G2/M]×100%。
1.3统计学方法
采用SPSS 17.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 各组黏附指数与凋亡率比较
菌丝组黏附指数显著高于孢子组(P < 0.05);菌丝组凋亡率显著高于孢子组和阴性对照组(P < 0.05),而孢子组和阴性对照组凋亡率相比差异无统计学意义(P > 0.05)。见表1。
表1 各组黏附指数与凋亡率比较(x±s)
注:与孢子组比较,aP < 0.05;与阴性对照组比较,bP < 0.05;“-”表示无数据
2.2 各组口腔黏膜上皮角质细胞周期比较
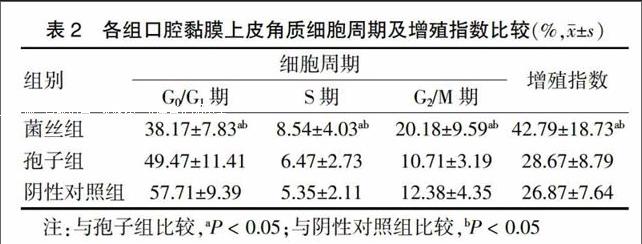
菌丝组G0/G1期细胞比例显著低于孢子组和阴性对照组(P < 0.05),S期、G2/M期细胞比例上升,且显著高于孢子组和阴性对照组(P < 0.05),PI明显高于孢子组和阴性对照组(P < 0.05),孢子组和阴性对照组PI比较差异无统计学意义(P > 0.05)。见表2。
表2 各组口腔黏膜上皮角质细胞周期及增殖指数比较(%,x±s)
注:与孢子组比较,aP < 0.05;与阴性对照组比较,bP < 0.05
3 讨论
口腔念珠菌感染是真菌-念珠菌属感染所引起的口腔黏膜疾病[6],又称口腔念珠菌病。近年来,由于抗生素和免疫抑制剂在临床上的广泛应用,发生菌群失调或免疫力降低,使内脏、皮肤、黏膜被真菌感染者日益增多,口腔黏膜念珠菌病的发生率也相应增高[7-8],其中,白色念珠菌是最主要的病原菌。鹅口疮(雪口病)是最常见的口腔念珠菌病。25%~50%的健康人口腔、阴道、消化道可带有念珠菌,但不发病;而非致病性念珠菌,在某种条件下,可转化为致病性[9],故有人称念珠状菌为条件致病菌。在幼儿雪口病、托牙性口炎、口角炎、念珠菌性白斑病和慢性黏膜皮肤念珠菌病患者中,白色念珠菌的检出率分别为84%、69%、77%、84%和100%[10]。念珠菌毒性的强弱,取决于毒性物质的代谢产物。在消化道或阴道内寄生的酵母型念珠菌并无致病性,而当它发育为菌丝型时,才有致病性。白色念珠菌的毒素具有相当于病毒的磷脂酶-A型的活性[11],以本菌的混悬液注入动物静脉中可致死。因此,病原菌的毒性和类型,与疾病力有密切关系。在健康带菌者中,唾液含菌量低于200 CFU/mL,因此,一般镜检法不能直接查见涂片中的病原体。白色念珠菌对口腔黏膜上皮有较强的黏附性,这是它致病作用的“立足点”,此种黏附性依靠上皮细胞表面的甘露糖苷蛋白部分[12],作为细胞的表面受体而发挥其黏附作用。因此,可破坏糖苷蛋白或相似结构物抑制黏附的发生,这对探索新的治疗药物提供了方向。
角质细胞是上皮细胞的重要组成部分,它为机体抵御外界病原菌侵袭提供了一层机械性屏障。目前研究证实[13],角质细胞是口腔黏膜损伤的靶细胞。Obokata等[14]研究中也提到,角质细胞是口腔黏膜上皮中含量最多的一种细胞,当发生白色念珠菌感染时,其也是主要侵袭靶细胞。白色念珠菌广泛存在于人和动物中,正常条件下不会致病;但有多数研究显示,白色念珠菌具有潜在致病性。Martinez等[15]证实,白色念珠菌感染疾病中,病变区上皮细胞明显增厚,深层显著增生,导致细胞有丝分裂加速,常伴有错角化,因此推测白色念珠菌可以导致口腔黏膜出现白斑损害。但是白色念珠菌的具体作用机制目前还不清楚,有研究认为[16],白色念珠菌致病性主要体现在侵袭能力,目前已知与侵袭能力相关的因素包括黏附性、疏水性和表型转换等。黏附性是白色念珠菌侵袭的第一步,也是其强致病力的主要标志。江文俊等[17]研究发现,白色念珠菌主要存在芽生孢子和假菌丝两种形式,也即孢子型和菌丝型,但是究竟何种类型的菌株具有致病性尚无统一定论。在本研究中,菌丝组黏附指数显著高于孢子组,这与阳隽等[18]报道结论相同,说明菌丝型的黏附能力大于孢子型。也有学者发现[19],白色念珠菌菌丝形成进一步促进黏附作用,而黏附也会加速菌丝形成。因此,可以初步推测,白色念珠菌菌丝的形成有利于提高黏附性。
细胞凋亡是清除细胞的正常途径,若正常凋亡受到影响,将会促进细胞异常发育和肿瘤的产生。李燕等[20]研究显示,随着肿瘤生长的加速,细胞凋亡数量也随之增加。曹婕等[21]对口腔黏膜上皮脱落碎片进行检测后证实,口腔恶性肿瘤或癌前病变的唾液中存在明显细胞凋亡情况,其凋亡与口腔白斑密切相关。高岩等[22]也发现,白斑癌变中,细胞凋亡参与了整个过程,且在不同过程作用各异,随着上皮细胞增生的加重,凋亡呈指数上升。本次研究中菌丝组凋亡率显著高于孢子组和阴性对照组,证实菌丝的产生促进细胞凋亡,这可能是白斑发生癌变的原因之一。
在细胞周期中,G1期是RNA和DNA聚合酶合成期,S期是DNA合成期。一般情况下,繁殖旺盛的细胞在S期、G2/M期比例较高。而PI则代表整个群体中细胞增殖的能力。为了进一步研究此过程,本研究对细胞不同分裂时期的细胞比例进行分析,结果显示,菌丝组G0/G1期细胞比例显著低于孢子组和阴性对照组,S期、G2/M期细胞比例显著高于孢子组和阴性对照组,PI也随之增加。说明菌丝型能够促进口腔黏膜上皮角质细胞的增长,其机制可能是促进细胞由G1期向S期转变,导致DNA合成加快,细胞增殖速度增加。此外本结果也提示白色念珠菌对口腔黏膜上皮角质细胞的增殖促进作用依赖于菌株的毒性作用和细胞的感染能力。目前多数专家达成的共识是:白色念珠菌中的毒性作用导致口腔黏膜上皮角质细胞中抑制增殖物质合成减少,使上皮细胞过度角质化,细胞出现异常增生,并可能发生癌变。本研究结论与上述观点完全相符。当然白色念珠菌导致口腔癌变的机制较多,而本研究也只是初步探讨了其癌变可能的机制之一,但是本实验证实白色念珠菌的表型与口腔白斑和癌变密切相关,这需要引起临床重视。
综上所述,白色念珠菌能够导致口腔黏膜上皮角质细胞发生凋亡和增殖周期改变,这种改变依赖于该菌的黏附性和感染性。
[参考文献]
[1] Postigo A,Bulacio L,Sortino M. Photodynamic inactivation of oropharyngeal Candida strains [J]. Phytomedicine,2014, 7113(14):212-218.
[2] Chang HT,Tsai PW,Huang HH,et al. LL37 and hBD-3 elevate the β-1,3-exoglucanase activity of Candida albicans Xog1p, resulting in reduced fungal adhesion to plastic [J]. Biochem J,2012,441(3):963-970.
[3] 王娜,李泽慧,钟良军,等.4种维药体外抗白色念珠菌的活性测定[J].口腔医学研究,2012,28(3):250-251.
[4] 张琳,黄晓旭,赵玮,等.先天性心脏病儿童牙菌斑中白色念珠菌的携带情况[J].临床口腔医学杂志,2014,(6):326-328.
[5] 刘青青,林小洁,陶人川,等.人类β防御素3及富组蛋白5对念珠菌黏附牙龈上皮细胞的抑制作用[J].广东医学,2014,35(3):370-373.
[6] 周唯,唐立辉,黄萍,等.三种新型可聚合抗菌单体对口腔病原菌的抗菌活性研究[J].实用口腔医学杂志,2012, 28(3):298-301.
[7] 张任秀.乳杆菌DM9811脂肪酸组分抑制白色念珠菌致老年义齿性口炎的作用[J].中国老年学杂志,2011,31(24):4787-4788.
[8] 张燕萍,吴凤鸣.5种义齿清洁剂对白色念珠菌生物膜清洁效果的比较[J].口腔医学研究,2011,27(5):368-371.
[9] 仵楠,赵今.白色念珠菌与主要致龋菌相关性研究[J].口腔医学研究,2012,28(10):1080-1082.
[10] 邱宏亮.脉冲Nd-YAG激光控制糜烂型扁平苔藓患者白色念珠菌检出率及分离株毒力的临床研究[J].实用口腔医学杂志,2014,30(1):85-88.
[11] 杨海萍,何虹,苗卓伟,等.口腔白色念珠菌感染的机体免疫机制研究进展[J].浙江医学,2011,33(8):1257-1259.
[12] 肖静,牛文钰,滕伟,等.聚酰胺-胺对白色念珠菌和牙龈卟啉单胞菌的抗菌性研究[J].中华口腔医学杂志,2011, 46(z1):94-98.
[13] 魏美荣,李国菊,张达,等.角质细胞生长因子对口腔黏膜上皮细胞凋亡的作用研究[J].华西口腔医学杂志,2013, (6):565-568.
[14] Obokata H,Yamato M,Yang J,et al. Subcutaneous transplantation of autologous oral mucosal epithelial cell sheets fabricated on temperature-responsive culture dishes [J]. J Biomed Mater Res A,2008,86(4):1088-1096.
[15] Martinez RC,Seney SL,Summers KL,et al. Effect of Lactobacillus rhamnosus GR-1 and Lactobacillus reuteri RC-14 on the ability of Candida albicans to infect cells and induce inflammation [J]. Microbiol Immunol,2009,53(9):487-495.
[16] Trabocchi A,Mannino C,Machetti F,et al. Identification of inhibitors of drug-resistant Candida albicans strains from a library of bicyclic peptidomimetic compounds [J]. J Med Chem,2010,53(6):2502-2509.
[17] 江文俊,姜福全,崔彦,等.白色念珠菌生物学特性研究进展[J].基础医学与临床,2014,34(4):550-554.
[18] 阳隽,张天托,朱家馨,等.白色念珠菌体外生物膜形成与基因分型关系的研究[J].国际检验医学杂志,2012, 33(13):1539-1541.
[19] 邱荣敏,赵玮,林艳,等.葡萄糖浓度对婴幼儿牙菌斑中白色念珠菌产酸和粘附性的影响[J].实用口腔医学杂志,2014,30(1):95-98.
[20] 李燕,李雯雯,王晓敏,等.JAK2V617F基因突变与骨髓增殖性肿瘤疾病类型及疾病转化的相关性分析[J].中国全科医学,2012,15(30):3486-3488.
[21] 曹婕,刘宏伟,刘晓松,等.口腔黏膜微核细胞数与上皮异常增生病损癌变的关系[J].北京大学学报:医学版,2011,43(4):600-602.
[22] 高岩,郭竹玲,罗海燕,等.口腔黏膜白斑癌变85例临床病理分析[J].中华口腔医学杂志,2012,47(7):410-413.
(收稿日期:2014-08-26 本文编辑:程 铭)

