桑叶清热解毒颗粒质量标准研究
何振洋+钟婷+许士杰+和东亮+赵珊珊+胡冬华

摘要:对桑叶清热解毒颗粒质量标准进行了研究,采用薄层色谱法对桑叶清热解毒颗粒进行定性鉴别,采用紫外可见分光光度法对桑叶清热解毒颗粒中总黄酮进行含量测定。结果表明:桑叶总黄酮线性范围是8~48mg/L,平均回收率是98.57%,RSD是0.52%,该方法可行,重现性比较好,能有效地控制桑叶清热解毒颗粒的质量。
关键词:桑叶清热解毒颗粒;桑叶总黄酮;质量标准
中图分类号:R917
文献标识码:A文章编号:1674-9944(2014)12-0228-04
1引言
桑叶,桑科植物桑树的叶,全国大部分地区均有生产,不喜光,耐寒,耐旱,不喜水湿。英文名称Mulberry。桑叶完整叶片呈宽卵形,是蚕的主要食物,长约15cm,宽约10cm,叶柄长约4cm,叶片基部呈现心脏形,顶端微尖,边缘有锯齿,握之扎手。气淡,味微苦涩。药用一般认为霜后采者质佳。有清热解毒、抗炎、降血糖血脂等功效。《日华子本草》中记载利五脏,通关节,下气,煎服,除风痛出汗,并补损淤血,并蒸后署,蛇虫蜈蚣咬,盐捋敷上。
桑叶中主要含有黄酮类化合物、生物碱类、植物甾醇、γ-氨基丁酸和桑叶多糖等,其中黄酮类化合物是植物界中茎叶含量最多的一类植物[9,12]。桑叶具有很高的药用价值:①清热解毒,疏散风热,用于治疗风热感冒以及目赤肿痛;②清肝明目,用于肝火目赤,头晕眼花;③清肺润燥,用于肺热咳嗽。桑叶清热解毒颗粒是以中药饮片为原料,通过现代制药技术,提取、浓缩、分离、干燥、制粒,包装精制而成。笔者参见2010版《中国药典》对桑叶清热解毒颗粒进行了质量标准的研究,现报道如下。
2仪器与试剂
2.1仪器
TU-1810型紫外-可见分光光度计(北京普析通用仪器有限公司);AL104型电子分析天平(十万分之一)梅特勒托利多(上海有限公司)。
2.2试剂与试药
超纯水;其他试剂均是分析纯。
2.3样品与对照品
供试样品:桑叶清热解毒颗粒(批号:20130104、20130105、20130106、20130107、20130108、20130109、20130110、20130111、20130112、20130113)。
对照品:芦丁对照品(批号:101180-201301 ,供含量测定用,规格:25mg,购买于中国药品生物制品检定所);桑叶对照药材(批号: ZS298145,供含量测定用,规格:200mg,购买于中国药品生物制品检定所)。
3实验方法与结果
3.1定性鉴别
3.1.1供试品溶液制备
桑叶清热解毒颗粒5g,加甲醇25mL,超声处理15min,过滤后,把滤液蒸干,将残渣加水10mL使溶解,加正丁醇振摇并提取2次,每次25mL,合并正丁醇液,蒸干后,将残渣加甲醇1mL使溶解,作为供试品溶液,以备后用。
3.1.2阴性对照溶液的制备
本品制备过程中以赤藓糖醇作为辅料,故将赤藓糖醇,按照供试品处理方法作为阴性对照溶液,以备后用。
3.1.3对照品溶液的制备
称取桑叶对照药材1g,加甲醇25mL,[6]超声处理10min,过滤,将滤液蒸干,残渣加水10mL,使溶解,加正丁醇振摇并提取2次,每次用25mL,最后合并正丁醇液,蒸干,残渣加甲醇1mL,使之溶解,作为对照品溶液。
3.1.4薄层色谱条件
吸附剂:以硅胶G为吸附剂。
展开剂:正丁醇-冰醋酸-水(4∶1∶5),取上层,作为展开剂。
显色剂:10%AlCl3乙醇溶液。
检视方式:在UV365nm下进行检视[13]。
3.1.5薄层色谱鉴别结果
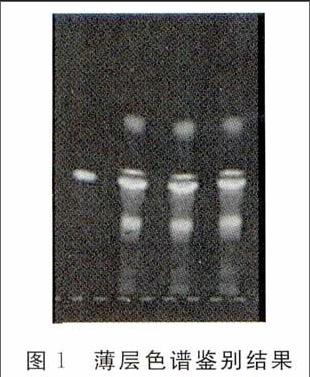
以芦丁为对照品,称取0.5g,按照桑叶清热解毒颗粒供试品处理方法处理,作为标准对照溶液。薄层色谱鉴别结果如图1。
图1薄层色谱鉴别结果
从左向右依次编号为1、2、3、4、5号,1号是阴性对照溶液,2号是芦丁对照品溶液,3号是桑叶对照药材溶液,4和5号是桑叶清热解毒颗粒溶液。
3.2含量测定
3.2.1对照品溶液的制备
取芦丁对照品,在105℃干燥至恒重,精密称定2mg,置于10 mL量瓶中,加入一定量甲醇(分析纯,4mL)溶解并稀释至刻度,摇匀后,即得0.2mg/mL。
3.2.2供试品溶液的制备
精密称取本品1.2g,加入超纯水20mL使之溶解,通过聚酰胺柱,用100mL超纯水洗脱至滤液无色。最后用100mL乙醇(分析纯)分3次洗脱,收集洗脱液,浓缩至干,残渣加一定量超纯水溶解后,转移至100mL容量瓶中,加超纯水至100mL刻度线,再取1 mL,置于100 mL容量瓶中,加入超纯水定容至100 mL,作为供试品溶液。
3.2.3测定波长的选择
取芦丁对照品溶液,甲醇(分析纯)作为空白溶液[10,11,15],置于紫外-可见分光光度计上,在700~400nm可见光波长范围内进行扫描,结果显示,在510nm波长处有最大吸收,所以选定检测波长为510nm。
3.2.4含量测定
取10批桑叶清热解毒颗粒样品,按照上述方法制备成供试品溶液,每批制备2份,分别精密吸取对照品溶液和供试品溶液,各1ml,参照标准曲线项下方法进行显色,以紫外-可见分光光度法,在510nm处测定吸光度,并用吸光度来计算10批样品中桑叶总黄酮的含量,实验结果见表1。
3.3方法学考察
3.3.1线性关系考察endprint
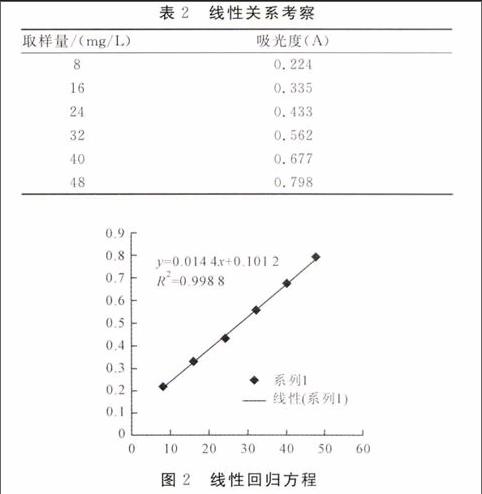
精密吸取0.2mg/mL标准溶液0.4、0.8、1.2、1.6、2.0和2.4 mL,分别置于10 mL的容量瓶中,分别加一定量超纯水至2.4 mL, 然后加入5%亚硝酸钠溶液0.4 mL,摇匀后静置6 min,加入10%硝酸铝溶液0.4 mL, 摇匀, 再静置6 min, 然后加入4.3%氢氧化钠溶液4.0 mL,最后加入超纯水定容至刻度线,充分摇匀,静置15 min后,得8、16、24、32、40和48 mg/L系列标准溶液。分别取1.0 mL标准溶液放入比色皿中[5,7,8],以空白溶液作参比,测定各个浓度标准溶液的吸光度。以各标准溶液浓度为横坐标,以各吸光度为纵坐标,绘制标准曲线(图1)。标准曲线表明标准溶液在8~48mg/L的范围内,浓度与吸光度呈线性关系,并得到回归方程:Y=0.0144X+0.1012,r2=0.9988。试验结果可见表2和图2。
3.3.2稳定性试验
精密吸取同一供试品溶液和对照品溶液各1mL,依上述方法处理,然后按照紫外-可见分光光度法,在检测波长510nm处,每隔20min分别依法测定各个吸光度,以芦丁对照品的吸光度为指标,测定供试品的稳定性,试验结果在表3中记录。
稳定性考察结果表明:对照品溶液和供试品溶液在2h内测定结果的RSD(%)分别为0.91%、0.68%,供试品溶液经显色后在120min内稳定性良好。
3.3.3精密度试验
精密吸取供试品溶液和芦丁对照品溶液各1mL,按照上述方法处理后,依照紫外-可见分光光度法[16],在检测波长510nm处,分别依法测定各自吸光度6次,并且以芦丁吸光度为指标,计算并考察精密度,试验考察结果记录在表4。
精密度考察试验结果表明:对照品溶液和供试品溶液经过连续测定,各自结果的RSD(%)分别为0.12%、1.94%,仪器、方法的精密度良好。
3.3.4重现性试验
精密称取同一批样品6份,按照供试品溶液制备项下方法制备溶液,进行依法显色,分别独立进行测定,并且[17]计算样品中桑叶总黄酮的含量,来考察本法的重现性,试验结果记录在表5。
3.3.5加样回收率试验
精密称取同法测定的已知含量供试品6份,分别精密加入相同对照品一定量,依法分别进行测定,计算各自的回收率,试验结果见表6。
加样回收率试验结果表明:平均回收率为98.57%,RSD(%)为0.52%,本法的准确性较好,并且本方法可行。
4小结与讨论
(1)定性鉴别过程中,对桑叶清热解毒颗粒的总提取物,采用的是超声提取法,以甲醇(分析纯)为溶剂,对桑叶总黄酮采用正丁醇分次提取,具体方法是取桑叶清热解毒颗粒5g,加甲醇25mL,超声处理时间是15min,过滤,滤液蒸干,残渣用超纯水溶解,加正丁醇振摇并提取2次,每次用正丁醇25mL,合并正丁醇提取液,蒸干后,残渣加甲醇1mL使之溶解,作为供试品溶液。实验表明,超声提取法不仅使定性鉴别结果好,而且实验效率高。
(2)在含量测定过程中,笔者采用聚酰胺柱层析分离法分离纯化得到桑叶总黄酮,超纯水洗脱至滤液无色,最后用乙醇(分析纯)洗脱,收集合并洗脱液,浓缩干后,残渣加一定量超纯水,溶解并转移至100mL容量瓶中,加超纯水至100mL刻度线,再精取其中1 mL置于100 mL容量瓶中,加超纯水定容至100 mL,作供试品溶液。方法学考察实验证明:这个方法能有效地提取分离出桑叶总黄酮,并且方法的可行性和重现性良好。
参考文献:
[1]国家药典委员会.中华人民共和国药典2010年版一部[S].北京:化学工业出版社,2005.
[2]何照范,张迪青.保健食品化学及检测技术[M].北京:中国轻工业出版社,1998:112.
[3]熊知行.叶文峰 酶法提取桑叶中黄酮类化合物的研究 [J].食品工业科技,2009(3).
[4]宋秋华,张磊,梁飞.黄酮类化合物的提取工艺研究进展[J].山西化工,2007(4):24~27.
[5]周天达,周雪仙.藤茶中双黄酮醇的分离、结构鉴定及其药理活性[J].中药及天然药物,1996(8):458.
[6]佚名.丁香花总黄酮的超声波提取及鉴别[J].广西师范学院学报:自然科学版,2007,24(3).
[7]石秀梅,邹辉,李春彦.近年来茶叶中总黄酮类化合物测定方法研究概况[J].中国民族民间医药杂志,2007(5).
[8]王燕.柿叶中黄酮类化合物的研究进展[J].亚太传统医药,2011(4).
[9]杨青珍,王锋,王帅龙.桑叶黄酮类物质的提取工艺及抗氧化性研究[J].江苏农业科学,2010(2).
[10]谢明勇,王元兴,易醒.青钱柳叶中黄酮化合物结构及含量研究[J].分析化学,2004(8):1053~1056.
[11]藏南.王学英,孙佳,等.不同品种不同发育期的榨蚕幼虫黄酮类化合物的提取及含量变化[J].食品研究及开发,2008(5).
[12]雍国新.薛梅.陈青桑叶中总黄酮的提取工艺研究[J].内蒙古中医药,2011(4).
[13]佚名.辣椒中芦丁的薄层及紫外鉴别[J].现代生物医药进展,2006,6(10).
[14]佚名.苦荞黄酮提取与分离技术的研究进展[J].安徽农业科学,2009(27).
[15]佚名.紫外分光光度法测定双山颗粒中总黄酮的含量[J].广西科学院学报,2010,26(3).
[16] Sun, Z.,Hou, S.,Yang, W.,et al. Cloning, Characterization and Functional Analysis of a Phenylalanine Ammonia-lyase Gene (FtPAL) from Fagopyrum tataricum Gaertn[J].Plant Molecular Biology Reporter,2012,30(5).
[17] Exogenous application of salicylic acid enhanced the rutin accumulation and influenced the expression patterns of rutin biosynthesis related genes in Fagopyrum tartaricum Gaertn leaves[J].Plant Growth Regulation,2012,68(1).endprint

