腹腔热灌注奈达铂化疗在恶性腹腔积液中的临床疗效及安全性观察
王付湘
[摘要] 目的 分析奈达铂与顺铂分别应用于恶性腹腔积液患者的抗癌效果及用药安全性,为该类患者临床诊疗积累实践性经验。 方法 本院2011年7月~2013年8月收治78例恶性腹腔积液患者,利用随机数字表法进行分组,分别设为研究组和对照组,每组39例。两组患者均接受灌注化疗,其中对照组给予顺铂常规腹腔灌注,研究组采取奈达铂腹腔热灌注化疗,记录并比较两组治疗6个月末不良反应发生情况及腹腔积液控制水平。 结果 研究组腹水消退有效率高于对照组(P<0.05)。两组不良反应发生率比较差异无统计学意义(P>0.05)。 结论 恶性腹腔积液患者实施腹腔热灌注奈达铂化疗相较于常规腹腔灌注方案,更有利于减轻机体毒副反应,且能有效控制积液水平,值得临床推广。
[关键词] 奈达铂;顺铂;热灌注化疗;腹腔积液,恶性;毒副反应
[中图分类号] R453 [文献标识码] A [文章编号] 1674-4721(2014)12(b)-0077-04
我国已逐步迈向老龄化社会,与之相伴随的是因机体细胞衰老而诱发的各类恶性肿瘤发生率呈攀升之势。据文献指出,妇科恶性肿瘤与胃肠道肿瘤是当前发病率上升幅度最高的两大类癌症,大多数来院就诊患者已步入中晚期阶段,由于癌细胞具有转移性,往往导致其他部位出现多种继发性肿瘤,这给治疗增加了不少难度[1]。以癌细胞脱落进入腹膜腔及腹腔淋巴结后而诱发的恶性腹腔积液是临床上常见的继发性肿瘤之一,患者在临床上表现为腹内压升高及腹水增多的不良症状,这会明显降低患者的生存时间,且会增加其生理性痛苦[2]。当前,恶性腹腔积液最为有效的治疗手段为腹腔灌注化疗,主要包括传统腹腔恒温灌注化疗及新型腹腔热灌注化疗。两种方案均为物理疗法与化学疗法相结合而催生的治疗方案,其治疗机制主要是将抗癌药物以液体的形式输注腹膜腔中,提高药物与癌细胞的接触面积,一方面能保证有效的血药浓度,另一方面能提高对癌细胞更为客观的杀伤力度[3]。目前在国内就这两类治疗方案的临床疗效及安全性差异的研究仍为数不多,笔者拟设计对照研究,进一步量化临床效益差异情况。
1 资料与方法
1.1 一般资料
选取本院2011年7月~2013年8月收治的78例恶性腹腔积液患者,其中男40例,女38例,年龄为42~81岁,平均为(72.8±3.1)岁。所有患者入院当天均经影像学、血生化常规及病理组织活检,确诊为相应恶性肿瘤,诊断参照人卫第7版《肿瘤学》教材中关于该病诊断标准。纳入标准:患者无心、肝、肾等重要脏器疾患;无任何精神或心理疾病;ECOG(WHO颁发的体力状况评分)为0~2分;预计生存时间≥3个月;患者及家属了解本调研全部内容且签署同意书。采用随机数字表法分为研究组和对照组,每组39例,其中研究组男性21例,女性18例,平均年龄为(71.7±2.8)岁,ECOG评分为(1.4±0.3)分,胃癌17例,结肠癌11例,卵巢癌11例;对照组男性19例,女性20例,平均年龄为(73.9±3.4)岁,ECOG评分为(1.5±0.4)分,胃癌18例,结肠癌9例,卵巢癌12例。两组的性别、年龄、肿瘤类型比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 研究组 实施腹腔热灌注化疗,化疗药物为奈达铂(齐鲁制药有限公司,国药准字H20050563),具体操作步骤为:利用B超定位腹腔积液位置,并确定最佳穿刺点,再穿刺置管成功构建腹腔双通道;初步评估腹水量及黏稠度,若评估结果显示腹水较为黏稠且含量较多时,应先将3.5 L生理盐水输入双通道中,并同步放出3.5 L腹水,且需保证输入量与输出量处于动态平衡,以免腹内压骤变引起内脏受损。若腹水评估结果较为理想,则先测量积液的出体温度,若达到40~42 ℃,可将30 mg奈达铂放入20~50 ml生理盐水中,从注药口通道输入,并开启双通道的有效循环通路,保证循环持续达1 h。待时间结束后,现将腹腔内的灌注液排出1 L左右,再将70 mg奈达铂放入10 ml生理盐水中进行稀释处理,待配置溶液后注入管道内。为尽可能降低灌注过程中所产生的不良反应,可将10 mg地塞米松配伍40 mg呋塞米通过注药口输入患者腹腔内,并指导患者每隔10 min更换1次体位,灌注全程共需变换12次体位,以保证药液充分浸润腹腔脏器及肠管壁。据文献指出,一旦奈达铂使用剂量>10 mg,为避免肾功能损害需行水化利尿干预。另外,患者在治疗全程中若表现出恶心、呕吐等胃肠道不适症状,需行8 mg恩丹西酮口服给药。化疗方案每隔2 d需重复灌注1次,每个疗程共包含3次灌注化疗。
1.2.2 对照组 实施常规腹腔关注化疗,化疗用药为顺铂(齐鲁制药有限公司,国药准字H37021358),具体操作步骤为:首先通过恒温箱对1.5 L生理盐水进行预热处理,使其始终维持在43 ℃左右,以作备用;再将10 mg顺铂注入进药口管腔,同时连接已预热处理的生理盐水进行循环灌注,指导患者每隔10 min更换1次体位,灌注全程共需改变12次体位。在化疗全程中,为减轻患者不良毒副反应,应将40 mg呋塞米、10 mg地塞米松加入50 ml生理盐水配置成溶液,并一同加入灌注液中;若患者出现胃肠道不良反应,应及时给予8 mg恩丹西酮。化疗方案每隔2 d需重复灌注1次,每个疗程共包含3次灌注化疗。
1.3 观察项目
所有患者于化疗前及化疗后第4周末行腹部超声检查,并评价腹腔积液量情况。腹腔积液量评价标准:Ⅰ级为肠间积液;Ⅱ级为肝肾间积液;Ⅲ级为肝前积液。根据腹水改善情况进行临床疗效等级划分。①无效:疗前腹水Ⅲ级且疗程结束后1个月随访时腹水Ⅲ级;疗前腹水Ⅱ级且疗程结束后1个月随访时腹水Ⅱ级;疗前腹水Ⅰ级且疗程结束后1个月随访时腹水Ⅰ级。②部分缓解:疗前腹水Ⅲ级且疗程结束后1个月随访时腹水Ⅱ级。③完全缓解:疗前腹水Ⅲ级且疗程结束后1个月随访时腹水Ⅱ级;疗前腹水Ⅱ级且疗程结束后1个月随访时腹水Ⅰ级;疗前腹水Ⅰ级且疗程结束后1个月随访时腹水消失。有效率=(部分缓解+完全缓解)例数/总例数×100%。记录两组患者化疗期间不良反应发生情况。endprint
1.4 统计学处理
采用SPSS 19.0统计软件对数据进行分析和处理,计量资料以x±s表示,采用两独立样本t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
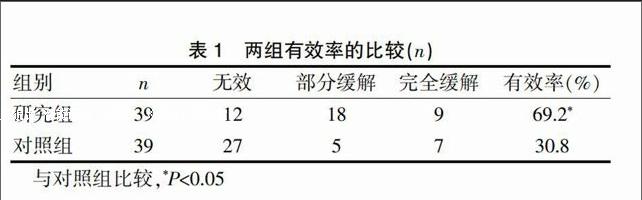
2.1 两组有效率的比较
研究组有效率高于对照组(χ2=8.108,P<0.05)(表1)。
表1 两组有效率的比较(n)
与对照组比较,*P<0.05
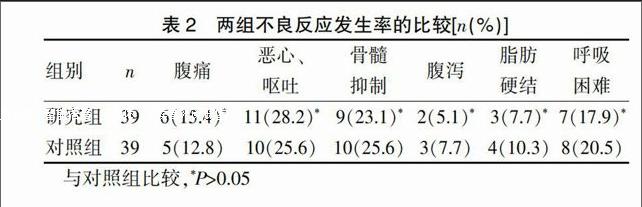
2.2 两组不良反应发生率的比较
两组不良反应发生率比较差异无统计学意义(P>0.05)(表2)。
表2 两组不良反应发生率的比较[n(%)]
与对照组比较,*P>0.05
3 讨论
恶性腹腔积液是恶性肿瘤常见的晚期并发症之一,该病主要是由于腹腔脏层和壁层腹腔出现癌细胞远处转移或局部癌肿浸润所致,导致腹腔出现大量异常积液[4]。目前在临床上应用较广的治疗手段包括单纯放水、体外循环灌注热化疗、腔内注射化疗药物及安装闭式引流管等。体循环热灌注化疗方案是以单一体腔热物理灌注法,将灌洗液经高温处理后,灌注冲洗腹腔浆膜层转移种植或发生于肠道、肝脏等脏器上的浅表肿瘤,借助铂类、阿奇霉素等热敏化疗药物,能有效提高对肿瘤细胞的杀伤力度[5];另外,这些药物在腹腔内停留时间长,与腹膜接触面积广,进而有效提高区域抗癌效果。据文献报道,体循环灌注热化疗在控制恶性腹腔积液方面成效显著,能有效减轻晚期癌肿患者生理痛苦,并延长生存时间,是当前晚期肿瘤治疗的常见辅助手段之一[6]。笔者所在医院目前针对恶性腹腔积液主要开展两种治疗方案,分别为体循环灌注热化疗和常规腹腔灌注化疗方案,由于国内研究就上述两种方案在临床疗效及安全性方面仍报道不多,故设计前瞻性对照研究,为恶性腹腔积液的有效方案制订提供数据支持。
研究表明,研究组腹水消退情况优于对照组(P<0.05),表明体循环灌注热化疗在抗癌性腹腔积水方面成效高于常规腹腔灌注化疗,因为体循环灌注热化疗的治疗原理是根据人体正常细胞与癌肿细胞含水量、血流量等生物学特征的差异以及对温度敏感性的不同,利用肿瘤热疗的基本理论,将感应式非接触加热装置连接体外循环灌注热化疗系统,使生理盐水等治疗液加热至治疗温度,通过动力循环泵将其泵入腹膜腔,并在处方规定的治疗时间内持续恒温,以有效发挥热杀伤力度[7]。该治疗方案还能对种植于浆膜层上的转移癌细胞实现热清扫,同时还能根据热疗后癌细胞代谢障碍及DNA、RNA等遗传物质损伤的生物学特性,给予具有热增敏效果的化疗药物,使癌细胞彻底中止有丝分裂,消除导致癌性积液的原发病灶,并快速修复浆膜,实现有效控制恶性积液的目的[8]。另外,腹膜腔所灌注的化疗药物以生理盐水作为载体,能使化疗药液充分接触腹膜腔表面积,使其在腹膜腔内保持较为恒定、持久的药物浓度,进而最大限度地杀灭恶性癌肿[9]。正是由于恒温化疗灌洗液的抗癌原理,成功地解决了临床上体腔灌注温度不恒定、体腔温度热匀散不理想、操作复杂等问题,避免了传统疗法经常并发的包裹、粘连、肠梗阻等系列后遗症[10]。
在不良反应发生率方面,两组比较差异无统计学意义(P>0.05),表明体循环灌注热化疗是一项相对安全的治疗手段。因为腹膜腔内毛细血管分布较少,热灌注液主要以局部区域性杀灭癌肿细胞为主,较少通过血管吸收进入体循环,进而全身毒副作用较小[11]。两组不良反应主要集中于腹痛和恶心、呕吐,由于灌洗液进入腹膜腔会导致交感神经张力增强,肠蠕动因外界应激源刺激会减慢蠕动次数,导致腹胀、腹痛情况的出现,而腹胀加上奈达铂对胃黏膜的刺激作用,会引起恶心,但上述两种症状经对症处理后均好转,不影响患者继续接收化疗。两组患者骨髓抑制发生率均较低,且程度较轻,均为Ⅰ度,与相关文献[12]报道结果相似。
综上所述,对于存在恶性腹腔积液的晚期肿瘤患者,开展体循环灌注热化疗,相较于常规灌注化疗,在腹水控制方面成效更佳,且安全性尚可,值得临床推广。
[参考文献]
[1] 李维,王华庆,赵阔,等.奈达铂腹腔热灌注化疗治疗癌性腹腔积液的疗效观察及分析[J].中国肿瘤临床,2012,39(22):1741-1744.
[2] 林允照,顾华,沈健.癌因性疲乏研究进展[J].浙江预防医学,2014,26(8):796-799,802.
[3] 李征,杨克虎,米登海,等.进展期胃癌术后腹腔热灌注化疗有效性和安全性的系统评价[J].中国循证医学杂志,2011,11(12):1402-1408.
[4] 魏琳,赵建武,梁文通.腹腔热灌注化疗治疗卵巢癌研究进展[J].贵州医药,2011,35(3):269-272.
[5] 李春香,张燕.吉西他滨联合奈达铂腹腔热灌注化疗治疗晚期胰腺癌的疗效观察[J].肿瘤基础与临床,2011,24(1):65-66.
[6] 孟令新,丁兆军,陈希平.热疗联合腹腔热灌注化疗治疗胰腺癌并腹腔积液的疗效观察[J].中华临床医师杂志,2011,5(7):l923-1927.
[7] 土秀清,方献英,柏峰.晚期卵巢癌术后早期奈达铂腹腔热灌注化疗临床研究[J].现代肿瘤医学,2011,19(10):2061-2063.
[8] 薛茜,胡元萍,林允照,等.延续护理对乳腺癌根治术患者术后心理状况和躯体功能的影响[J].海南医学,2014,25(10):1551-1553.
[9] Smolle E,Taucher V,Haybaeck J.Malignant ascites in ovarian cancer and the role of targeted therapeutics[J].Anticancer Res,2014,34(4):1553-1561.
[10] Zhao J,Chen XX,Zhang AM,et al.A pilot study of combination intraperitoneal recombinant human endostatin and chemotherapy for refractory malignant ascites secondary to ovarian cancer[J].Med Oncol,2014,31(4):930.
[11] Bezan A,Hohla F,Meissnitzer T,et al.Systemic effect of catumaxomab in a patient with metastasized colorectal cancer:a case report[J].BMC Cancer,2013,13(1):618.
[12] He ZY,Wei XW,Luo M,et al.Folate-linked lipoplexes for short hairpin RNA targeting claudin-3 delivery in ovarian cancer xenografts[J].J Control Release,2013,172(3):679-689.
(收稿日期:2014-09-13 本文编辑:李亚聪)endprint