癫痫患者CYP2C19基因多态性对丙戊酸钠血药浓度的影响
韩瑞玲,李艳,吴薇
癫痫是由于大脑神经元突发性异常放电导致的短暂大脑功能障碍,发病率较高(我国总体患病率约2.89‰[1])、病程长(大多需要终身服药)、治愈率低。丙戊酸钠(sodium valproate,VPA)是临床上常用的一线抗癫痫药物,有效血药浓度范围是50~100 μg/mL,但由于其体内的非线性药物代谢动力学特征,导致药物代谢的个体差异增大(血药浓度不足或过量),用药剂量和血药浓度之间不呈正相关[2]。大量研究表明,药物代谢酶的遗传多态性可导致药物血药浓度的差异,是影响VPA给药剂量的重要因素之一[3,4]。
细胞色素酶P450 2C19(cytochrome P450 2C19,CYP2C19)是一种重要的药物代谢酶,参与多种药物(如VPA、氯吡格雷、苯妥英钠、奥美拉唑等)的体内代谢。但CYP2C19活性在不同的人群中具有较大的差异,这是因为编码酶的CYP2C19基因具有遗传多态性(*1,*2,*3)导致酶的活性不同,从而引起不同人群、不同个体对药物的代谢能力下降或增强,影响相关药物的体内代谢及疗效[5]。
因此通过检测患者CYP2C19基因型,判断患者代谢速度(快代谢、慢代谢),合理调整用药剂量,是提高VPA的药物疗效,减少毒副作用的有效途径。本研究即探讨癫痫患者中VPA代谢相关基因CYP2C19多态性分布及其与血药浓度的关系,为临床医师合理使用VPA等相关药物提供参考和指导。
1 资料与方法
1.1 资料
1.1.1 一般资料 选择2014年2月至2015年2月在武汉大学人民医院神经内科、神经外科住院,诊断为癫痫并以VPA片剂单药治疗的无血缘关系的患者177例,男 109例(61.6%),女 68例(38.4%);年龄18个月~67岁,平均年龄(19.5±21.3)岁;均为汉族;均否认家族遗传病病史;服用剂量为0.2~1.2 g/d,分1~3次服用,并根据疗效及VPA血药浓度(控制在 50~100 μg/mL)调整剂量。
1.1.2 试剂和仪器 Viva-E药物浓度分析系统,购于美国Syva公司;BR-526-24全自动杂交仪、BE2.0生物芯片识读仪、全血基因组DNA提取试剂盒及CYP2C19基因检测DNA微阵列芯片法试剂盒均购于上海百傲科技有限公司;T100型PCR仪购于美国Bio-rad公司;干式恒温器购于杭州奥盛公司;高速离心机购于美国Thermo公司;涡旋振荡器购于江苏海门其林贝尔仪器厂。
1.2 方法
1.2.1 标本采集 所有患者在单一服用VPA5个半衰期(约100 h)后,于下次清晨空腹服药前,静脉采血2~3 mL(EDTA抗凝管抽取,4℃存放)用于检测血药浓度及提取DNA。
1.2.2 VPA血药浓度测定及其标准化[6]采用酶放大免疫分析法(EMIT)检测VPA血药浓度(C0)。计算标准化血药浓度=C0/每日每公斤体质量的服药量,以消除患者体重和服药剂量对血药浓度的影响。
1.2.3 外周血DNA提取 按照百傲外周血DNA提取试剂盒使用说明书进行DNA提取和纯化。
1.2.4 PCR扩增 按照百傲CYP2C19基因检测DNA微阵列芯片法试剂盒说明书,扩增总反应体系为25 μL:CYP2C19扩增液1和扩增液2 19 μL,反应液A 1μL,DNA 模板 5μL。扩增条件:50℃5 min;94℃预变性 5 min;94℃变性25 s,48 ℃退火 40 s,72 ℃延伸 30 s,35 个循环;72℃延伸5 min。扩增产物置4℃冰箱储存待用。
1.2.5 杂交显色 按照百傲CYP2C19基因检测DNA微阵列芯片法试剂盒说明书,准备扩增产物及各管试剂于2 mL离心管中,并将准备好的离心管插入试管架相应位置,放入杂交仪,运行杂交程序。
1.2.6 基因分型结果分析 启动BE2.0生物芯片识读仪扫描芯片,显示出有不同的探针信号差异的基因位点图像,启动上海百傲公司提供的基因芯片图像分析软件(Baio Array Doctor V 2.0)进行图像扫描与数据分析,输出检测结果。根据百傲公司的分型检测说明书的定义,CYP2C19等位基因的野生纯合子型为*1/*1,单突变型为*1/*2和*1/*3,纯合子突变型为*2/*2和*3/*3,双突变杂合子型为*2/*3。此外,将纯合子*1/*1定义为强代谢型(正常代谢型),单突变型*1/*2和*1/*3定义为中间代谢型,双突变型*2/*2,*2/*3和*3/*3定义为弱代谢型。
1.3 统计学处理
按Hardy-Weinberg平衡定律计算各等位基因频率是否符合该定律从而验证数据的可靠性。采用SPSS 19.0软件处理数据,计量资料以(±s)表示,组间比较采用方差分析,计数资料以率表示,不同性别间基因多态性分布的差异分析采用x2检验,P<0.05为差异有统计学意义。
2 结果
2.1 CYP2C19基因型及其分布
各等位基因的频率符合Hardy-Weinberg 平衡定律(x2=0.057,P=0.812),群体基因遗传平衡,数据来自同一孟德尔群体。各种基因型采用生物芯片判读并分类,各种基因型生物芯片识别图见图1。CYP2C19基因型的性别分布和总体分布情况见表1和表2,性别对于CYP2C19基因型的分布差异无统计学意义(P>0.05)。
2.2 CYP2C19代谢型对血药浓度的影响

图1 CYP2C19基因分型生物芯片识别图
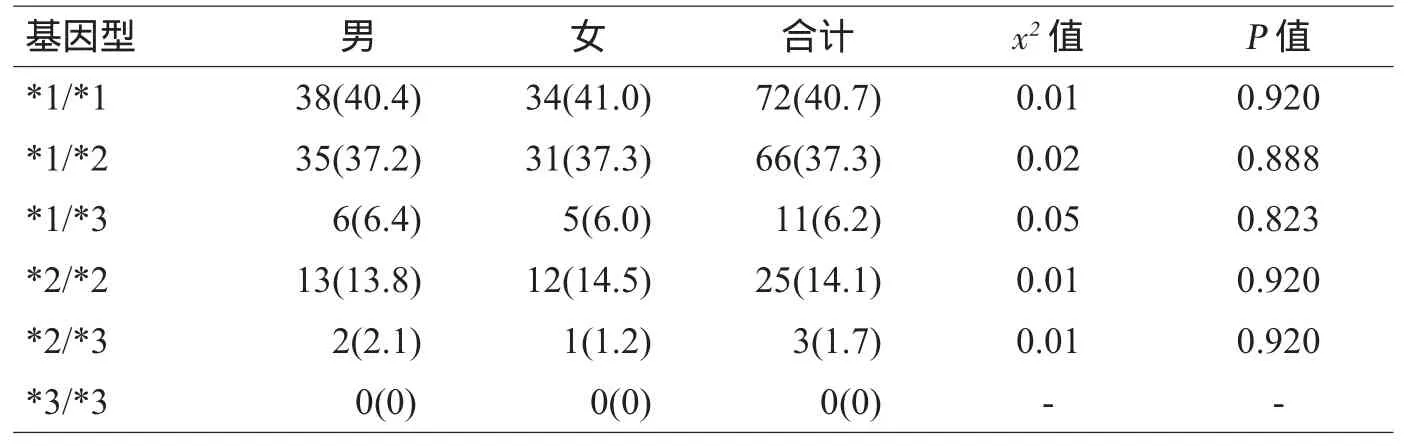
表1 CYP2C19基因型及其在不同性别中的分布[例(%)]
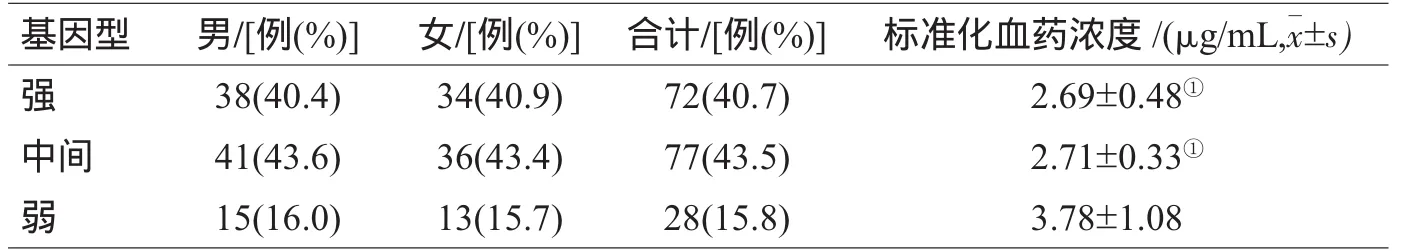
表2 各代谢型基因的频率分布与VPA标准化血药浓度比较
CYP2C19强代谢型和中间代谢型之间标准化血药浓度无显著性差异(P>0.05),弱代谢型标准化血药浓度高于强代谢型和中间代谢型(P<0.05),强代谢型和中间代谢型患者的标准化血药浓度差异无统计学意义(P>0.05),见表2。
3 讨论
癫痫患者需长期甚至终生服用VPA等抗癫痫药物治疗,VPA的体内代谢过程受多种CYP450酶的影响,其中以CYP2C19 为主[7-9]。
本组癫痫患者中,CYP2C19基因的多态性分布与性别差异无显著统计学意义(P>0.05),这与其他报道相似[10],表明在与CYP2C19基因多态性相关的代谢模式与疗效之间,不必过多地考虑性别因素。此外,本研究结果表明具有多态性的中间代谢型和弱代谢型占59.3%,这比其他相关文献报道略高[7,11]。其原因可能与研究对象的选择标准、遗传背景及研究例数等不同有关。本研究表明携带CYP2C19纯合突变(*2/*2、*2/*3)的弱代谢型患者较未突变的强代谢型患者(野生型)的VPA血药浓度高,说明纯合突变患者体内CYP2C19酶的催化作用减弱,VPA代谢减慢,这与文献[7,12]的研究结果基本一致,表明弱代谢型患者VPA的用量应该减少,以便在控制症状的同时减少药物浓度过高导致的不良反应的发生。此外,本研究仅在武汉大学人民医院进行分析,患者均来自武汉地区,且样本量偏小,因此结果存在一定的片面性,尚需进行更大样本的抽样调查。
总之,CYP2C19基因多态性在武汉地区癫痫患者中分布比较普遍,这对于临床实践具有重要的指导意义。因此,我们建议武汉地区的医务工作者使用VPA等相关药物进行抗癫痫治疗时,在允许的条件下尽可能检测CYP2C19基因分型,明确患者遗传药理学特征以调整用药剂量,达到优化个体化用药的目的。
[1]Gu L,Liang B,Chen Q,et al.Prevalence of epilepsy in the People's Republic of China:a systematic review [J].Epilepsy Res,2013,105:195-205.
[2]Wang W,Wu J,Li S,et al.Sodium valproate for epilepsy in rural China:an efficacy and safety assessment in primary care[J].Epilepsy Res,2012,102:201-205.
[3]Kouga T,Shimbo H,Iai M,et al.Effect of CYP2C19 polymorphisms on stiripentol administration in Japanese cases of Dravet syndrome[J].Brain Dev,2015,37:243-249.
[4]Dorado P,López-Torres E,Peñas-Lledó EM,et al.Neurological toxicity after phenytoin infusion in a pediatric patient with epilepsy:influence of CYP2C9,CYP2C19 and ABCB1 genetic polymorphisms[J].Pharmacogenomics J,2013,13:359-361.
[5]StinglJ,VivianiR.Polymorphism in CYP2D6 and CYP2C19,members of the cytochrome P450 mixed-function oxidase system,in the metabolism of psychotropic drugs[J].J Intern Med,2015,277:167-177.
[6]Castberg I,Spigset O.Effects of comedication on the serum levels of aripiprazole:evidence from a routine therapeutic drug monitoring service[J].Pharmacopsychiatry,2007,40:107-110.
[7]王育琴,齐晓涟,黄越,等.丙戊酸药物浓度与CYP2C19基因多态性关系的研究 [J].中国医院药学杂志,2003,23:33-36.
[8]Fleming J,Chetty M.Psychotropic drug interactions with valproate[J].Clin Neuropharmacol,2005,28:96-101.
[9]Goto S,Seo T,Murata T,et al.Population estimation of the effects of cytochrome P450 2C9 and 2C19 polymorphisms on phenobarbital clearance in Japanese[J].Ther Drug Monit,2007,29:118-121.
[10]周建华,苏楠.河南地区汉族人群丙戊酸钠代谢相关基因CYP2C19的多态性分布调查分析 [J].中国实用神经疾病杂志,2013,16:45-47.
[11]白向荣,姜德春,王育琴,等.中国人群癫痫患者CYP2C19、CYP2C9的基因型对丙戊酸清除率影响的研究[J].中国临床药理学与治疗学,2007,12:1405-1410.
[12]廖清船,史菁菁,张永,等.细胞色素P450酶2A6、2B6、2C9及2C19基因多态性对丙戊酸钠血药浓度的影响 [J].中华神经科杂志,2013,46:82-86.
神经损伤与功能重建2015年4期
- 神经损伤与功能重建的其它文章
- 人胶质瘤组织中miR-125b表达研究
- 孤立性眩晕患者不同类型眩晕比较分析
