陆地生态系统甲烷产生和氧化过程的微生物机理
张坚超,徐镱钦,陆雅海
北京大学, 城市与环境学院,北京 100871
陆地生态系统甲烷产生和氧化过程的微生物机理
张坚超,徐镱钦,陆雅海*
北京大学, 城市与环境学院,北京 100871
陆地生态系统存在许多常年性或季节性缺氧环境,如:湿地、水稻土、湖泊沉积物、动物瘤胃、垃圾填埋场和厌氧生物反应器等。每年有大量有机物质进入这些环境,在缺氧条件下发生厌氧分解。甲烷是有机质厌氧分解的最终产物。产生的甲烷气体可通过缺氧-有氧界面释放到大气,产生温室效应,是重要的温室气体。产甲烷过程是缺氧环境中有机质分解的核心环节,而甲烷氧化是缺氧-有氧界面的重要微生物过程。甲烷的产生和氧化过程共同调控大气甲烷浓度,是全球碳循环不可分割的组成部分。对陆地生态系统甲烷产生和氧化过程的微生物机理研究进展进行了概要回顾和综述。主要内容包括:新型产甲烷古菌即第六和第七目产甲烷古菌和嗜冷嗜酸产甲烷古菌的发现;短链脂肪酸中间产物互营氧化过程与直接种间电子传递机制;新型甲烷氧化菌包括厌氧甲烷氧化菌和疣微菌属好氧甲烷氧化菌的发现;甲烷氧化菌生理生态与环境适应的新机制。这些研究进展显著拓展了人们对陆地生态系统甲烷产生和氧化机理的认识和理解。随着新一代土壤微生物研究技术的发展与应用,甲烷产生和氧化微生物研究领域将面临更多机遇和挑战,对未来发展趋势做了展望。
甲烷产生;甲烷氧化;微生物机理;新型产甲烷古菌; 直接种间电子传递
工业革命以来,工农业活动、化石燃料的燃烧及毁林开荒等人类活动造成二氧化碳(CO2)、甲烷(CH4)和氧化亚氮(N2O)等温室气体大量排放,由此引发的全球变化已经成为当今全人类面临的重要环境问题。CH4是重要的温室气体,自工业革命以来,大气CH4浓度增加了近2.5倍,已由工业革命前的715ppb(体积分数)增加至2011年的1803 ppb[1]。20世纪90年代经历了一个近10年的稳定期,但自2007起大气CH4再度迅速增加[1]。单位质量CH4的温室效应是CO2的21倍[2]。目前全球每年的CH4排放量约为500—600 Tg[3]。大气甲烷来源可分为人为源和自然源,其中人为源约占三分之二,主要包括畜牧、稻田、采煤、油气工业、垃圾填埋以及生物质燃烧等;湿地是甲烷排放最主要的自然源。在所有CH4排放源中,约69%的CH4来源于产甲烷古菌的新陈代谢活动[4]。因此,产甲烷古菌是甲烷产生的最重要生物源。
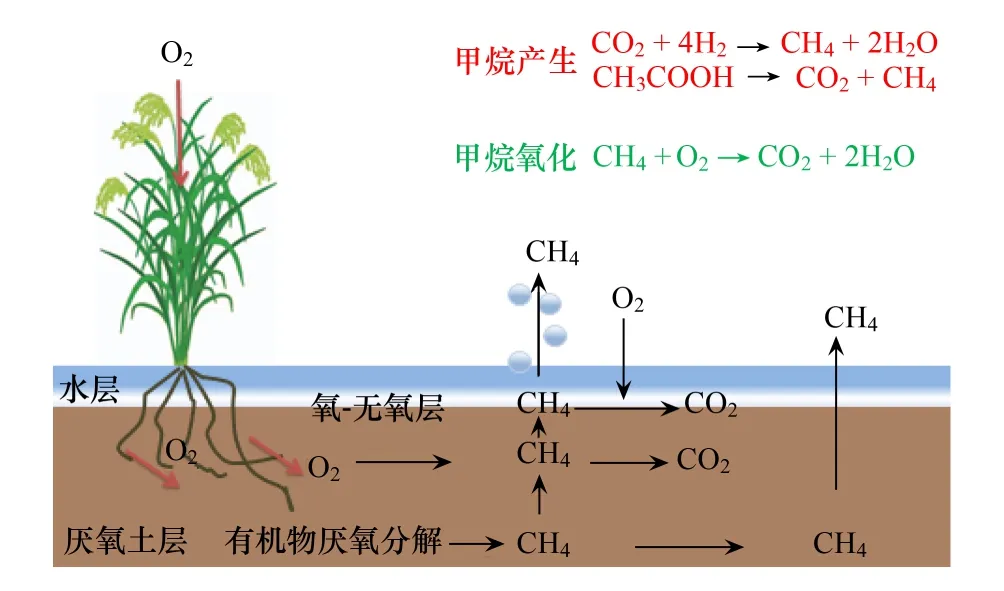
图1 湿地及水稻土系统的甲烷产生及氧化过程 Fig.1 The production and oxidation of methane from wetlands and paddy soils
尽管产甲烷古菌是大气甲烷排放的重要生物源,但陆地生态系统还存在另一类微生物,即甲烷氧化菌,可将甲烷彻底氧化为CO2。甲烷氧化菌在陆地生态系统中广泛分布。在森林、草原等甲烷浓度较低的环境,甲烷氧化菌每年氧化约3千万吨甲烷,是大气甲烷主要的生物汇[5]。而在湿地、水稻土、垃圾填埋场等甲烷浓度较高的环境,甲烷氧化菌每年氧化约相当于这些环境中甲烷产生总量的一半[5]。陆地生态系统向大气排放甲烷取决于土壤中产甲烷古菌和甲烷氧化菌活动的平衡结果(图1)。本文对近年来陆地生态系统中甲烷产生和甲烷氧化研究的若干进展进行综述,并抛砖引玉提出未来研究发展的建议和思考。
1 陆地生态系统甲烷产生的微生物机制
1.1 产甲烷古菌的研究进展
陆地生态系统包括许多自然和人为缺氧环境,如:湿地、水稻田、动物瘤胃、垃圾填埋场、厌氧生物反应器等。进入缺氧环境的有机物质一般经以下步骤进行分解:(1)水解作用,复杂有机物质转变成单糖类物质,并进一步发酵成脂肪酸、CO2和H2;(2)脂肪酸在互营氧化细菌(Syntrophs)的作用下氧化生成乙酸、CO2和H2;(3)乙酸、H2和CO2分别被乙酸型和氢型产甲烷古菌利用产生甲烷[6]。同型产乙酸细菌也可将H2/CO2转变成乙酸,并由乙酸型产甲烷古菌转变成甲烷。由此可见, 有机质厌氧降解由上述的厌氧食物链协同进行,甲烷是厌氧食物链的最终产物,而产甲烷古菌是有机质厌氧降解食物链的末端成员。
产甲烷古菌分布十分广泛,从土壤到湖泊沉积物,从陆地到海洋,从零下低温环境到100℃以上的高温环境[7],遍布地球大部分的缺氧环境,即使在氧气充足的沙漠区域,其土壤生物结皮中也存在活跃产甲烷古菌[8],它们在地球碳素循环中扮演着重要角色。近10多年来,国内外针对产甲烷古菌的多样性和生态功能开展了大量研究,取得了重要进展。
1.1.1 嗜冷嗜酸产甲烷古菌
地球约75%的环境常年平均温度低于5℃[9]。低温产甲烷环境包括高纬度和高海拔的湿地、高山、湖泊沉积物、冰川、永久冻土以及深海沉积物等。在陆地高寒生态系统,由于漫长时期的生物固碳(植物光合固碳)、有机物沉积及其缓慢的生物降解, 土壤中储存了大量有机碳, 在全球碳平衡中起举足轻重的作用。但高寒生态系统对全球变化特别敏感。一方面,全球气候变暖存在区域性差异,高寒区域的气候变暖速度高于全球平均水平,最近2012年的北极变暖速度约是全球平均水平的2倍[10]。另一方面,甲烷排放通量的测定表明,高寒生态系统存在活跃的产甲烷过程,例如:北半球西伯利亚苔原冻土平均每年排放大量甲烷。而我国青藏高原的若尔盖湿地,平均海拔3500m,年平均气温约1℃,年平均甲烷排放量为0.65 —1.0 Tg[11]。
自然环境的产甲烷途径可分为三种,即:利用氢气还原CO2的氢型途径,通过乙酸裂解的乙酸型途径和利用甲基类化合物的甲基型途径。Kotsyurbenko等[12]研究发现, 在低温和底物浓度较高条件下,甲烷主要来源于乙酸裂解途径。GroßKopf等[13]证明低温和高温条件下主要产甲烷古菌类型和产甲烷途径发生明显变化:低温条件下以乙酸型的甲烷鬃菌占主导,而高温下则以能利用H2/CO2的甲烷胞菌和甲烷八叠球菌为主。这表明,温度在一定程度上影响产甲烷古菌的群落结构和代谢途径。其原因可能与低温条件下氢气积累促进了同型产乙酸菌生长,同型产乙酸菌与氢型产甲烷古菌竞争,将H2/CO2转变成乙酸;而在高温或中温条件下,氢型产甲烷古菌比同型产乙酸菌具有更大的热力学优势,使氢型产甲烷途径渐渐占主导地位[3]。
根据产甲烷古菌的最适生长温度,产甲烷古菌可分为嗜热菌(最适温度55℃左右)、极端嗜热菌(最适温度高于80℃)、嗜温菌(最适温度在35℃左右)和嗜冷菌(最适温度低于25℃)。目前产甲烷古菌纯培养的研究多数集中在中温和高温菌,对嗜冷产甲烷古菌的研究十分稀少[3]。但近年来国内外学者已从南极和高寒湿地等区域分离培养了若干嗜冷产甲烷古菌。如美国学者从南极冰湖分离获得两株嗜冷产甲烷古菌,其中Methanogeniumfrigidum的最适生长温度在15℃,倍增时间为2.9d,超过20℃不能生长[14],而Methanococcoidesburtonii的最适生长温度为23℃,高于28℃不能生长[15]。我国学者从青藏高原若尔盖湿地分离获得了1株嗜冷产甲烷古菌Methanolobuspsychrophilus,其最适生长温度为18℃,在此条件下,甲醇转化的Km和Vmax值可达(87.5±0.4) μmol/L和(0.39±0.04) Mm/h,转化效率非常高,但高于25℃不能生长[16]。为了理解嗜冷产甲烷古菌对环境的适应机理,上述菌株的基因组和转录组都已进行了测序分析。M.burtonii的比较转录组分析表明,在冷胁迫条件下,其RNA结合蛋白呈现上调,使RNA数量能维持在适合翻译的水平,另有一些基因的转录发生变化,预计可导致细胞表面发生重构,有助于适应冷胁迫条件[17]。有意思的是M.burtonii对冷胁迫响应最强烈的10个转录子中有7个为未知功能的编码基因[18]。这暗示M.burtonii可能利用新的冷适应机制。
高纬度和高海拔的沼泽和泥炭湿地,不仅常年低温,而且由于有机质的积累,其土壤多呈酸性条件。大多数产甲烷古菌生长的pH范围比较窄,接近中性,在pH6.0—8.0之间。但也有一些嗜酸产甲烷古菌,例如Kuzneceorii在早期的研究中发现一株产甲烷古菌,可在pH4.0条件下生长[19]。Maestrojuan和Boone[20]发现一些甲烷八叠球菌可在pH4.5生长。而Patel等[21]获得一株甲烷杆菌纯培养(Methanobacteriumespanolae)其最适pH为5.5—6.0。美国学者从酸性泥炭沼泽分离获得了Methanoregulaboonei(菌株 6A8T),其生长的最适pH为4.0—4.5 之间[22]。这为研究理解酸性泥炭沼泽的中嗜酸产甲烷的机理提供重要生物材料。
1.1.2 第六产甲烷古菌目的发现
产甲烷古菌在分类上属于广域古菌门,在1998年之前,学术界确认由5个分类目组成,分别为甲烷火球菌目(Methanopyrales)、甲烷球菌目(Methanococcales)、甲烷杆菌目(Methanobacteriales)、甲烷微菌目(Methanomicrobiales)和甲烷八叠球菌目(Methanosarcinales)。关于产甲烷古菌目的介绍可见表1。1998年,德国科学家通过16S rRNA基因片段分析,首次在意大利水稻土中发现了一类新的产甲烷古菌[23],并将其命名为RC-I古菌。通过系统发育和亲缘关系分析,发现RC-I古菌是位于甲烷八叠球菌目和甲烷微菌目之间的深度分枝[13]。随后进一步研究发现RC-I含有产甲烷途径中起关键作用的甲基辅酶M还原酶基因(mcrA)[24]。基于16S rRNA和mcrA基因的大量研究表明RC-I在环境中广泛分布,遍布全球不同陆地和沿海的生态系统。尤其是世界各地的水稻田是RC-I的主要栖居地之一。对水稻土中古菌群落的分子分析表明,每克水稻土中(干重)约有106—107个RC-I细胞,占总产甲烷古菌数量的20%—50%[25]。研究发现,与其他产甲烷古菌相比,RC-I更能适应低氢浓度条件[26];在45—50℃的高温条件下,RC-I往往占据绝对优势[27]。应用元基因组学(Metagenomics)方法的研究发现RC-I还含有一系列编码抗氧化胁迫的基因,以及利用碳水化合物的基因[28]。对mcrA基因在稻麦轮作土壤中的表达进行动态跟踪后,发现RC-I在排水、低温、有氧的条件下能够保持相对较高的基因表达水平[29]。RC-I古菌适应低氢、抗氧化以及利用有机物的特性使RC-I在水稻土中具备独特的选择性优势。
基于稳定同位探针技术(SIP)的研究证实水稻根际的RC-I在甲烷形成过程中起关键作用[30]。进一步研究发现在水稻根际土壤,RC-I比其他氢型甲烷菌具有更高的细胞密度和甲烷产量[31]。脂肪酸的互营氧化是厌氧有机质降解的关键步骤,利用稳定同位素探针技术研究发现,RC-I在水稻土中乙酸、丙酸和丁酸的互营降解中都起关键作用,证实RC-I具有适应低氢条件的能力[27,32]。通过研究氧气和硝酸盐对水稻土产甲烷菌群落的胁迫影响,证实了RC-I在水稻田中具有抗氧优势[27,33-34]。这一系列研究表明RC-I在水稻土甲烷产生过程中可能起关键作用。
但是,尽管分子生态学的研究极大的丰富了人们对RC-I的认识,由于一直缺乏纯培养物,使研究人员无法对RC-I进行更为直接和深入的生理生态机制研究。直到2007年,日本研究人员通过利用互营共培养的方法,从水稻土获得了首个RC-I的纯培养物,即菌株SANAE[35]。他们采用不同指标对SANAE进行鉴定,确定其为产甲烷古菌的新种,命名为Methanocellapaludicola,并进一步确定其代表一个新目,即:甲烷胞菌目(Methanocellales)。2010年第二株纯菌MethanocellaarvoryzaeMRE50被成功分离[36]。经过数年努力,本文作者的实验室于2012年从中国水稻土获得了第三株纯菌,命名为MethanocellaconradiiHZ254[37]。与前两株纯菌相比,HZ254菌株具有生长快速、易培养的特性,为深入研究甲烷胞菌的生理生化机制提供了良好的实验材料。至此,三株纯菌的分离培养确认了第六目产甲烷古菌的分类地位。目前,三个甲烷胞菌菌株的基因组已全部测序[38],其基因组、转录组和一系列生理生化的研究为深入理解甲烷胞菌目的生态功能提供了理论基础。
1.1.3 第七产甲烷古菌目的发现
土壤生态系统栖息着不同类型的动物,包括小型动物如白蚁、蚯蚓等,它们在土壤有机物质分解和转化过程中起非常重要的作用。白蚁属于节肢动物,主要分布在热带和亚热带地区,以木材或纤维素为食。大量基于16S rRNA和mcrA分析的研究表明,白蚁肠道存在一类新型古菌,其系统发育关系与热原体目(Thermoplasmatales)比较接近[39]。追溯Genebank中相关的16S rRNA基因发现,这类古菌可能在深海沉积物、水稻土、湖泊水体和沉积物、垃圾填埋场和厌氧反应器等中广泛存在。不仅如此,这类古菌在瘤胃和哺乳动物肠道中经常表现为优势菌群。Mihajlovski等[40]最早在人类肠道排泄物中探测到这类古菌,确定为产甲烷古菌,并指出它们代表产甲烷古菌的一个新目。Wright等[41]也发现它们是牛瘤胃的主要产甲烷古菌。这些研究一定程度上反映了这类新型产甲烷古菌的广泛分布及潜在功能。
2012年,Dridi等[42]从人类粪便中分离获得了第一个纯培养物,命名为Methanomassiliicoccusluminyensis,并正式提出第七产甲烷古菌目,即:Methanomassiliicoccales。目前,除这株纯菌外,研究人员还从白蚁[39],人类肠道[43]及厌氧反应器[44]中获得了高度富集的第七产甲烷古菌目的培养物。纯菌及这些富集培养物的基因组和生理生化实验表明,它们属于甲基型产甲烷古菌,但拥有着独特的代谢特性。和一般的专性甲基型产甲烷古菌不同,它们缺少将CO2还原为甲基辅酶M的完整路径[45],因此这类菌需要额外添加氢气才能生长。基因组分析表明,它们含有一些基因,可利用H2还原甲醇、甲胺、二甲胺等底物。生理实验[46]进一步证实M.luminyensis在H2存在条件下才能利用甲胺类物质(甲胺,二甲胺,三甲胺)进行生长。
因此,从营养角度看,第七产甲烷古菌目既不是典型甲基型产甲烷古菌,也不是氢型产甲烷古菌,属于两者的混合营养型。
尽管在水稻土、湿地和湖泊沉积物等自然环境中经常探测到与第七产甲烷古菌目十分相似的16S rRNA基因片段,但它们是否在这些环境的甲烷产生和排放中起重要作用,目前尚不清楚。但在草原反刍动物和热带亚热带森林土壤的白蚁肠道,这类产甲烷古菌的功能已越来越受到人们的关注。
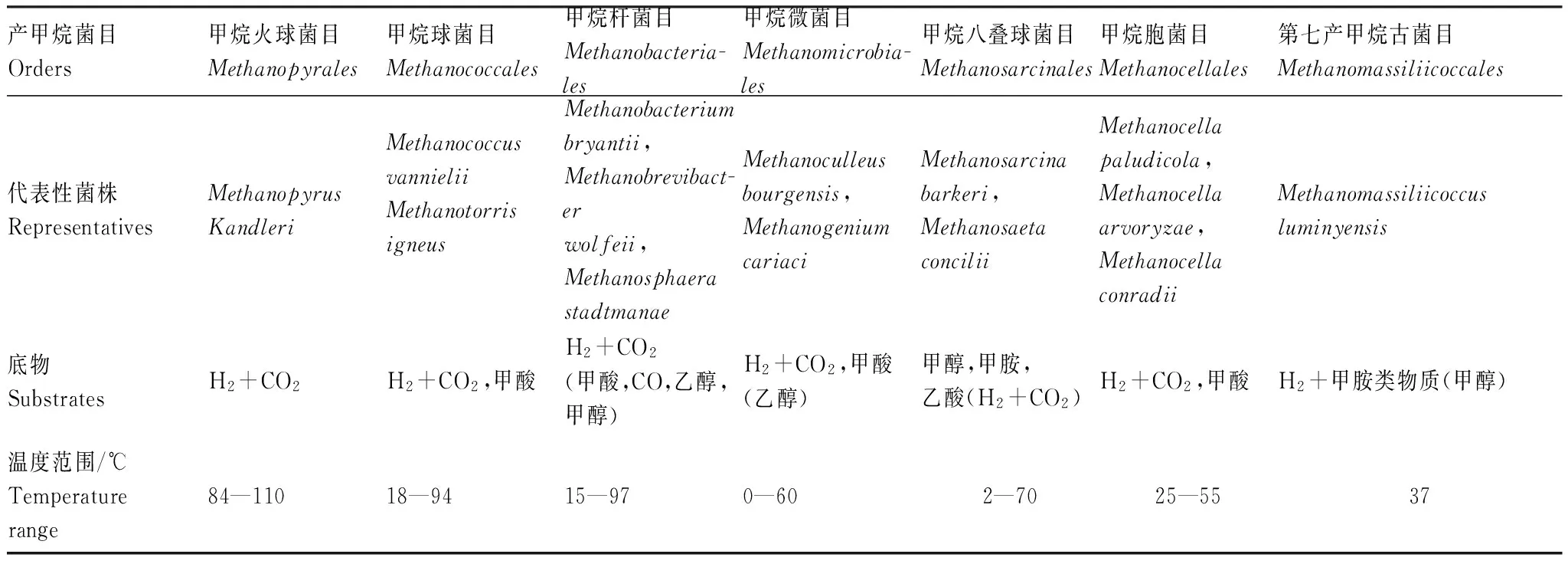
表1 产甲烷古菌目特征介绍
1.2 互营产甲烷过程研究进展
在水稻土和湿地环境,有机物质的厌氧降解主要包括水解、产酸和产甲烷三个过程,涉及初级发酵菌,次级发酵菌,同型产乙酸菌,氢型和乙酸型产甲烷古菌五类功能微生物[47]。互营产甲烷是整个过程中非常关键的环节。互营是一种特殊的共生关系,能够使两种不同代谢类型的微生物所释放的有限能量得到最大限度的利用,有着重要的微生物生态学意义。互营关系的建立及相互作用方式一直是国内外研究关注的焦点,尤其体现在种间电子的传递机制上[48]。它不仅决定了有机物质降解产甲烷过程的效率,还是产甲烷古菌与互营菌克服热力学壁垒维持生长的关键环节[48-49]。
1.2.1 种间氢/甲酸传递
在大多数互营产甲烷环境中,H2扮演了非常重要的角色。不仅分子量小、容易扩散,而且产甲烷古菌和细菌体内还富含各种氢酶和脱氢酶,H2的形成和氧化需要这些酶的作用[50-51]。互营产甲烷过程的种间H2转移电子传递过程如图2a所示。胞内常见的氧化还原介质有NADH、FADH2和Ferredoxins(Fd)等。这些介质的氧化和质子还原的能量问题是互营产甲烷途径的关键[52]。H+/H2氧化还原电位较低(E0′=-414mV),NAD+/NADH和FADH/FADH2的氧化还原电位分别为-320mV和-220mV,而Fd(ox)/Fd(red)维持在-398mV或更低。在标准状态下,上述氧化还原介质难以作为电子供体还原H+形成H2,但如果能降低H2分压直至低于1Pa时,各反应的自由能可发生显著变化,有的从吸热反应转变为放热反应。这就表明,在互营产甲烷过程中,必须使H2分压维持在很低的水平。在产甲烷古菌与互营氧化菌的互营体系中,互营氧化菌能够通过膜结合的甲酸脱氢酶将甲酸裂解产生H2,而产甲烷古菌不断消耗H2维持自身生长,H2能够依赖氧化还原介质在种间发生传递从而降低整个反应体系的H2分压,最终使反应自发进行实现质子的还原和能量的转化。产甲烷古菌大多利用H2还原CO2,菌体内细胞色素的存在与否,对临界H2分压有一定的影响[53],例如,不含细胞色素的产甲烷古菌能够使H2维持在更低的水平,在互营作用中起关键作用。
然而H2并非是电子传递的唯一载体,甲酸已被预测为是另一种电子穿梭体[54]。甲酸不仅可以产生H2,直接参与CH4的生成,而且甲酸/CO2的氧化还原电位(-432 mV)与H+/H2的(-432 mV)相同。目前种间H2或甲酸转移两种途径谁占主导并没有定论。在不同自然或人工环境中,它们对互营产甲烷过程的相对贡献可能有所不同,迅速发展的基因组和转录组学技术将有利于开展这方面的深入研究。
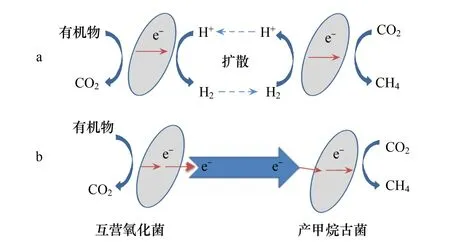
图2 互营产甲烷过程H2载体电子传递及直接种间电子传递示意图Fig.2 Schematic diagrams of H2 mediated electron transfer and direct interspecies electron transfer in syntrophic-methanogenic associations
1.2.2 直接种间电子传递
直接种间电子传递(DIET)是近年来研究发现互营产甲烷过程中存在的新型电子传递机制。早在20世纪80年代,Lovley等[55-56]证明了电子受体Fe(Ⅲ)能够接受微生物释放至胞外的电子并产生超细粒磁铁矿,开启了研究胞外直接电子转移(Direct extracellular electron transfer, DEET)的先河。此后,有大量文献对DEET的形成机制进行报道[57]。DEET指微生物将胞内产生的电子转移到胞外供电子受体接受发生反应。常见的电子受体包括Fe(Ⅲ)、Mn(Ⅳ)、腐殖质等不可溶物质,部分微生物可利用电极或另一类微生物细胞。我们把以微生物为电子受体的胞外直接电子转移(DEET)称为直接种间电子传递(DIET)。DIET和DEET最大的不同之处在于电子受体为微生物体内存在或分泌的细胞物质[55]。DIET如图2b所示。有关DIET的证据最早在地杆菌的共培养中发现[58]。两株地杆菌在以乙醇为底物的共培养条件下能够形成直径1—2 mm、导电的二菌团聚体(dual-species aggregates),在排除种间氢转移的情况下,研究者推测二菌团聚体发生了种间直接电子传递。Morita等[59]在生物反应器的产甲烷过程中发现了类似现象,发现从上流式厌氧污泥床反应器提取的微生物团聚体导电性是上述地杆菌团聚体的三倍,并且该体系无法实现氢转移途径,表明DIET是互营产甲烷过程的另一种重要机制。
目前,DIET的机制主要包括以下几种。一是通过细胞膜上的细胞色素c介导将电子传递给受体,Summers等[58]证实地杆菌之间具有导电性的团聚体是依靠地杆菌细胞膜上的细胞色素c形成的。而且通过基因敲除的方法发现[57],地杆菌在细胞色素c含量较低时无法进行胞外电子传递,进一步说明细胞色素c的重要性。二是通过菌毛(Pili)等细胞附属物[60]实现胞外电子传递,菌毛具有很强的导电性。Malvankar等[61]发现菌毛蛋白能够作为分子导线实现电子传递。三是主要借助自身所分泌的吩嗪类色素(Phenazine)[62]、核黄素(Flavin)[63]和醌类(Quinones)[64]等氧化还原电子穿梭体实现电子传递。此外,研究表明粒状活性炭[65]、(半)导体铁氧化物[66]、生物炭[67]等材料对DIET有极大的促进作用。
最近,本文作者的实验室利用富集培养的方法对水稻土壤中丁酸互营氧化产甲烷过程进行了研究[68]。结果发现在富集培养体系中添加纳米磁铁矿显著促进了产甲烷过程,而如果使磁铁矿外表包裹一层SiO2进行绝缘处理,其对产甲烷过程的促进作用随即消失,这表明纳米磁铁矿的导电性起了重要作用。进一步用纳米石墨颗粒替代纳米磁铁矿,发现同样能对产甲烷过程起促进作用。扫描电镜观察显示纳米颗粒紧密附着在不同形态的细胞表面,将不同细胞联接起来。这些结果首次表明种间直接电子传递可能在丁酸互营氧化过程中起重要作用。该发现具有重要实际意义,因为在土壤和沉积物等自然环境广泛分布着导电性纳米矿物,如磁铁矿和黄铁矿等。过去很多这些环境的研究忽略了无机矿物可能引起的特殊生态作用。
2 陆地生态系统甲烷氧化的微生物机理
甲烷氧化菌是一类独特的微生物,广泛分布在不同环境,它们能将甲烷彻底氧化成CO2和水,是地球系统甲烷排放的天然消减器。最近20年来,针对不同生态系统甲烷氧化菌的研究取得了显著进展。
好氧甲烷氧化菌传统上都属于变形细菌门(Proteobacteria),根据细胞的内膜结构、磷脂脂肪酸成分和碳同化途径等可将好氧甲烷氧化菌分成Ⅰ型菌和Ⅱ型菌。Ⅰ型菌属γ-变形细菌,利用5-磷酸核酮糖同化途径(RuMP),包括甲基杆菌(Methylobacter)、甲基球菌(Methylococcus)、甲基单胞菌(Methylomonas)、甲基微菌(Methylomicrobium)和甲基八叠球菌(Methylosarcina)等12属;Ⅱ型菌属α-变形细菌,利用丝氨酸(Serine)同化途径,包括甲基弯曲菌(Methylosinus)和甲基孢囊菌(Methylocystis)等4属[69-70]。Ⅰ型菌可进一步分成Ⅰa亚型和Ⅰb亚型,Ⅰb亚型菌(Methylococcus和Methylocaldum)同时拥有RuMP和丝氨酸途径,因此兼有Ⅰ型菌和Ⅱ型菌的碳同化特征。
2.1 新型甲烷氧化菌
2.1.1 厌氧甲烷氧化过程
近年来,甲烷氧化菌研究的重要进展之一是厌氧甲烷氧化菌的发现。鉴于甲烷的化学稳定性,长期以来,科学家认为环境中不可能存在无氧参与的甲烷氧化。但是生物地球化学方面的证据不断显示深海沉积物中可能存在厌氧甲烷氧化过程[71]。美国微生物学家DeLong领导的研究小组利用稳定同位素探针技术,首次发现古菌可能催化了海底沉积物的厌氧甲烷氧化[72],随后他们采用次级离子质谱技术(SIMS)证实厌氧甲烷氧化依靠一类由硫酸盐还原菌和未培养古菌(ANME)组成的互营复合体[73]。通过元基因组学(Metagenomics)分析,该小组最终发现厌氧甲烷氧化实际上是产甲烷过程的逆向代谢过程[74]。最近,德国学者发现未培养古菌ANME-2实际上具备独立完成硫酸盐还原和甲烷氧化两个过程的能力[75]。厌氧甲烷氧化的另一个重大突破是发现淡水沉积物中存在依赖于反硝化过程的厌氧甲烷氧化[76]。根据热力学原理,与反硝化耦合的厌氧甲烷氧化比与硫酸盐还原耦合的甲烷氧化更具有热力学优势。因此,研究者推测在淡水沉积物中可能存在依赖于反硝化过程的厌氧甲烷氧化。荷兰学者最早获得了反硝化甲烷氧化富集物,并通过环境转录组研究发现,反硝化甲烷氧化菌实际上拥有一套完整的好氧甲烷氧化途径,并拥有一套除N2O还原酶以外的所有反硝化基因[77]。据此,他们推测反硝化甲烷氧化菌同时执行了反硝化和好氧甲烷氧化两个过程,表明环境中可能存在一条全新的甲烷氧化途径。
2.1.2 疣微菌纲甲烷氧化菌
近年来甲烷氧化菌研究的另一重要突破是发现了属于疣微菌纲 (Verrucomicrobia)的好氧甲烷氧化菌。疣微菌广泛分布在好氧和厌氧环境中,包括水稻土和湖泊沉积物。但目前分离培养的纯菌十分罕见。2007至2008年,国际上三个独立研究小组分别从富含甲烷的地热环境(温泉等)分离纯化了能进行好氧甲烷氧化的疣微菌[78-80],这是研究者首次发现不属于变形细菌的好氧甲烷氧化菌。疣微菌的分类地位如图3所示。尽管地域起源不同,三株疣微菌的16S rRNA基因相似度高达98%以上,因此被归为同一个新属,命名为甲基嗜酸菌(Methylacidiphilum)[81]。这些氧化菌具有嗜热和极端嗜酸特点,缺乏好氧甲烷氧化菌特有的皱褶内膜结构,但基因组含有三个完整的pmoCAB操纵子以及一个单独的pmoC拷贝。甲烷氧化疣微菌的发现显著拓宽了对好氧甲烷氧化菌多样性的认识,但这类氧化菌是否在水稻土和其它生境中存在并具有氧化功能目前还不清楚。用磷脂脂肪酸稳定同位素标记的研究显示,在垃圾填埋土中一些在变形细菌中不常见的脂肪酸信号分子如i14:0磷脂脂肪酸受到同位素标记[82],在水稻根际的研究中也发现类似现象[83],这些研究可能预示甲烷氧化疣微菌在非极端环境的生态功能。
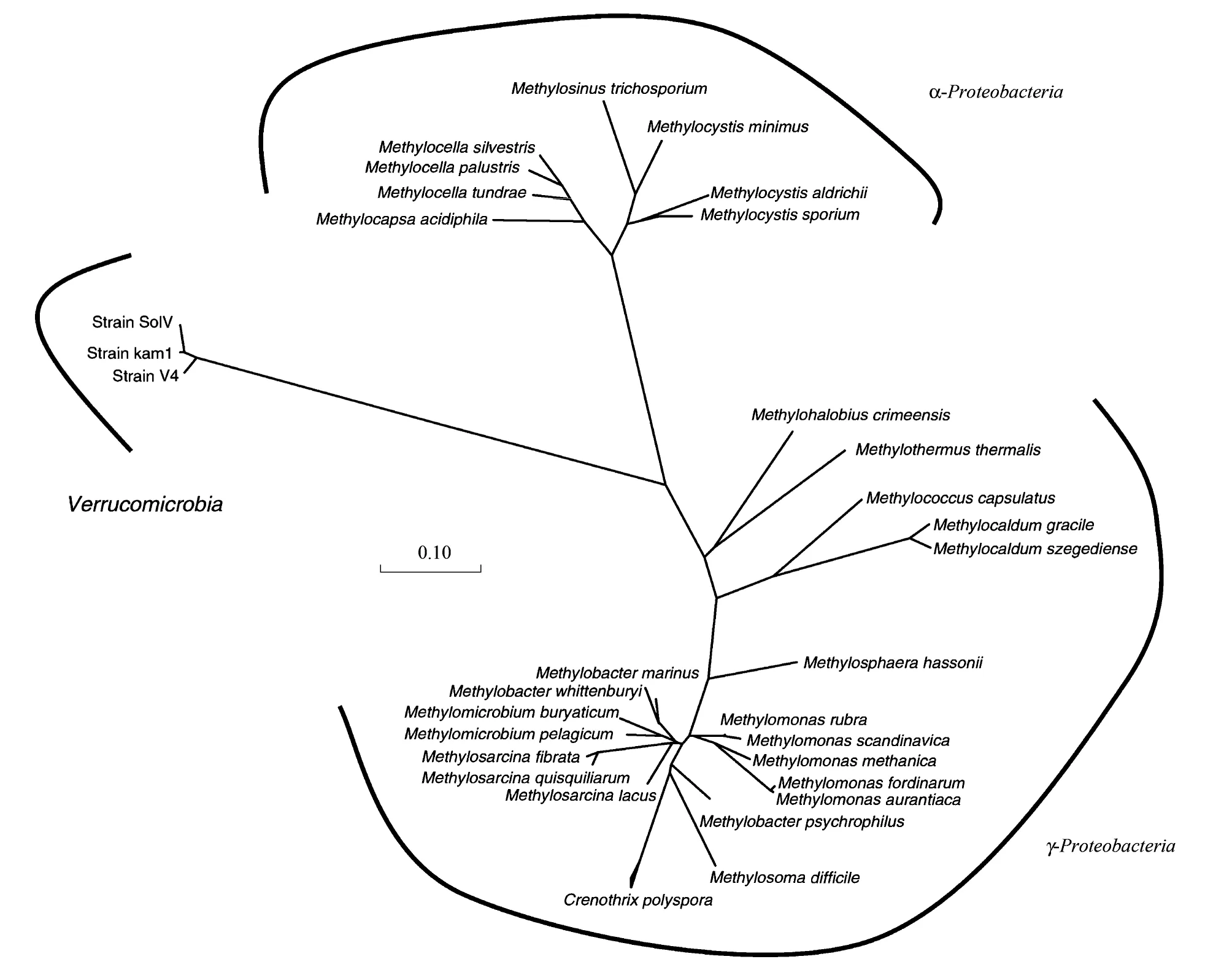
图3 甲烷氧化菌分类[84]Fig.3 16S rRNA gene phylogeny of the obligate aerobic methane oxidizing bacteria[84]
2.2 甲烷氧化菌的生理生态特征
2.2.1 高亲和力甲烷单加氧酶
甲烷氧化在许多环境都能发生,即使在甲烷浓度很低的森林土和旱地土(大气甲烷浓度)也能检测到活跃的甲烷氧化过程。但至今为止纯培养研究无法解释大气甲烷浓度下的甲烷氧化。最近,基因组研究揭示有些甲烷氧化菌实际上拥有两套pmo基因即pmoCAB1和pmoCAB2,其基因序列差异可达70%以上[85]。以上提到的甲烷氧化疣微菌即拥有两套pmo基因。两套同工酶基因的存在暗示甲烷单加氧酶对甲烷的亲和力可能存在差异,德国学者的研究证实了这一假设[86]。他们发现甲烷氧化菌pmoCAB1只在甲烷浓度大于600μL/L时才起作用(低亲和力),而pmoCAB2能在甲烷浓度小于10 μL/L条件下保持活性(高亲和力)。过去大量生态生理的研究忽略了pmoCAB2的功能。显然,甲烷氧化菌如果拥有两套不同亲和力的酶,则它们的环境适应能力将显著提高。对纯菌分析表明大部分Ⅱ型菌拥有两套pmo基因,而Ⅰ型菌往往只有pmoCAB1。这种差异可能影响它们在土壤生态系统的群落结构和功能。
2.2.2 乙酸代谢能力
长期以来,学术界认为甲烷氧化菌是严格的C1利用者(甲烷和甲醇等),不可能利用多碳化合物如乙酸。但最近有人发现了两个新的甲烷氧化菌(Methylocella和Methylocapsa),能利用乙酸作为独立的碳源和能源。进一步研究发现在湿地土壤中广泛存在的甲基孢囊菌属(Methylocystis)具有乙酸利用能力,且在甲烷存在时,乙酸利用效率更高[87]。甲烷氧化菌的乙酸利用能力具有重要生态学意义,因为在湿地和水稻土,乙酸是有机质降解的主要中间产物,而这些环境中甲烷生产通常呈现明显的季节性变化,乙酸利用能力可使这些甲烷氧化菌具有更强的生存适应能力。
2.2.3 厌氧发酵作用
除乙酸利用能力外,一些甲烷氧化菌还可能拥有更为复杂的厌氧代谢能力,最近有研究表明在低氧(5%—10% O2)条件下,甲基孢囊菌能利用甲烷在胞内合成羟基丁酸聚合物(PHB)。当环境条件由低氧变成无氧时,甲烷氧化菌能用PHB进行厌氧发酵[88],供生存需要。另外,厌氧发酵产生的发酵产物包括乙酸、丙酮和琥珀酸可释放到环境,供其它微生物利用,形成由甲烷驱动的食物链[89]。PHB是许多细菌抵御不良环境的能量储备物质,拥有PHB代谢能力将使甲烷氧化菌更能适应有氧与无氧交替变化的环境。
另外,作者实验室的研究发现Ⅰ型氧化菌主要分布在水稻的根际和表层土,而Ⅱ型菌则在下层无氧区域占优势[90]。不少研究也表明Ⅱ型菌更能适应低氧环境[91]。但是,这些生态分布特点是否与Ⅱ型菌的厌氧代谢有关,有待进一步研究。
3 展望
甲烷产生和氧化是陆地生态系统碳循环的重要环节。纵观过去20年来国内外对甲烷产生和氧化过程及其微生物的研究,可以看出,为了理解不同环境中甲烷产生和氧化过程的机制,并探索起关键作用的微生物种类和生理生态功能,研究工作已经取得了许多突破性进展,发现了一系列新型产甲烷古菌和甲烷氧化菌,揭示了特殊生理生态机制。这些创新突破十分依赖于关键科学问题的牵引、研究方法与技术的发展以及多学科交叉发展的推动。未来研究的科学问题如下:
第一,甲烷产生和氧化微生物适应环境变化的机理和理论。微生物不断改变环境,并受到变化环境的影响不断适应环境。微生物对环境变化的适应机理是土壤微生物学的基本科学命题,但目前尚未形成相关理论体系。过去大量研究探索了环境因子对甲烷产生和氧化微生物群落结构和功能的影响,但大部分工作停留在群落水平,在分子和细胞水平的研究相对缺乏。如何从分子和细胞水平通过尺度放大,探究甲烷产生和氧化微生物与环境之间的相互作用关系,揭示对环境变化的适应机理,将是未来相关研究的重要挑战。
第二,甲烷产生和氧化微生物的新型菌群和代谢途径。大量环境微生物学的研究表明,目前已知的微生物种类不足实际存在的1%。这暗示环境中可能仍存在大量未知的甲烷产生和氧化微生物。新型微生物种类极有可能拥有新的代谢途径,包括全新的甲烷产生和氧化途径以及微生物种间相互作用关系。过去的研究进展已经证明这一观点。无疑,新型菌种及新途径的发现将继续成为未来研究的焦点。
第三,研究方法的创新发展和学科交叉。近年来,一系列新的研究方法和技术,包括:环境基因组和转录组学分析及其与SIP技术的结合、单细胞分离培养和测序技术、NanoSIMS技术(高分辨率二级离子质谱)、电化学研究方法和超分辨率荧光显微镜技术等正在迅速发展。这些方法技术的发展与应用,无疑将推动甲烷产生和甲烷氧化微生物的研究取得更多创新与发展。
[1] IPCC. Climate Change 2013: The Physical Science Basis//Stocker T F, Qin D, Plattner G K, Tignor M, Allen S K, Boschung J, Nauels A, Xia Y, Bex V, Midgley P M, eds. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge, United Kingdom and New York, NY, USA: Cambridge University Press, 2013: 1-1535.
[2] Manne A S, Richels R G. An alternative approach to establishing trade-offs among greenhouse gases. Nature, 2001, 410(6829): 675-677.
[3] 蒋娜, 陈紫娟, 曹轶, 田建卿, 王艳芬, 东秀珠. 低温湿地甲烷古菌及其介导的甲烷产生途径. 微生物学通报, 2013, 40(1): 137-145.
[4] Conrad R. The global methane cycle: recent advances in understanding the microbial processes involved. Environmental Microbiology Reports, 2009, 1(5): 285-292.
[5] Thauer R K. Functionalization of methane in anaerobic microorganisms. Angewandte Chemie International Edition, 2010, 49(38): 6712-6713.
[6] Conrad R. Contribution of hydrogen to methane production and control of hydrogen concentrations in methanogenic soils and sediments. FEMS Microbiology Ecology, 1999, 28(3): 193-202.
[7] Huber R, Kurr M, Jannasch H W, Stetter K O. A novel group of abyssal methanogenic archaebacteria (Methanopyrus) growing at 110 °C. Nature, 1989, 342(6251): 833-834.
[8] Angel R, Matthies D, Conrad R. Activation of methanogenesis in arid biological soil crusts despite the presence of oxygen. PLoS One, 2011, 6(5): e20453.
[9] Akila G, Chandra T S. Performance of an UASB reactor treating synthetic wastewater at low-temperature using cold-adapted seed slurry. Process Biochemistry, 2007, 42(3): 466-471.
[10] IPCC. Climate Change 2014: Mitigation of Climate Change//Edenhofer O, Pichs-Madruga R, Sokona Y, Minx J C, Farahani E, Kadner S, Seyboth K, Adler A, Baum I, Brunner S, Eickemeier P, Kriemann B, Savolainen J, Schlömer S, Von Stechow C, Zwickel T, eds. Contribution of Working Group Ⅲ to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. United Kingdom and New York, NY, USA: Cambridge University Press, Cambridge, 2014.
[11] Ding W X, Cai Z C, Wang D X. Preliminary budget of methane emissions from natural wetlands in China. Atmospheric Environment, 2004, 38(5): 751-759.
[12] Kotsyurbenko O R, Nozhevnikova A N, Zavarzin G A. Methanogenic degradation of organic matter by anaerobic bacteria at low temperature. Chemosphere, 1993, 27(9): 1745-1761.
[13] Großkopf R, Janssen P H, Liesack W. Diversity and structure of the methanogenic community in anoxic rice paddy soil microcosms as examined by cultivation and direct 16S rRNA gene sequence retrieval. Applied and Environmental Microbiology, 1998, 64(3): 960-969.
[14] Franzmann P D, Liu Y T, Balkwill D L, Aldrich H C, Conway De Macario E, Boone D R.Methanogeniumfrigidumsp. nov., a psychrophilic, H2-using methanogen from Ace Lake, Antarctica. International Journal of Systematic and Evolutionary Microbiology, 1997, 47(4): 1068-1072.
[15] Franzmann P D, Springer N, Ludwig W, Conway De Macario E, Rohde M. A methanogenic archaeon from Ace Lake, Antarctica:Methanococcoidesburtoniisp. nov. Systematic and Applied Microbiology, 1992, 15(4): 573-581.
[16] Zhang G S, Jiang N, Liu X L, Dong X Z. Methanogenesis from methanol at low temperatures by a novel psychrophilic methanogen, “Methanolobuspsychrophilus” sp. nov., prevalent in Zoige wetland of the Tibetan Plateau. Applied and Environmental Microbiology, 2008, 74(19): 6114-6120.
[17] Williams T J, Lauro F M, Ertan H, Burg D W, Poljak A, Raftery M J, Cavicchioli R. Defining the response of a microorganism to temperatures that span its complete growth temperature range (-2℃ to 28℃) using multiplex quantitative proteomics. Environmental Microbiology, 2011, 13(8): 2186-2203.
[18] Campanaro S, Williams T J, Burg D W, De Francisci D, Treu L, Lauro F M, Cavicchioli R. Temperature-dependent global gene expression in the Antarctic archaeonMethanococcoidesburtonii. Environmental Microbiology, 2011, 13(8): 2018-2038.
[19] Williams R T, Crawford R L. Methanogenic bacteria, including an acid-tolerant strain, from peatlands. Applied and Environmental Microbiology, 1985, 50(6): 1542-1544.
[20] Maestrojuán G M, Boone D R. Characterization ofMethanosarcinabarkeriMSTand 227,MethanosarcinamazeiS-6T, andMethanosarcinavacuolataZ-761T. International Journal of Systematic Bacteriology, 1991, 41(2): 267-274.
[21] Patel G, Sprott G D, Fein J E. Isolation and characterization ofMethanobacteriumespanolaesp. nov., a mesophilic, moderately acidiphilic methanogen. International Journal of Systematic Bacteriology, 1990, 40(1): 12-18.
[22] Bräuer S L, Cadillo-Quiroz H, Yashiro E, Yavitt J B, Zinder S H. Isolation of a novel acidiphilic methanogen from an acidic peat bog. Nature, 2006, 442(7099): 192-194.
[23] Großkopf R, Stubner S, Liesack W. Novel euryarchaeotal lineages detected on rice roots and in the anoxic bulk soil of flooded rice microcosms. Applied and Environmental Microbiology, 1998, 64(12): 4983-4989.
[24] Lueders T, Chin K -J, Conrad R, Friedrich M. Molecular analyses of methyl-coenzyme M reductase α-subunit (mcrA) genes in rice field soil and enrichment cultures reveal the methanogenic phenotype of a novel archaeal lineage. Environmental Microbiology, 2001, 3(3): 194-204.
[25] Krüger M, Frenzel P, Kemnitz D, Conrad R. Activity, structure and dynamics of the methanogenic archaeal community in a flooded Italian rice field. FEMS Microbiology Ecology, 2005, 51(3): 323-331.
[26] Lu Y H, Lueders T, Friedrich M W, Conrad R. Detecting active methanogenic populations on rice roots using stable isotope probing. Environmental Microbiology, 2005, 7(3): 326-336.
[27] Liu F H, Conrad R.Thermoanaerobacteriaceaeoxidize acetate in methanogenic rice field soil at 50°C. Environmental Microbiology, 2010, 12(8): 2341-2354.
[28] Erkel C, Kube M, Reinhardt R, Liesack W. Genome of rice cluster I archaea—the key methane producers in the rice rhizosphere. Science, 2006, 313(5785): 370-372.
[29] Watanabe T, Kimura M, Asakawa S. Distinct members of a stable methanogenic archaeal community transcribemcrAgenes under flooded and drained conditions in Japanese paddy field soil. Soil Biology and Biochemistry, 2009, 41(2): 276-285.
[30] Lu Y H, Conrad R. In situ stable isotope probing of methanogenic archaea in the rice rhizosphere. Science, 2005, 309(5737): 1088-1090.
[31] Conrad R, Klose M, Noll M, Kemnitz D, Bodelier P L E. Soil type links microbial colonization of rice roots to methane emission. Global Change Biology, 2008, 14(3): 657-669.
[32] Conrad R, Erkel C, Liesack W. Rice cluster I methanogens, an important group ofArchaeaproducing greenhouse gas in soil. Current Opinion in Biotechnology, 2006, 17(3): 262-267.
[33] Yuan Q, Lu Y H. Response of methanogenic archaeal community to nitrate addition in rice field soil. Environmental Microbiology Reports, 2009, 1(5): 362-369.
[34] Yuan Y L, Conrad R, Lu Y H. Responses of methanogenic archaeal community to oxygen exposure in rice field soil. Environmental Microbiology Reports, 2009, 1(5): 347-354.
[35] Sakai S, Imachi H, Sekiguchi Y, Ohashi A, Harada H, Kamagata Y. Isolation of key methanogens for global methane emission from rice paddy fields: a novel isolate affiliated with the clone cluster rice cluster I. Applied and Environmental Microbiology, 2007, 73(13): 4326-4331.
[36] Sakai S, Conrad R, Liesack W, Imachi H.Methanocellaarvoryzaesp. nov., a hydrogenotrophic methanogen isolated from rice field soil. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(12): 2918-2923.
[37] Lü Z, Lu Y H.Methanocellaconradiisp. nov., a thermophilic, obligate hydrogenotrophic methanogen, isolated from Chinese rice field soil. PLoS One, 2012, 7(4): e35279.
[38] Lyu Z, Lu Y H. Comparative genomics of threeMethanocellalesstrains reveal novel taxonomic and metabolic features. Environmental Microbiology Reports, 2015, 7(3): 526-537.
[39] Paul K, Nonoh J O, Mikulski L, Brune A. “Methanoplasmatales, ”Thermoplasmatales-related archaea in termite guts and other environments, are the seventh order of methanogens. Applied and Environmental Microbiology, 2012, 78(23): 8245-8253.
[40] Mihajlovski A, Alric M, Brugère J -F. A putative new order of methanogenic Archaea inhabiting the human gut, as revealed by molecular analyses of themcrAgene. Research in Microbiology, 2008, 159(7/8): 516-521.
[41] Wright A -D G, Auckland C H, Lynn D H. Molecular diversity of methanogens in feedlot cattle from Ontario and prince Edward Island, Canada. Applied and Environmental Microbiology, 2007, 73(13): 4206-4210.
[42] Dridi B, Raoult D, Drancourt M. Matrix-assisted laser desorption/ionization time-of-flight mass spectrometry identification ofArchaea: towards the universal identification of living organisms. APMIS, 2012, 120(2): 85-91.
[43] Borrel G, Harris H M B, Tottey W, Mihajlovski A, Parisot N, Peyretaillade E, Peyret P, Gribaldo S, O′Toole P W, Brugère J F. Genome sequence of “CandidatusMethanomethylophilus alvus” Mx1201, a methanogenic archaeon from the human gut belonging to a seventh order of methanogens. Journal of Bacteriology, 2012, 194(24): 6944-6945.
[44] Iino T, Tamaki H, Tamazawa S, Ueno Y, Ohkuma M, Suzuki K I, Igarashi Y, Haruta S.CandidatusMethanogranum caenicola: a novel methanogen from the anaerobic digested sludge, and proposal ofMethanomassiliicoccaceaefam. nov. andMethanomassiliicoccalesord. nov., for a methanogenic lineage of the classThermoplasmata. Microbes and Environments, 2013, 28(2): 244-250.
[45] Lang K, Schuldes J, Klingl A, Poehlein A, Daniel R, Brune A. Comparative genome analysis of “CandidatusMethanoplasma termitum” indicates a new mode of energy metabolism in the seventh order of methanogens. Applied and Environmental Microbiology, 2014, 81(4): 1338-1352.
[46] Brugère J F, Borrel G, Gaci N, Tottey W, O′Toole P W, Malpuech-Brugère C. Archaebiotics: proposed therapeutic use of archaea to prevent trimethylaminuria and cardiovascular disease. Gut Microbes, 2014, 5(1): 5-10.
[47] Hedderich R, Whitman W B. Physiology and biochemistry of the methane-producing archaea//Rosenberg E, DeLong E, Lory S, Stackebrandt E, Thompson F, eds. The Prokaryotes. Berlin: Springer, 2013: 635-662.
[48] 张杰, 陆雅海. 互营氧化产甲烷微生物种间电子传递研究进展. 微生物学通报, 2015, doi: 10.13344/j.microbiol.china.150077.
[49] 马晨, 周顺桂, 庄莉, 武春媛. 微生物胞外呼吸电子传递机制研究进展. 生态学报, 2011, 31(7): 2008-2018.
[50] Vignais P M, Billoud B. Occurrence, classification, and biological function of hydrogenases: an overview. Chemical Reviews, 2007, 107(10): 4206-4272.
[51] McInerney M J, Struchtemeyer C G, Sieber J, Mouttaki H, Stams A J, Schink B, Rohlin L, Gunsalus R P. Physiology, ecology, phylogeny, and genomics of microorganisms capable of syntrophic metabolism. Annals of the New York Academy of Sciences, 2008, 1125(1): 58-72.
[52] Stams A J M, De Bok F A M, Plugge C M, Van Eekert M H A, Dolfing J, Schraa G. Exocellular electron transfer in anaerobic microbial communities. Environmental Microbiology, 2006, 8(3): 371-382.
[53] Thauer R K, Kaster A K, Seedorf H, Buckel W, Hedderich R. Methanogenic archaea: ecologically relevant differences in energy conservation. Nature Reviews Microbiology, 2008, 6(8): 579-591.
[54] Thiele J H, Zeikus J G. Control of interspecies electron flow during anaerobic digestion: significance of formate transfer versus hydrogen transfer during syntrophic methanogenesis in flocs. Applied and Environmental Microbiology, 1988, 54(1): 20-29.
[55] Lovley D R, Phillips E J P. Availability of ferric iron for microbial reduction in bottom sediments of the freshwater tidal Potomac River. Applied and Environmental Microbiology, 1986, 52(4): 751-757.
[56] Lovley D R, Stolz J F, Nord G L, Jr., Phillips E J P. Anaerobic production of magnetite by a dissimilatory iron-reducing microorganism. Nature, 1987, 330(6145): 252-254.
[57] Lovley D R. Live wires: direct extracellular electron exchange for bioenergy and the bioremediation of energy-related contamination. Energy & Environmental Science, 2011, 4(12): 4896-4906.
[58] Summers Z M, Fogarty H E, Leang C, Franks A E, Malvankar N S, Lovley D R. Direct exchange of electrons within aggregates of an evolved syntrophic coculture of anaerobic bacteria. Science, 2010, 330(6009): 1413-1415.
[59] Morita M, Malvankar N S, Franks A E, Summers Z M, Giloteaux L, Rotaru A E, Rotaru C, Lovley D R. Potential for direct interspecies electron transfer in methanogenic wastewater digester aggregates. MBio, 2011, 2(4): e00159-11.
[60] Reguera G, McCarthy K D, Mehta T, Nicoll J S, Tuominen M T, Lovley D R. Extracellular electron transfer via microbial nanowires. Nature, 2005, 435(7045): 1098-1101.
[61] Malvankar N S, Yalcin S E, Tuominen M T, Lovley D R. Visualization of charge propagation along individual pili proteins using ambient electrostatic force microscopy. Nature Nanotechnology, 2014, 9(12): 1012-1017.
[62] Rabaey K, Boon N, Höfte M, Verstraete W. Microbial phenazine production enhances electron transfer in biofuel cells. Environmental Science & Technology, 2005, 39(9): 3401-3408.
[63] Marsili E, Baron D B, Shikhare I D, Coursolle D, Gralnick J A, Bond D R.Shewanellasecretes flavins that mediate extracellular electron transfer. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(10): 3968-3973.
[64] Newman D K, Kolter R. A role for excreted quinones in extracellular electron transfer. Nature, 2000, 405(6782): 94-97.
[65] Liu F H, Rotaru A -E, Shrestha P M, Malvankar N S, Nevin K P, Lovley D R. Promoting direct interspecies electron transfer with activated carbon. Energy & Environmental Science, 2012, 5(10): 8982-8989.
[66] Kato S, Hashimoto K, Watanabe K. Microbial interspecies electron transfer via electric currents through conductive minerals. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(25): 10042-10046.
[67] Chen S S, Rotaru A -E, Shrestha P M, Malvankar N S, Liu F H, Fan W, Nevin K P, Lovley D R. Promoting interspecies electron transfer with biochar. Scientific Reports, 2014, 4: 5019.
[68] Li H J, Chang J L, Liu P F, Fu L, Ding D W, Lu Y H. Direct interspecies electron transfer accelerates syntrophic oxidation of butyrate in paddy soil enrichments. Environmental Microbiology, 2015, 17(5): 1533-1547.
[69] McDonald I R, Bodrossy L, Chen Y, Murrell J C. Molecular ecology techniques for the study of aerobic methanotrophs. Applied and Environmental Microbiology, 2008, 74(5): 1305-1315.
[70] Semrau J D, DiSpirito A A, Yoon S. Methanotrophs and copper. FEMS Microbiology Reviews, 2010, 34(4): 496-531.
[71] Reeburgh W S. Oceanic methane biogeochemistry. Chemical Reviews, 2007, 107(2): 486-513.
[72] Hinrichs K -U, Hayes J M, Sylva S P, Brewer P G, DeLong E F. Methane-consuming archaebacteria in marine sediments. Nature, 1999, 398(6730): 802-805.
[73] Orphan V J, House C H, Hinrichs K -U, McKeegan K D, DeLong E F. Methane-consuming archaea revealed by directly coupled isotopic and phylogenetic analysis. Science, 2001, 293(5529): 484-487.
[74] Hallam S J, Putnam N, Preston C M, Detter J C, Rokhsar D, Richardson P M, DeLong E F. Reverse methanogenesis: testing the hypothesis with environmental genomics. Science, 2004, 305(5689): 1457-1462.
[75] Milucka J, Ferdelman T G, Polerecky L, Franzke D, Wegener G, Schmid M, Lieberwirth I, Wagner M, Widdel F, Kuypers M M M. Zero-valent sulphur is a key intermediate in marine methane oxidation. Nature, 2012, 491(7425): 541-546.
[76] Raghoebarsing A A, Pol A, Van De Pas-Schoonen K T, Smolders A J P, Ettwig K F, Rijpstra W I C, Schouten S, Damste J S S, Op Den Camp H J M, Jetten M S M, Strous M. A microbial consortium couples anaerobic methane oxidation to denitrification. Nature, 2006, 440(7086): 918-921.
[77] Ettwig K F, Van Alen T, Van De Pas-Schoonen K T, Jetten M S M, Strous M. Enrichment and molecular detection of denitrifying methanotrophic bacteria of the NC10 phylum. Applied and Environmental Microbiology, 2009, 75(11): 3656-3662.
[78] Dunfield P F, Yuryev A, Senin P, Smirnova A V, Stott M B, Hou S B, Ly B, Saw J H, Zhou Z M, Ren Y, Wang J M, Mountain B W, Crowe M A, Weatherby T M, Bodelier P L E, Liesack W, Feng L, Wang L, Alam M. Methane oxidation by an extremely acidophilic bacterium of the phylum Verrucomicrobia. Nature, 2007, 450(7171): 879-882.
[79] Pol A, Heijmans K, Harhangi H R, Tedesco D, Jetten M S M, Op Den Camp H J M. Methanotrophy below pH 1 by a new Verrucomicrobia species. Nature, 2007, 450(7171): 874-878.
[80] Islam T, Jensen S, Reigstad L J, Larsen Ø, Birkeland N -K. Methane oxidation at 55 °C and pH 2 by a thermoacidophilic bacterium belonging to theVerrucomicrobiaphylum. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(1): 300-304.
[81] Op Den Camp H J M, Islam T, Stott M B, Harhangi H R, Hynes A, Schouten S, Jetten M S M, Birkeland N -K, Pol A, Dunfield P F. Environmental, genomic and taxonomic perspectives on methanotrophicVerrucomicrobia. Environmental Microbiology Reports, 2009, 1(5): 293-306.
[82] Crossman Z M, Abraham F, Evershed R P. Stable isotope pulse-chasing and compound specific stable carbon isotope analysis of phospholipid fatty acids to assess methane oxidizing bacterial populations in landfill cover soils. Environmental Science & Technology, 2004, 38(5): 1359-1367.
[83] Qiu Q F, Noll M, Abraham W -R, Lu Y H, Conrad R. Applying stable isotope probing of phospholipid fatty acids and rRNA in a Chinese rice field to study activity and composition of the methanotrophic bacterial communitiesinsitu. The ISME Journal, 2008, 2(6): 602-614.
[84] Murrell J. The aerobic methane oxidizing bacteria (methanotrophs)//Timmis K N, ed. Handbook of Hydrocarbon and Lipid Microbiology. Berlin: Springer, 2010: 1953-1966.
[85] Ricke P, Erkel C, Kube M, Reinhardt R, Liesack W. Comparative analysis of the conventional and novelpmo(particulate methane monooxygenase) operons fromMethylocystisstrain SC2. Applied and Environmental Microbiology, 2004, 70(5): 3055-3063.
[86] Baani M, Liesack W. Two isozymes of particulate methane monooxygenase with different methane oxidation kinetics are found inMethylocystissp. strain SC2. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(29): 10203-10208.
[87] Belova S E, Baani M, Suzina N E, Bodelier P L E, Liesack W, Dedysh S N. Acetate utilization as a survival strategy of peat-inhabitingMethylocystisspp. Environmental Microbiology Reports, 2011, 3(1): 36-46.
[88] Vecherskaya M, Dijkema C, Saad H R, Stams A J M. Microaerobic and anaerobic metabolism of aMethylocystisparvusstrain isolated from a denitrifying bioreactor. Environmental Microbiology Reports, 2009, 1(5): 442-449.
[89] Costa C, Dijkema C, Friedrich M, Garcia-Encina P, Fernández-Polanco F, Stams A J M. Denitrification with methane as electron donor in oxygen-limited bioreactors. Applied Microbiology and Biotechnology, 2000, 53(6): 754-762.
[90] Ma K, Qiu Q F, Lu Y H. Microbial mechanism for rice variety control on methane emission from rice field soil. Global Change Biology, 2010, 16(11): 3085-3095.
[91] Macalady J L, McMillan A M S, Dickens A F, Tyler S C, Scow K M. Population dynamics of type I and Ⅱ methanotrophic bacteria in rice soils. Environmental Microbiology, 2002, 4(3): 148-157.
Microbial mechanisms of methane production and oxidation in terrestrial ecosystems
ZHANG Jianchao, XU Yiqin, LU Yahai*
CollegeofUrbanandEnvironmentalSciences,PekingUniversity,Beijing100871,China
Terrestrial ecosystems consist of oxic and anoxic environments. Anoxic environments can be permanent or temporary, and they include natural wetlands, paddy field soils, lake and river sediments, rumens, landfills, and anaerobic bioreactors. Large amounts of organic matter are released into these environments annually. Under anoxic conditions, organic matter is decomposed anaerobically, with methane (CH4) as the final product. CH4can diffuse through the anoxic-oxic interface and enter the atmosphere, and can become a potent greenhouse gas. Methanogenesis appears to be the core process of organic matter decomposition in anoxic environments. Methane oxidation takes place actively in the anoxic-oxic interface through which CH4diffuses. Microbial production and oxidation of CH4in terrestrial ecosystems together regulate the atmospheric concentration of CH4and contribute to a crucial part of global carbon cycling. In this review, we report the recent advances in the mechanistic understanding of microbial CH4production and oxidation in terrestrial ecosystems. The major topics include: discovery of novel methanogens, particularly of the psychrophilic and acidophilic methanogens, and the 6thand 7thorders of methanogens; syntrophic interaction and direct interspecies electron transfer in the methanogenic oxidation of short-chain fatty acids; the discovery of novel methanotrophs, including anaerobic and aerobic verrucomicrobial methanotrophs; and the novel ecophysiological properties of methanotrophs. These advances have greatly increased our understanding of microbial CH4production and oxidation in terrestrial ecosystems, and with the development of new methods and technologies, more breakthroughs are expected. We also propose a few perspectives for future studies.
methane production; methane oxidation; microbial mechanisms; novel methanogens; direct interspecies electron transfer (DIET)
国家自然基金重点项目(41130527)
2015-07-09;
2015-08-12
10.5846/stxb201507091459
*通讯作者Corresponding author.E-mail: luyh@pku.edu.cn
张坚超,徐镱钦,陆雅海.陆地生态系统甲烷产生和氧化过程的微生物机理.生态学报,2015,35(20):6592-6603.
Zhang J C, Xu Y Q, Lu Y H.Microbial mechanisms of methane production and oxidation in terrestrial ecosystems.Acta Ecologica Sinica,2015,35(20):6592-6603.

