XpertMTB/RIF实验在结核病诊断中的应用
刘慧梅 颜学兵
1.徐州医学院临床医学系,江苏徐州 221000;2.江苏省徐州市传染病医院结核科,江苏徐州 221000;3.徐州医学院附属医院感染科,江苏徐州 221000
结核病的有效控制关键在于对结核患者的快速检测及治疗。 传统的实验室诊断方法存在诸多不足,如抗酸菌涂片镜检方法操作简便、快速、特异、经济,但灵敏性较低[1-2];固体培养法价格较低廉,敏感性较涂片镜检法高,但耗时达数周;液体培养法虽然可以提高敏感度、缩短报告时间,但经济成本非常高[3-4]。因此寻找一种可以快速诊断结核病的实验室方法显得非常重要[5]。近年来,利福平耐药实时荧光定量核酸扩增技术(Xpert MTB/RIF)实验逐渐受到国内外广泛关注。 该检测方法国内临床应用刚刚起步,缺乏对其诊断性能的报道。 本研究旨在对Xpert MTB/RIF 实验与T-spot 实验等检测方法在结核病诊断中的临床价值进行对比研究。
1 资料与方法
1.1 一般资料
收集2014 年10 月~2015 年5 月徐州市传染病医院结核科收治的237 例患者,分为结核组和非结核组,分别为195 例和42 例,诊断均符合中华结核病诊治指南诊断标准。 结核组包括: 肺结核组160 例,男77 例,女83 例,年龄5~78 岁;肺外结核组35 例,男22 例,女13 例,年龄3~72 岁,主要包括结核性腹膜炎10 例、结核性脑膜炎3 例、骨结核3 例、淋巴结核6 例、肠结核7 例、肾结核3 例、女性生殖系统结核3 例。 非结核组42 例,主要是肺炎、肺癌等患者,男26 例,女16 例,年龄22~83 岁。
1.2 方法
嘱咐患者清晨嗽口后用力咳出深部浓痰,一式3 份,一份用于结核分枝杆菌(MTB)培养,一份用于痰涂片检查,一份用于XpertMTB/RIF 检测。标本收集的注意事项:①痰液标本收集以清晨为最佳,因为该时间段患者痰量多,含菌量多;②在医生或护士指导下取样,不得私自取样;③嘱咐患者漱口3 遍以上,以除去浅表固有细菌。 如果患者昏迷或无力咳嗽,不宜收集样本,医护人员应该协助患者采取合适体位,叩背以使痰液松动,再用吸痰器吸引,在吸痰器吸管中段搜集痰液,按吸痰法将痰液吸入集痰器内。
1.3 结核感染T 细胞斑点(T-spot)、液体培养、Xpert MTB/RIF 及药敏实验
T-spot 实验:采集肝素抗凝外周血5 mL,分离外周单个核细胞(PBMC)放入包被γ-INF 抗体的微孔板,加入结核特异性抗原早期分泌靶向抗原(early se creting antigen target 6,ESAT-6)和培养滤过蛋白(culture filtrate protein 10,CFP-10)作为刺激原,温箱培养24 h 后,洗去抗原致敏效应T 淋巴细胞,加入生物素标记的二抗,再经酶联显色,在细胞因子分泌的地方形成斑点,通过记录斑点读数检测结核特异抗原致敏效应T 淋巴细胞数量。 结果判定:当空白对照孔内斑点数为0~5 个时,任一实验孔斑点数减去空白孔斑点数≥6 个,结果为阳性;如果空白对照孔斑点数>6 个时, 任一实验孔斑点数≥空白孔斑点数的2 倍,结果同样表明阳性结果;如果上述标准不符合且阳性质控对照孔正常时,检测结果为阴性。
液体培养及药敏试验:在Ⅱ级生物安全操作柜中接种环刮取菌落,涂抹至罗氏培养基斜面,旋紧螺旋盖,在涡旋振荡器上振荡10~20 s,制成均匀的菌液。静置10 min 后,用吸管接种约0.1 mL 至中性罗氏培养及斜面上。 传代后的培养基放置在36℃培养,每周观察菌落生长情况,于肉眼可见菌落出现后1~2 周进行药敏试验。 制备菌液:在磨菌瓶中加入1~2 滴10%吐温-80℃水溶液,用无菌吸管尖端刮取2~3 周新鲜菌落,置于磨菌瓶中。旋紧瓶盖,在涡旋振荡器上振荡10~20 s。 静置5 min,小心打开瓶盖,加入约2 mL 灭菌生理盐水,静置片刻,使菌液中的大块物质沉淀。用无菌吸管吸取上部的菌液,约1 mL,转移到另一无菌试管中,与标准买时比浊管比浊。 逐渐滴加灭菌生理盐水,直至菌液浊与标准麦氏比浊管一致,即得到1 mg/mL的菌液。 接种:在无菌带有螺旋盖的试管中以无菌手法加入2mL 灭菌生理盐水备用,每株待测菌准备2 管。菌液静置,带颗粒或菌块沉淀。 用22 SWG 标准接种环2 满环1 mg/mL 的菌液,平移至2 mL 灭菌生理盐水中,即稀释成1×10-2mg/mL 菌液。 用同样方法再进行100 倍稀释,即成1×10-4mg/mL 菌液。 用22 SWG标准接种环分别取1 满环1×10-2mg/mL 和1×10-4mg/mL的菌液,用划线法均匀接种菌量为1×10-4mg 和1×10-6mg。接种后的培养基直立放置于恒温培养内,36℃培养,培养4 周后报告结果。
标本符合以下特点可直接用于药敏试验:①出现肉眼可见菌落后1~2 周的新鲜菌落;②没有其他污染菌共存;③涂片确认为抗酸菌。
Xpert MTB/RIF 实验:以1:2 的比例,往痰液标本中加入处理液,在涡旋振荡器上涡旋振荡15~30 s,室温静置15 min,使痰标本充分液化。 再将混合液转移至反应盒中,将反应试剂盒放入Gene Xpert 仪器(美国Cepheid 公司生产)中,按说明书进行检测,约2 h即可读取结果。 结果判断: 依照探针的循环阈值(Ct值),当内对照探针Ct 值≤38 时为阳性,反之则为无效, 提示标本的DNA 提取不合格或含有PCR 抑制物。 5 个探针中至少2 个探针Ct 值≤38 即为检测到MTB,可进一步按照Ct 值对MTB 进行半定量。Ct 值<16 为高含量,Ct 值为16~22 为中等含量,Ct 值为22~28 为低含量,Ct 值>28 为极低含量。 检测利福平耐药的基础在于MTB 特异性分子信标早期Ct 值和晚期Ct 值之差。 即△Ct 值。 系统设置的结果判断标准为△Ct>3.5 提示对利福平耐药,△Ct<3.5 提示对利福平敏感。由于终止循环数为38 个循环,因此当早期探针Ct 值>34.5 或晚期探针Ct 值>38 时,利福平耐药结果为不确定。 目前研究表明95%的利福平耐药菌株在rpoB 基因81 bp 区域(RRDR)存在基因突变。
1.4 结果判定
1.4.1 痰涂片结果判定 按照中国防痨协会基础专业委员会制订的实验室检查规程进行[6-7]。①抗酸杆菌阴性(-):连续观察300 个不同视野,未发现抗酸杆菌。②报告抗酸杆菌菌素:1~8 条/300 个视野。③抗酸杆菌阳性(+):每100 个视野发现3~9 条抗酸杆菌。④抗酸杆菌阳性(++):每10 个视野发现1~9 条抗酸杆菌。⑤抗酸杆菌阳性(+++):每个视野发现1~9 条抗酸杆菌。 ⑥抗酸杆菌阳性(++++):每个视野发现平均10 条抗酸杆菌。
1.4.2 药敏结果判定 (-):无菌落生长;报告实际菌落数:<50 个菌落;(+):50~100 个菌落;(++):100~200 个菌落;(+++):大部分融合(200~500 个菌落);(++++):融合(>500 个菌落)。
1.5 统计学方法
采用SPSS 18.0 统计学软件进行数据分析,计数资料用率表示,组间比较采用χ2检验或Fisher 确切概率法。 Kappa>0.4,表示两种实验检验一致性结果较好;Kappa<0.4,表示检验结果一致性较差。以P <0.05为差异有统计学意义。
2 结果
2.1 Xpert MTB/RIF 实验与其他结核检测方法的结果比较
结核组患者Xpert MTB/RIF 实验检测敏感性显著高于液体培养(χ2=36.691,P = 0.000)和痰涂片(χ2=6.934,P = 0.008),与T-spot 比较差异无统计学意义(χ2=0.347,P=0.541)。非结核组4 种方法特异性均较高且差异无统计学意义(χ2=0.346、0.346、1.012,P=0.557、0.557、0.314)。基于入组情况将患者分为肺结核、肺外结核进行分析,4 种检测方法均表明肺结核组结核分枝杆菌检测敏感性(Xpert MTB/RIF、T-spot 痰涂片、液体培养)明显高于肺外结核组(χ2=8.915、5.880、7.142、7.457,P = 0.003、0.015、0.008、0.006)。 见表1。
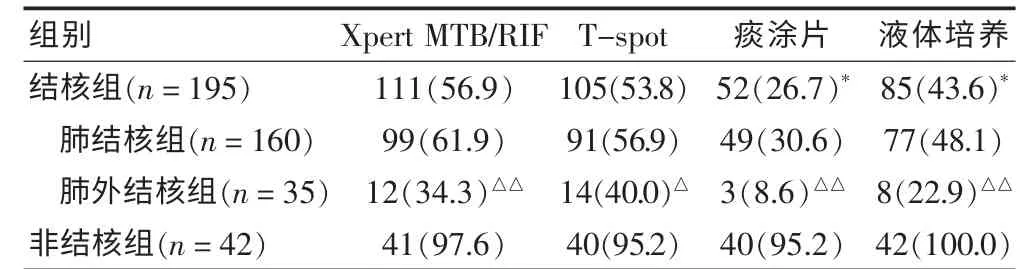
表1 结核敏感性及非结核特异性比较[n(%)]
2.2 Xpert MTB/RIF 实验与其他几种检测结果一致性的比较
Xpert MTB/RIF 实验与T-spot 实验检出结果符合率为86.9%,一致性Kappa=0.737,一致性结果较好;Xpert MTB/RIF 实验与痰涂片检出结果符合率为61.2%,一致性Kappa=0.200,一致性结果较差;Xpert MTB/RIF 实验与液体培养检测结果符合率为78.5%,一致性Kappa=0.563,一致性结果较好。 见表2。

表2 Xpert MTB/RIF 实验与痰涂片和液体培养检测结果一致性的比较(例,n=237)
2.3 利福平耐药检测结果
在237 例可疑结核患者中,液体培养阳性有85 例,9 例Xpert MTB/RIF 实验检测失败,共76 例可进行利福平耐药检测效能分析。传统比例法药敏实验检测出耐药菌9 株,耐药率为11.8%(9/76)。比例法耐药的的患者标本中,XpertX 系统检测出8 株为耐药菌,敏感性为88.9%,比例法药敏实验检测敏感菌67 例中,有1 例Xpert 系统检测出为耐药菌,特异性为98.5%(66/67)。 见表3。

表3 利福平耐药检测结果(例,n=76)
3 讨论
我国是世界上22 个结核病高负担国家之一,结核病患者数量约500 万例,居世界第二位,每年新增患者130 万,死亡病例约13 万例[8-11]。《2011 年中国卫生统计年鉴》资料显示,在甲乙类法定报告传染病中,我国现阶段结核病发病率为74.27/10 万,仅次于病毒性肝炎,位居第二,其死亡率为0.22/10 万,仅次于艾滋病,亦位居第二,而且发病人群以青壮年为主[12]。 结核病的疫情控制与结核病的早期发现、合理规范治疗、管理密切相关。 尽管结核病的诊断水平有了很大提高,但传统的结核病诊断方法依旧存在很多不足之处,严重影响结核病的诊断工作开展。 Xpert MTB/RIF实验是针对结核分枝杆菌rpoB 基因利福平耐药决定区设计引物、探针,检测其是否发生突变[13-14],2 h 内即可诊断患者是否感染结核分枝杆菌以及耐药性情况[15-16]。 本次研究旨在比较Xpert MTB/RIF 实验与其他3 种检测方法检测结核分枝杆菌的效能,并以药敏实验为金标准,分析其检测利福平耐药的应用价值。
本研究采用可疑结核患者血液、痰标本分别进行T-spot 实验、Xpert MTB/RIF 实验、涂片镜检、液体培养以及传统比例法药敏实验检测患者是否感染结核分枝杆菌及其对利福平耐药情况。 结果显示,以临床诊断为金标准,Xpert MTB/RIF 实验检测结核分枝杆菌敏感性为56.9%,与国内赵冰等[17]研究结果基本一致。 Xpert MTB/RIF 实验检测结核分枝杆菌敏感性略高于T-spot 实验,明显高于痰涂片镜检、液体培养。一致性检验结果表明,Xpert MTB/RIF 实验与液体培养、T-spot 实验检测结果一致性较好。
研究表明将Xpert MTB/RIF 实验检测利福平耐药情况应用于耐药高危人群(耐药率>20%)中开展,检测结果更具有价值[17]。 以比例法药敏实验作为金标准,Xpert MTB/RIF 实验检测利福平耐药的敏感性为88.9%,特异性为98.5%,与既往的研究[18-19]结果基本一致。但敏感性低于Boehme 等[20]研究结果。由于本次研究中76 例培养阳性标本进行药敏实验, 耐药率仅为11.8%,目标人群利福平耐药率较低,敏感性过低可能是由于利福平耐药患者过少所致。因此世界卫生组织建议如果在利福平耐药率较低人群中应用Xpert MTB/RIF 检测技术检测利福平耐药情况,检测结果为耐药,样本仍需采用药敏实验进一步验证Xpert检测结果。
综上所述,Xpert MTB/RIF 实验操作简单、检测快速、敏感性高并且对实验室要求较低,因此可以很好的辅助临床医生及时诊断目标疾病,具有一定的使用前景。
[1] 王永忠,柳龙银,张宏宇,等.结核分枝杆菌实时荧光核酸恒温扩增检测方法的建立及应用[J].江苏医药,2011,37(23):2820-2822.
[2] 郑强,李朝金,苟莉,等.多种肺结核临床实验室诊断方法的比较分析[J].国际检验医学杂志,2014,35(21):2941-2942.
[3] 雷云.荧光PCR 诊断肺结核的临床应用研究[J].临床肺科杂志,2014,19(7):1278-1279.
[4] 张玉平,丁显平,张丽嫒,等.T-SPOT、TB、痰涂片和TBDNA 检测在肺结核诊断中的比较研究[J].成都医学院学报,2013,8(1):49-51.
[5] 杨新明,邹文玮.不同方法检查痰中结核杆菌的结果及分析[J].实验与检验医学,2010,2(3):303-304.
[6] 刘建君.中国结核病防治规划痰涂片镜检质量保证手册[M].北京:中国协和医科大学出版社,2004:5-19.
[7] 赵雁林,王黎霞.分枝杆菌分离培养标准化操作程序及质量保证手册[M].北京:人民卫生出版社,2013:3-12.
[8] WHO. The stop TB strategy,case reports,treatment outcomes and estimates of TB burden [R]. Geneva,2009.
[9] 王黎霞.中国结核病防治工作现状分析[J].中国公共卫生,2012,(4):413-414.
[10] WHO.Global tuberculosis control[R].WHO report,2011.
[11] WHO. The global plan to stop TB 2011-2015:transforming the fight towards elimination of tuberculosis [R].Geneva:World health Organization,2010.
[12] Zhao YL,Xu SF,Wang LX,et al. National survey of drugresistant tuberculosis in china [J]. N IngI J Med,2012,366(23):2161-2170.
[13] Nicol MP,Workman L,Isaacs W,et al. Accuracy of the Xpert MTB/RIF test for the diagnosis of pulmonary tuberculosis in children admitted to hospital in Cape Town,South Africa:a descriptive study [J]. Lancet Infect Dis,2011,11(11):819-824.
[14] Marlowe EM,Novak-Weekley SM,Cumpio J,et al. Evaluation of the Cepheid Xpert MTB/RIF assay for direct detection of Mycobacterium tuberculosis complex in respiratory specimens [J]. J Clin Microbiol,2011,49(32):1621-1623.
[15] 夏辉,赵雁林.Xpert MTB/RIF 在我国的应用前景[J].实用医学杂志,2013,29(23):3799-3800.
[16] 李力韬,李洪敏,马远征,等.应用XpertMTB/RIF 对脊柱结核临床标本行结核分枝杆菌与利福平耐药性检测的验证性研究[J].中华骨科杂志,2014,34(2):211-215.
[17] 赵冰,欧喜超,夏辉,等.Xpert MTB/RIF 检测技术在结核病诊断中的应用评价[J].中国防痨杂志,2014,36(6):462-466.
[18] 张治国,欧喜超,孙倩,等.利福平耐药实时荧光定量核酸扩增技术检测痰标本中结核分枝杆菌及其耐药性的研究[J].中国防痨杂志,2013,35(1):13-15.
[19] 伊惠霞,侯新月,王泉,等.Xpert MTB/RIF 系统快速检测结核分枝杆菌及利福平耐药性研究[J].新疆医科大学学报,2014,37(12):1643-1646.
[20] Boehme CC,Nabeta P,Hillemann D,et al. Rapid molecular detection of tuberculosis and rifampin resistance [J].N Eng J Med,2010,363(11):1005-1015.

