黄土高原石油污染土壤微生物群落结构及其代谢特征
甄丽莎, 谷 洁, 胡 婷, 吕 睿, 贾凤安, 刘 晨, 李 燕
1 西北农林科技大学资源环境学院, 杨凌 712100 2 陕西省微生物研究所, 西安 710043 3 陕西省循环农业工程技术研究中心, 杨凌 712100
黄土高原石油污染土壤微生物群落结构及其代谢特征
甄丽莎1,2, 谷 洁1,3,*, 胡 婷1, 吕 睿2, 贾凤安2, 刘 晨2, 李 燕2
1 西北农林科技大学资源环境学院, 杨凌 712100 2 陕西省微生物研究所, 西安 710043 3 陕西省循环农业工程技术研究中心, 杨凌 712100
针对污染胁迫下土壤微生物群落变化和代谢变异等问题,基于平板稀释法和Biolog微平板分析方法,研究了陕北黄土高原石油污染土壤微生物群落结构、代谢特征及其功能多样性。结果表明,不同类群的土壤微生物对石油污染胁迫的响应不同,污染土壤细菌和真菌数量高出清洁土壤1个数量级,而污染土壤的放线菌数量极显著减少(P<0.01);污染土壤和清洁土壤微生物对糖类和多聚物类碳源较易利用,污染土壤微生物总体上代谢碳源的种类和活性均低于清洁土壤。微生物群落主成分分析(PCA)表明,石油污染土壤和清洁土壤的微生物群落存在显著差异(P<0.01),起分异作用的碳源主要为糖类,其次是羧酸类和氨基酸类;随着土壤石油含量增加,典型变量值变异(离散)增大,土壤微生物群落结构稳定性降低。微生物群落多样性分析表明,Shannon丰富度指数(H)、McIntosh均一度指数(U)和Simpson优势度指数(1/D)均达到极显著差异(P<0.01),污染土壤微生物群落H和U低于清洁土壤,但是一定浓度的石油污染可以刺激土壤微生物群落中优势种群的生长,1/D增高。研究结果为陕北黄土高原石油污染区土壤微生物修复提供理论基础。
黄土高原; 石油污染; 微生物群落结构; 群落代谢特征
黄土高原矿产资源丰富,是中国重要的能源基地。据统计,陕北地区石油已探明储量11亿t,2009年仅延安地区原油产量就达1224万t[1]。在该地区石油产业的发展过程中,由于开采和运输过程中存在一些不合理的作业方式,导致了石油进入土壤,引起了土壤石油污染的环境问题[2]。由于土壤系统的开放性,石油污染物可以通过蒸发作用进入大气环境,通过径流和渗透等途径进入水环境,再从大气、土壤和水环境转移到植物、动物和人体,对人类健康造成持久性危害[3-4]。石油污染已经成为该地区土壤生态环境保护的一个突出问题[5-6]。在该区域石油污染方面,任磊等[7]对黄土高原延河流域石油类物质径流污染规律进行了研究。王金成等[8]对黄土高原微生物3大类群,以及土壤含盐率、有机质含量等环境因子的相互作用进行了研究。陆昕等[9]利用假单胞菌对陕北石油污染土壤进行了生物修复。但是,有关陕北黄土高原石油污染土壤微生物群落结构、代谢特征和微生物群落功能多样性的研究却鲜见报道。土壤微生物是土壤生物活性的重要组成部分,参与土壤中有机物质的分解、转化等生物化学过程。土壤微生物群落结构、代谢特征和功能多样性可作为土壤环境质量评价的重要指标[10]。刘五星等[11]已利用微生物群落结构和物种多样性对南京周边石油污染土壤的生态风险进行评价。本文利用平板稀释法和Biolog微平板法研究了陕北黄土高原石油污染土壤中微生物群落结构及其功能多样性,分析了石油污染土壤微生物对单一碳源的利用程度,对黄土高原石油污染土壤生态环境和可生物修复性进行评价,以期为陕北黄土高原石油污染区生态修复提供理论依据。
1 材料与方法
1.1 研究地区概况
供试土壤采自陕西省延安市宝塔区河庄坪油井(109°26′ E,36°40′ N),海拔1018—1045 m,位于鄂尔多斯盆地伊陕斜坡中段,地处黄土高原丘陵沟壑区,属于大陆性半干旱半湿润气候,年均气温7.7—10.6 ℃,年均日照2300—2700 h,年均无霜期170 d,年均降水量500 mm。
1.2 试验材料
1.2.1 土样采集
石油污染土壤外观呈黑色或深棕色、有严重油味。选取2处石油污染土壤,采集表层(0—20 cm)土壤样品,记为石油污染土壤- 1(Petroleum contaminated soil- 1, PCS- 1)和石油污染土壤- 2(Petroleum contaminated soil- 2, PCS- 2)。另在油井附近玉米农田,随机选取5个采样点,采集农田表层(0—20 cm)土壤样品,除去表面可见的动物和植物残体,混匀,记为对照非石油污染土壤(CK)。将土样置于冰箱内带回实验室。一部分新鲜土壤研磨过2 mm筛,4 ℃保存,供测定土壤石油含量和微生物群落代谢特征;另一部分风干,供测定土壤理化性状使用。
1.2.2 Biolog ECO 微平板
Biolog ECO微平板(ECO MicroPlate,美国Marix Technologies Corporation生产)的31种单一碳源分为6大类[12],包括糖类10种、羧酸类7种、氨基酸类6种、多聚物类4种、多胺化合物类2种和芳香化合物类2种。
1.3 试验指标及其测定方法
1.3.1 土壤石油含量及理化性状测定
土壤石油含量采用重量法测定,称取10 g石油污染土壤,依次使用20 mL正己烷、20 mL二氯甲烷和20 mL三氯甲烷进行索氏提取,合并提取液置于100 mL圆底烧瓶中蒸馏去除溶剂,置烘箱中至恒重,取出放入干燥器中冷却30 min后称重。土壤pH值用PDS- 3C型精密pH计测定(土∶水比为1∶2.5)[13]。土壤全氮、全碳、速效磷和速效钾采用农化分析法测定[14]。土壤基本理化性质见表1。

表1 土壤基本理化性状
1.3.2 微生物数量测定
采用平板稀释法对土壤中的细菌、真菌、放线菌数量进行测定[15]。其中,细菌培养基为牛肉膏蛋白胨培养基;真菌培养基为PDA(马铃薯葡萄糖琼脂)培养基,加入抗生素使其终浓度为100 μg/mL;放线菌培养基为高氏Ⅰ号培养基,加入重铬酸钾使其终浓度为50 mg/L[16]。
1.3.3 微生物群落水平生理轮廓(CLPPs)测定
称取相当于5.0 g风干质量的新鲜土壤,加入装有45 mL无菌生理盐水(0.85%NaCl)的三角瓶中,摇床(200 r/min)振荡30 min,获得土壤样品表面和内部的微生物悬浮液,静置片刻后取上清液,采用10倍稀释法,用无菌生理盐水将其稀释至浓度为10-3的悬浮液。在超净工作台上,将稀释好的土壤悬浮液接种于ECO微平板中,每孔150 μL。将接种的ECO板装入聚乙烯盒中置于25 ℃暗箱培养,连续培养240 h,在此培养过程中每隔12 h在ELISA反应微平板读数器上590 nm处读数1次[17]。
1.4 数据处理
1.4.1 孔平均颜色变化率(AWCD)
式中,Ci为各反应孔在590 nm处的吸光值;R为ECO板对照孔A1在590 nm处的吸光值。Ci-R小于零的孔,计算时记为零,即:Ci-R≥0[18]。
1.4.2 群落多样性指数
群落Shannon丰富度指数(H):
H=-∑ Pi× lnPi
式中,Pi为第i孔相对吸光值与整板平均相对吸光值总和的比,即:Pi=(Ci-R)/ ∑(Ci-R)。
群落Simpson优势度指数(D)
式中,ni为第i孔相对吸光值(Ci-R),N为相对吸光值的总和,Simpson指数通常用1/D值表示。
群落McIntosh均一度指数(U)
式中,ni为第i孔相对吸光值(Ci-R)。
采用Biolog ECO板培养120 h反应孔的平均颜色变化率用于主成分分析。数据采用Excel(V2003)进行数据处理和制图,采用SAS(V8.1)和SPSS(18.0)软件进行主成分分析析。
2 结果与分析
2.1 石油污染土壤微生物群落组成分析
土壤微生物对土壤生态环境的变化较植物和土壤动物更为敏感。由表2可见,CK、PCS- 1和PCS- 2 3种土壤微生物总量和组成存在较大差异。CK土壤微生物数量大小为细菌>放线菌>真菌,石油污染土壤PCS- 1和PCS- 2微生物数量发生变异,表现为细菌>真菌>放线菌。各处理土壤中的细菌占绝对优势(百分含量均在94%以上),CK处理土壤中真菌数量最低, PCS- 1和PCS- 2土壤中放线菌数量最低。不同土壤的细菌数量大小依次为PCS- 1>PCS- 2>CK,PCS- 1和PCS- 2处理的细菌数量极显著高于CK处理(P<0.01),分别为CK处理的9.0倍和5.8倍,PCS- 1和PCS- 2之间差异达到显著水平(P<0.05);3种土壤的真菌数量差异达到极显著水平(P<0.01),PCS- 1和PCS- 2处理的真菌数量分别为CK处理的9.0倍和4.0倍;CK处理的放线菌数量极显著高于石油污染土壤(P<0.01),是PCS- 1的19.5倍,PCS- 2的58.7倍,PCS- 1和PCS- 2之间差异不显著(P>0.05)。

表2 石油污染土壤微生物数量与组成分析
2.2 微生物群落代谢特征及其功能多样性分析
2.2.1 ELLSA平均颜色变化率(AWCD)分析
平均颜色变化率(AWCD)反应土壤微生物的活性,是微生物群落利用单一碳源能力的重要指标[19]。AWCD值越大,表明土壤中微生物活性越高。从图1可以看出,3种土壤微生物群落的AWCD随着培养时间的延长而逐渐升高。在0—24 h培养时期,各处理的AWCD均很小,说明在24 h之内碳源基本未被微生物群落利用;从24 h开始,各处理的AWCD出现了明显的变化,反映出此后微生物群落活性增强,碳源被大幅度利用,其中,CK的土壤微生物群落的AWCD急剧升高,增长斜率最大,为0.02。3种土壤的AWCD在整个培养过程中存在明显差异,从大到小依次为:CK>PCS- 1>PCS- 2,即CK的土壤微生物活性最大,PCS- 1、PCS- 2次之。

图1 土壤微生物群落培养过程中孔平均颜色变化率(AWCD)变化Fig.1 AWCD (Average Well-Color Development) change during incubation of soil microbial community
2.2.2 微生物群落碳源代谢分析
微生物对不同碳源的利用可以反映微生物的代谢功能类群。采用Biolog ECO板培养120 h的吸光值分析不同土壤微生物群落对6类碳源的利用(表3),结果表明不同土壤微生物群落对碳源的优先利用种类和利用程度有明显差异。CK土壤微生物群落对碳源利用率由大到小依次为:糖类>多聚物类>氨基酸类>羧酸类>多胺化合物类>芳香化合物类。PCS- 1土壤微生物群落对碳源的利用表现为:糖类>羧酸类>多聚物类>氨基酸类>多胺化合物类>芳香化合物类。PCS- 2土壤由于长期受到高浓度石油污染,导致了微生物群落对碳源的利用选择发生了变化,对碳源的利用表现为:多聚物类>糖类>氨基酸类>羧酸类>多胺类化合物>芳香化合物类。从土壤微生物生理碳代谢群落结构来看,CK和PCS- 1土壤优势种群均为糖类代谢群,PCS- 2土壤优势种群为多聚物类代谢群,各种土壤中多胺化合物类代谢群和芳香化合物类代谢群最弱。
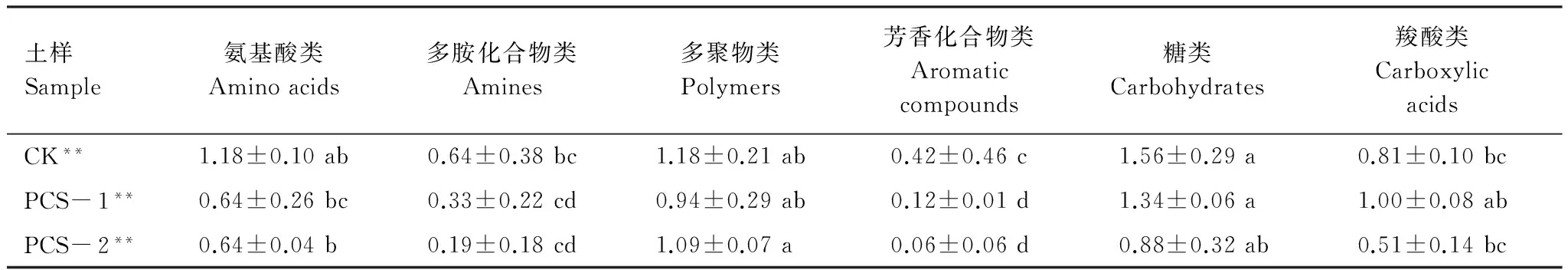
表3 土壤微生物群落对6类碳源的利用
2.2.3 微生物群落代谢主成分分析(PCA)
石油污染不但会影响土壤微生物活性,而且会改变微生物群落结构,使微生物产生代谢变异性,从而对碳源的利用选择发生转移。采用Biolog ECO板培养120 h的吸光值进行主成分分析(PCA),31个主成分因子前8个成分的累积方差贡献率达到100%(表4)。前8个成分的特征值分别为9.68、4.98、4.35、3.67、3.09、2.36、1.74和1.15,第二个特征值是一个明显折点(图2)。因此,提取可以聚集单一碳源变量的数据变异(累计方差贡献率)为47.27%的前两个主成分PC1、PC2来分析土壤微生物群落功能多样性。由图3可见,3种土壤在主成分坐标体系中分布差异十分明显,这种差异主要体现在PC1上。CK位于PC1的正端,典型变量值达1.39,PCS- 1、PCS- 2位于PC1的负端,方差分析表明,PC1典型变量值差异极显著(F=51.71,P<0.01),表现为CK、PCS- 1和PCS- 2土壤之间差异均达到极显著水平。从典型变量值的离散性来看,CK和PCS- 1土壤的离散(变异)较小,PCS- 2土壤的离散较大,说明CK和PCS- 1土壤微生物群落结构比PCS- 2相对稳定。从PCA分析中31种碳源在主成分上的因子载荷图(图4),可以看出31种碳源对PC1和PC2的贡献率。对PC1贡献大的碳源(特征向量系数>0.50)有18种,其中糖类6种,羧酸类4种,氨基酸类4种,多胺化合物类2种,可见对PC1起分异作用的碳源主要是糖类,其次是羧酸类和氨基酸类。对PC2贡献率大的碳源有4种,均为糖类。D-甘露醇对PC1和PC2的贡献率均大于0.50。

表4 总方差解释

图2 碎石图Fig.2 Scree plot

图3 土壤微生物群落主成分分析Fig.3 Principal component analysis of soil microbial community

图4 31种碳源对PC1和PC2贡献的特征向量系数Fig.4 Eigenvector coefficients of carbon sources with loading for PC1 and PC2
2.2.4 微生物群落多样性指数分析
微生物群落多样性指标(Shannon丰富度指数,H、Simpson优势度指数,1/D和McIntosh均一度指数,U)常被用于评价土壤微生物功能多样性[20]。H反映了土壤微生物群落的丰富程度;1/D则着重于土壤微生物群落中最常见的物种;U是基于群落物种多维空间上距离的多样性指数,是群落物种均一性的度量[21]。由表5可见,CK、PCS- 1处理的丰富度指数H极显著高于PCS- 2(P<0.01),分别比PCS- 2高出13.4%和11.6%,CK和PCS- 1之间差异不显著(P>0.05);PCS- 1的优势度指数1/D最高,是CK和PCS- 2的1.26和1.68倍。CK的均一度指数U极显著高于PCS- 2(P<0.01),是PCS- 2的1.35倍,PCS- 1的优势度指数U与CK和PCS- 2之间差异均不显著(P>0.05)。

表5 土壤微生物群落多样性指数
3 讨论
微生物是土壤生物活性的重要组成部分,对土壤有机物质的分解和转化起着重要的作用[22],是评价土壤质量的重要指标[10]。一方面,石油污染物影响土壤微生物群落结构及其组成,另一方面,土壤微生物群落结构及其组成也制约着石油烃类的分解与转化。刘五星等[11]等研究表明石油污染土壤中细菌、放线菌数量与清洁土壤无显著差异,真菌数量显著提高。Franco等[23]研究了威尼斯费留利朱利亚地区石油污染土壤,结果表明,受到污染的软土微生物量与对照相比显著提高,其他类型土壤微生物量有不同程度的下降。土壤受到石油污染后,微生物群落及其组成的变化因土壤性质和石油组分的不同而表现出差异。本研究供试土样为黄绵土,石油污染土壤样品中污染物浓度分别是土壤石油烃临界值(500 mg/kg)的212倍和274倍,属于重度污染。研究结果表明,石油污染土壤微生物数量极显著增加,以细菌为主,真菌次之,均比未受石油污染土壤高出1个数量级,而放线菌数量极显著减少。石油污染土壤的细菌浓度为107CFU/g,所占比例达99.8%—99.9%。
微生物数量反映的是土壤微生物群落大小,而AWCD反映的是微生物群落代谢活性[24]。未污染土壤的微生物活性明显高于石油污染土壤,且随着污染物浓度的增加,微生物活性减弱。有研究报道土壤C∶N∶P为120∶10∶1时有利于微生物对污染物的降解[25],这可能是本研究土壤微生物数量高于清洁土壤,而群落代谢活性低于清洁土壤的原因,石油污染导致碳含量增加,土壤养分比例严重失衡,进而影响了微生物群落的代谢活性。石油污染物不仅可以降低微生物群落对碳源的代谢能力,还可以改变微生物群落对碳源的利用模式。不同浓度石油污染土壤的微生物群落代谢存在显著差异,随污染物浓度增加,土壤微生物群落对碳源的代谢模式由以糖类为主转变为以多聚物类为主。土壤典型变量值的变异(离散)随着石油浓度的增加而增大,微生物群落结构稳定性降低,说明石油烃类污染物破坏了土壤原有的生态环境。主成分分析(PCA)表明,对土壤微生物群落代谢模式起分异作用的碳源主要是糖类。说明陕北黄土高原石油污染土壤微生物群落通过调整碳源利用模式来适应环境污染[26]。
Shannon丰富度指数(H)、Simpson优势度指数(1/D)和McIntosh均一度指数(U)从不同侧面反映了土壤微生物群落的功能多样性。Shannon丰富度指数和McIntosh均一度指数分析结果表明,清洁土壤微生物群落的丰富度和均一度均高于石油污染土壤。而Simpson优势度指数分析结果则说明,一定浓度的石油污染可以刺激土壤微生物群落中优势种群的生长。这与彭静静等[27]的研究结果一致,高浓度的多环芳烃使土壤微生物的丰富度降低,但可以促进某些微生物的生长使其占据主导地位。杨萌青等[28]研究也证实了随着石油污染浓度的增加,土壤微生物均匀度降低。
综上所述,陕北黄土高原石油污染土壤具有良好的可生物修复性,应当充分开发土著细菌资源,并外源投加氮、磷等营养元素,从而刺激土著石油降解菌的生长,提高石油降解率。一方面,在受到石油污染后,土壤微生物,尤其是细菌数量急剧增加,为石油污染土壤生物修复提供了大量的菌种资源;另一方面,一定浓度的石油可以促进某些微生物的生长,添加外源营养物质,使优势菌群在石油污染土壤生物修复过程中占主导地位,发挥降解石油污染物的作用。
[1] 刘培, 梁继东, 高伟, 贺延龄. 延安石油开采对周边黄土污染的调查分析. 西安交通大学学报, 2011, 45(7): 123- 128.
[2] Zhou Q X, Sun F H, Liu R. Joint chemical flushing of soils contaminated with petroleum hydrocarbons. Environment International, 2005, 31(6): 835- 839.
[3] Fine P, Graber E R, Yaron B. Soil interactions with petroleum hydrocarbons: Abiotic processes. Soil Technology, 1997, 10(2): 133- 153.
[4] Gribb M M, Bene K J, Shrader A. Sensitivity analysis of a soil leachability model for petroleum fate and transport in the vadose zone. Advances in Environmental Research, 2002, 7(1): 59- 72.
[5] Tang J C, Wang M, Wang F, Sun Q, Zhou Q X. Eco-toxicity of petroleum hydrocarbon contaminated soil. Journal of Environmental Sciences, 2011, 23(5): 845- 851.
[6] Ruffo P, Bazzana L, Consonni A, Corradi A, Saltelli A, Tarantola S. Hydrocarbon exploration risk evaluation through uncertainty and sensitivity analyses techniques. Reliability Engineering & System Safety, 2006, 91(10/11): 1155- 1162.
[7] 任磊, 黄廷林. 黄土高原的石油类物质坡面径流污染研究. 中国给水排水, 2000, 16(11): 1- 5.
[8] 王金成, 井明博, 肖朝霞, 刘灵霞, 王凤琴, 张希彪, 周天林. 陇东黄土高原地区石油污染土壤微生物群落及其与环境因子的关系. 水土保持通报, 2012, 32(5): 145- 151.
[9] 陆昕, 陈立, 李娟, 陈五岭. 假单胞菌Nwu1-mu对陕北石油污染土壤的生物修复作用研究. 农业环境科学学报, 2010, 29(5): 910- 917.
[10] Winding A, Hund-Rinke K, Rutgers M. The use of microorganisms in ecological soil classification and assessment concepts. Ecotoxicology and Environmental Safety, 2005, 62(2): 230- 248.
[11] 刘五星, 骆永明, 滕应, 李振高, 吴龙华. 石油污染土壤的生态风险评价和生物修复Ⅱ.石油污染土壤的理化性质和微生物生态变化研究. 土壤学报, 2007, 44(5): 848- 853.
[12] Papatheodorou EM, Efthimiadou E, Stamou G P. Functional diversity of soil bacteria as affected by management practices and phonological stage of Phaseolus vulgaris. European Journal of Soil Biology, 2008, 44(4): 429- 436.
[13] Huang C, Deng L J, Gao X S, Zhang S R, Luo T, Ren Q R. Effects of fungal residues return on soil enzymatic activities and fertility dynamics in a paddy soil under a rice-wheat rotation in Chengdu Plain. Soil and Tillage Research, 2010, 108(1/2): 16- 23.
[14] 鲍士旦. 土壤农化分析 (第三版). 北京: 中国农业出版社, 2000: 432- 437.
[15] 沈萍, 范秀容, 李广武. 微生物学实验 (第三版). 北京: 高等教育出版社, 1999: 49- 57.
[16] 彭云霞, 姜怡, 段淑蓉, 李文均, 徐丽华. 稀有放线菌的选择性分离方法. 云南大学学报(自然科学版), 2007, 29(1): 86- 89.
[17] Kong W D, Zhu Y G, Fu B J, Marschner P, He J Z. The veterinary antibiotic oxytetracycline and Cu influence functional diversity of the soil microbial community. Environmental Pollution, 2006, 143(1): 129- 137.
[18] Selmants P C, Hart S C, Boyle S I, Stark J M. Red alder (Alnusrubra) alters community-level soil microbial function in conifer forests of the Pacific Northwest, USA. Soil Biology and Biochemistry, 2005, 37(10): 1860- 1868.
[19] 徐华勤, 肖润林, 邹冬生, 宋同清, 罗文, 李盛华. 长期施肥对茶园土壤微生物群落功能多样性的影响. 生态学报,2007, 27(8): 3355- 3361.
[20] Gomez E, Ferreras L, Toresani S. Soil bacterial functional diversity as influenced by organic amendment application. Bioresource Technology, 2006, 97(13): 1484- 1489.
[21] Fang H, Yu Y L, Chu X Q, Wang X G, Yang X E, Yu J Q. Degradation of chlorpyrifos in laboratory soil and its impact on soil microbial functional diversity. Journal of Environmental Sciences, 2009, 21(3): 380- 386.
[22] Marin J A, Hernandez T, Garcia C. Bioremediation of oil refinery sludge landfarming in semiarid conditions: Influence in soil microbial activity. Environmental Research, 2005, 98(2): 185- 195.
[23] Franco I, Contin M, Bragato G, De Nobili M. Microbiological resilience of soils contaminated with crude oil. Geoderma, 2004, 121(1/2): 17- 30.
[24] 席劲瑛, 胡洪营, 姜健, 钱易. 生物过滤塔中微生物群落的代谢特性. 环境科学, 2005, 26(4): 165- 170.
[25] 张从, 夏立江. 污染土壤生物修复技术. 北京: 中国环境科学出版社, 2000, 246- 268.
[26] Wenderoth D F, Reber H H. Correlation between structural diversity and catabolic versatility of metal-affected prototrophic bacteria in soil. Soil Biology and Biochemistry, 1999, 31(3): 345- 352.
[27] 彭静静, 张又弛, 侯艳伟, 黎慧娟, 蔡超. 炼油厂周边PAHs污染土壤中微生物群落结构多样性研究. 生态环境学报, 2011, 20(5): 962- 965.
[28] 杨萌青, 李立明, 李川, 李广贺. 石油污染土壤微生物群落结构与分布特性研究. 环境科学, 2013, 34(2): 789- 794.
Microbial community structure and metabolic characteristics of oil-contaminated soil in the Loess Plateau
ZHEN Lisha1,2, GU Jie1,3,*, HU Ting1, LÜ Rui2, JIA Feng′an2, LIU Chen2, LI Yan2
1CollegeofResourcesandEnvironment,NorthwestAgricultureandForestryUniversity,Yangling712100,China2ShaanxiProvinceMicrobiologyInstitute,Xi′an710043,China3TheResearchCenterofRecycleAgriculturalEngineeringandTechnologyofShaanxiProvince,Yangling712100,China
To investigate the impacts of crude oil pollution on the soil microbial community, and estimate the potential for crude oil degradation by indigenous microbial consortia, we examined the soil microbial community structure, metabolic characteristics and functional diversity of crude oil-contaminated soil collected in the Loess Plateau in northern Shaanxi, using plate counts and the Biolog Eco plate method. The results showed that the responses of soil microbes to crude oil pollution stress varied greatly. The abundance of bacteria and fungi in crude oil-contaminated soil were about one order of magnitude higher than in the uncontaminated soil, while the abundance of actinomycetes was significantly lower in polluted soil than in uncontaminated soil (P<0.01). The number of bacteria in crude oil-contaminated soil was 107CFU/g, and the proportion of bacteria reached 99.8%—99.9% of all microbes. This indicated that majority of the crude oil biodegradation was the result of bacterial activity in collaboration with fungi rather than actinomycetes. The microbial activity of uncontaminated soil was higher than that of crude oil-contaminated soil, and microbial activity decreased with increased concentrations of crude oil. This phenomenon can be easily explained by the fact that the microbial metabolic activity had been affected owing to an increase in carbon sources and an imbalance in the soil nutrient ratio followed by an increase in the crude oil concentration in soil. The microbes in both crude oil-contaminated and uncontaminated soil were more likely to use carbon sources such as carbohydrates and polymers on the Biolog plates. Microbes from crude oil-contaminated soil used less of the available carbon sources and showed lower metabolic activity than microbes from the uncontaminated soil. This indicated that soil microbes adapted to the crude oil-contaminated environment by adjusting the microbial community structure, and a correlation was observed between the soil microbial community structure and soil microbial growth. The principal component analyses results revealed a significant difference (P<0.01) in soil microbial community structure between uncontaminated and crude oil-contaminated soils. The differences mostly related to the use of carbohydrates as the dominant carbon source and then carboxylic acids and amino acids. The variation in the canonical variable (discrete value) increased with increasing soil crude oil content, however, the stability of the soil microbial community structure decreased. This indicated that the crude oil pollutant destroyed the original soil ecological environment. The diversity of microbial community, as indicated by Shannon (H), McIntosh (U), and Simpson (1/D) indices, was significantly different in crude oil-contaminated soil (P<0.01) compared with uncontaminated soil.HandUvalues were lower in crude oil-contaminated soil than in uncontaminated soil, and 1/Dwas higher in crude oil-contaminated soil than in uncontaminated soil. This phenomenon was likely due to the stimulating effect of certain levels of crude oil on the growth of the dominant microbial community. The findings stated above provide a basis for bioremediation of oil-contaminated soil in the Loess Plateau in northern Shaanxi. These results are especially important because they indicated that the soil in the Loess Plateau in northern Shaanxi shows good potential for bioremediation, and crude oil contamination in the soil could be degraded by indigenous microbes with the addition of nitrogen and phosphorus. An additional benefit is that it leads to an improved evaluation of the bioremediation potential of the indigenous microbial consortia.
Loess Plateau; oil-contaminated soil; microbial community structure; community metabolic characteristics
国家自然科学基金(4087119, 41171203); 农业部“948”项目(2010-Z20); 陕西省科学院青年人才项目(2012K- 34); 陕西省科学技术研究发展项目(2014K01- 12-06)
2013- 12- 13;
日期:2014- 11- 03
10.5846/stxb201312132953
*通讯作者Corresponding author.E-mail: gujoyer@sina.com
甄丽莎, 谷洁, 胡婷, 吕睿, 贾凤安, 刘晨, 李燕.黄土高原石油污染土壤微生物群落结构及其代谢特征.生态学报,2015,35(17):5703- 5710.
Zhen L S, Gu J, Hu T, Lü R, Jia F A, Liu C, Li Y.Microbial community structure and metabolic characteristics of oil-contaminated soil in the Loess Plateau.Acta Ecologica Sinica,2015,35(17):5703- 5710.

