鱼腥草素钠联合阿奇霉素对金黄色葡萄球菌生物被膜早期黏附的影响
濮燕屏, 程惠娟, 段强军, 黄卫锋
(安徽中医药大学,安徽合肥230038)
鱼腥草素钠联合阿奇霉素对金黄色葡萄球菌生物被膜早期黏附的影响
濮燕屏, 程惠娟*, 段强军, 黄卫锋
(安徽中医药大学,安徽合肥230038)
目的研究鱼腥草素钠(sodium houttuyfonate,SH)联合阿奇霉素(azithromycin,AZM)对金黄色葡萄球菌生物被膜早期黏附的影响。方法微量倍比稀释法测定鱼腥草素钠和阿奇霉素对金黄色葡萄球菌的最小抑菌浓度 (minimum inhibitory concentration,MIC);连续稀释法行活菌计数,测定1 MIC鱼腥草素钠、1 MIC阿奇霉素单药组和1/2 MIC鱼腥草素钠+1/2MIC阿奇霉素联合组对金黄色葡萄球菌生物被膜黏附的影响;结晶紫染色法评价不同浓度鱼腥草素钠和阿奇霉素单用及联合组对金黄色葡萄球菌早期生物被膜生长量的影响;扫描电镜 (SEM)观察各药物组对金黄色葡萄球菌生物被膜形态的影响。结果鱼腥草素钠和阿奇霉素对金黄色葡萄球菌的MIC分别为64、0.25 mg/L。鱼腥草素钠联合阿奇霉素联合用药组能增强阿奇霉素对生物被膜早期黏附的清除作用,尤以2MIC药物浓度联合组作用最强 (与阴性对照组比较P<0.001)。电镜下观察细菌数及形态也验证了上述结果。结论鱼腥草素钠、阿奇霉素可减少金黄色葡萄球菌的早期黏附,抑制生物被膜的形成,联合用药后对金黄色葡萄球菌生物被膜的抑制具有协同作用,预期两药联合使用可以提高生物被膜相关感染的临床疗效。
金黄色葡萄球菌;生物被膜;鱼腥草素钠;阿奇霉素;黏附作用
分布广泛的革兰氏阳性细菌金黄色葡萄球菌(Staphylococcus aureus)是一种人兽共患的重要致病菌,常引起皮肤黏膜及多种组织器官的化脓性炎症。据统计,有20%~25%人群是金黄色葡萄球菌的长期宿主,75%~80%人群是间歇性宿主[1-2]。近年来,随着医疗技术的发展,金黄色葡萄球菌可黏附于导尿管、人工心脏瓣膜等植入性医疗器材表面形成生物被膜 (biofi1m,BF)[3-5],而由细菌产生多聚复合物基质包绕自身形成的生物被膜可大大降低其对抗生素及消毒剂的敏感性,从而增强它的生存能力[6]。临床上单一抗生素对于金黄色葡萄球菌生物被膜的治疗效果欠佳,而两种抗生素联用易诱导耐药性,鉴于此,以生物被膜为对象,进行定向药物研发已经成为解决金黄色葡萄球菌耐药性及其生物被膜相关感染的热点,但有关中药及其有效成分对金黄色葡萄球菌生物被膜的形成与影响的研究鲜有报道。本课题组前期发现,中药有效单体鱼腥草素钠(sodium houttuyfonate,SH)能显著抑制生物被膜形成,并对抗生素破坏生物被膜形成有较好的增敏和协同作用[7-8]。本研究旨在通过观察鱼腥草素钠联合阿奇霉素(azithromycin,AZM)对金黄色葡萄球菌早期生物被膜的作用,以期为中药治疗金黄色葡萄球菌生物被膜相关感染提供依据。
1 材料
1.1 菌株与药物 金黄色葡萄球菌标准株ATCC25923(中国食品药品检定研究院);鱼腥草素钠对照品 (中国食品药品检定研究院,100247-199601);阳性对照药阿奇霉素(辉瑞制药有限公司,批号J20090135)。
1.2 试剂和仪器 LB培养基、胰酶大豆肉汤培养基 (北京奥博星生物技术有限责任公司);结晶紫 (天津市光复精细化工研究所,分析纯);DPH-9162型电热恒温培养箱(上海一恒科技有限公司);紫外分光光度计;SpectraMax M2e多功能酶标仪 (美谷分子仪器上海有限公司);Sirion200型场扫描电镜 (美国FEI公司)。
2 方法
2.1 鱼腥草素钠及阿奇霉素对金黄色葡萄球菌最低抑菌浓度(minimum inhibitory concentration,MIC)的测定 按照文献方法并改进[9],鱼腥草素钠和阿奇霉素分别用 MH(B)培养基稀释成11个质量浓度梯度,分别为256、128、64、32、16、8、4、2、1、0.5、0.25 mg/L和32、16、8、4、2、1、0.5、0.25、0.125、0.062 5、0.031 25 mg/L。向各96孔平底微量培养板中加入0.5 Mc菌液100μL。另设1个不含药培养基作为阴性对照,37℃孵育24 h后观察结果,以无菌生长的最大稀释浓度为MIC,试验重复3次。
2.2 药物对金黄色葡萄球菌黏附作用的影响 分别设鱼腥草素钠、阿奇霉素单药组,联合用药组,阴性对照组。取6孔无菌培养板,每孔加入1片无菌医用滤膜和2 mL TSB培养基和200μL的1×104CFU/mL的金黄色葡萄球菌菌体混悬液,各组加入相应浓度的药物。鱼腥草素钠、阿奇霉素单药组药物浓度为1MIC,联合用药组使用浓度为1/2MIC鱼腥草素钠+1/2MIC阿奇霉素,阴性对照组加入不含药物培养基,分别在培养6、8、12、24 h后取出滤膜,用无菌PBS清洗浮游菌,将滤膜置于无菌试管中加入5 mL生理盐水,超声中震荡 (超声频率40 kHz)20 min,连续稀释法倾注培养计算活菌数,观察各药物在不同时间段对细菌黏附清除后的活菌量,实验重复3次。
2.3 药物对金黄色葡萄球菌早期生物被膜生长量的影响
按文献方法[10]将实验分成鱼腥草素钠、阿奇霉素 2、1、1/2、1/4、1/8、1/16和1/32 MIC药物浓度单药组,及1/2 MIC鱼腥草素钠分别与阿奇霉素2、1、1/2、1/4、1/8、1/ 16和1/32 MIC药物浓度联合组,另设不含药物空白组为阴性对照 (n=4)。96孔板中,每孔中加入调整好的金黄色葡萄球菌悬液200μL,37℃静置孵育6、8、12、24 h PBS清洗浮游菌,自然晾干后以0.1%结晶紫染色20 min,吸弃结晶紫,PBS清洗,30%冰乙酸脱色,静置15 min后用紫外分光光度计测定492 nm处吸光度A。以阴性组A为100%生物被膜,换算各药物组生物被膜生长量计算抑制百分率。
2.4 药物对金黄色葡萄球菌黏附作用的形态学观察 将无菌玻片置于6孔板中,分别加入2mL含菌TSB培养基,试验分别以1MIC鱼腥草素钠、1MIC阿奇霉素为给药浓度,1/2 MIC鱼腥草素钠+1/2 MIC阿奇霉素为联合给药浓度,于37℃静置培养12 h,用镀银染法染色后扫描电镜下观察细菌形态的变化以判断各种药物的作用效果[11]。
2.5 数据处理 采用SPSS 11.0软件进行两独立样本方差分析,数据以表示,组间比较采用t检验,P<0.05为有统计学意义。
3 结果
3.1 药物对金黄色葡萄球菌的MIC测定 鱼腥草素钠对金黄色葡萄球菌的MIC为64 mg/L,阿奇霉素对金黄色葡萄球菌的MIC为0.25mg/L。
3.2 药物对金黄色葡萄球菌黏附作用的影响 图1所示,1 MIC鱼腥草素钠、1 MIC阿奇霉素和1/2 MIC鱼腥草素钠+1/2MIC阿奇霉素药物浓度分别作用6、8、12、24 h。阴性对照组无药物处理。结果显示联合用药组相对于单药组清除金黄色葡萄球菌黏附作用明显增加。

图1 阿奇霉素单药组及联合组对金黄色葡萄球菌黏附的影响
3.3 药物对金黄色葡萄球菌早期生物被膜生长量的影响
本研究选用了6、8、12、24 h共4个时间点作为不同药物浓度对金黄色葡萄球菌生物被膜抑制作用的观察,图2提示随着药物浓度的增加,不同时间段鱼腥草素钠单药组对金黄色葡萄球菌生物被膜生长均有抑制作用,其中以2× MIC抑制作用最强,与阴性对照组比较P<0.001。6 h时抑制率为68.75%,8 h时为85.33%,12 h时为68.75%,24 h时为58.82%。

图2 鱼腥草素钠单药组对金黄色葡萄球菌生物被膜生长量的影响 (,n=4)
图3提示阿奇霉素各单药组及各药物浓度联合组在不同时间段对金黄色葡萄球菌生物被膜生长均有抑制作用,随着培养时间的增加阴性对照组的生物膜量逐渐增加,用药组的生物膜量增加缓慢,且鱼腥草素钠与阿奇霉素联合使用时似乎更能清除生物膜量。例如用药6 h时,最低浓度1/32 MIC联合组从单药组抑制率30.38%增加到57.14%,最高浓度2 MIC联合组从单药组抑制率57.14%增加到70.24%,抑制作用的增强呈药物剂量依赖性。
3.4 药物对金黄色葡萄球菌黏附作用的形态学观察 扫描电镜下观察到药物对细菌的黏附清除作用明显,对照组中能够看到大量菌体存在和一些菌体分泌物清晰可见,然而药物作用组中,细菌的黏附能力受到不同程度的减弱,并且无分泌物的存在,与对照组对比鲜明,联合用药组对于金黄色葡萄球菌的抑制作用最为明显。见图4。
4 讨论
细菌产生耐药性的主要原因之一是生物被膜的形成。生物被膜是细菌为适应环境利于生存的一种群居生活现象,包括有细菌的黏附、发展、成熟和播散等阶段[12]。生物被膜的结构特异性使得细菌能够阻碍或延缓抗生素的通透,从而提高自身的耐药性及免疫逃避性。有研究表明生物被膜细菌对抗生素的抵抗力是浮游细菌的十倍乃至上千倍[13]。传统抗生素对细菌生物被膜引起的慢性和反复性感染效果欠佳,因此,临床上细菌生物被膜感染常表现为反复发作及愈后差等特点。如何治疗由细菌生物被膜引起的难治性感染已成为临床相当棘手的问题。细菌形成生物被膜的机制虽然相当复杂,但黏附于器官及介质表面是引起感染的第一步。不能牢固定植于宿主器官或组织表面的细菌,容易被血液及其他体液冲刷因而不能形成感染,故是否能抑制生物被膜黏附是评判一个药物治疗细菌感染的重要指标之一[14]。
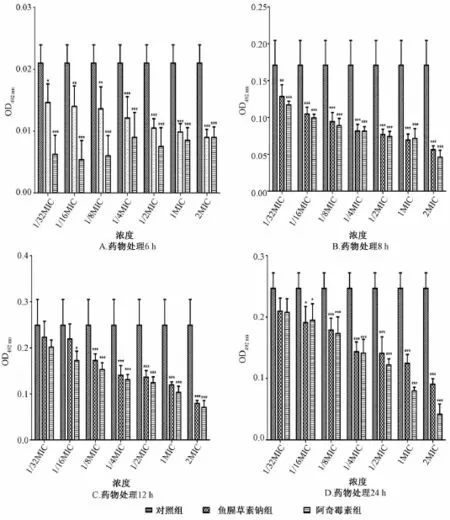
图3 阿奇霉素单药组及联合组对金黄色葡萄球菌生物被膜生长量的影响 (,n=4)

图4 扫描电镜观察药物12 h对金黄色葡萄球菌黏附的影响
目前国内外抗生物被膜的研究局限于抗菌西药的单独使用和抗菌药与抗菌药或非抗菌药的联合使用,但鲜见有中药与抗生素联用抗生物被膜的研究。中药鱼腥草性味辛、寒,具有清热解毒、消肿排毒、健脾、利尿通淋等功效,其主要活性成分鱼腥草素钠生物活性高、毒性低[15]。而临床常见的阿奇霉素对金黄色葡萄球菌悬浮菌和生物被膜具有较好的抗菌活性[16]。因此,本实验选用阿奇霉素作为阳性对照药,设计了6、8、12、24 h 4个不同时间点,观察鱼腥草素钠单独用药及联合用药对金黄色葡萄球菌早期生物被膜的影响。实验结果表明一定浓度的鱼腥草素钠对金黄色葡萄球菌早期生物被膜具有抑制作用,能减少生物被膜的早期黏附,且随着药物浓度的增加抑制作用增强,尤以2 MIC联合用药组抑制作用最强,活菌计数较阴性对照组及阿奇霉素组均明显减少,由此推测鱼腥草素钠具有增强阿奇霉素对生物被膜的渗透及杀菌作用。
抗菌药的长期使用易产生耐药性,中药体外实验抗菌作用虽弱于抗生素,但却有着不易耐药、副作用小、效果持久等优势,近年来有研究表明清热解毒的中药也有抗生物被膜的作用[17-18]。由于生物被膜的形成过程涉及环节多,且结构复杂,两种药物的联合可能是作用于同一靶点或不同靶点,但其具体的机制尚不明确。因此,在今后除了尝试中西用药结合,发挥优势互补之外,对其联合用药过程中对生物被膜的具体作用机制亟待于深入研究。
[1]Harmsen M,Lappann M,Knoche1S,et al.Ro1e of extrace11uar DNA during biofi1m formation by Listeramonocytogenes[J].Appl Environ Micobiol,2010,76(7):2271-2279.
[2]Singha1D,Foreman A,Jervis-Bardy J,et al.Staphylococcus aureus biofi1ms:Nemesis of endoscopic sinus surgery[J].Laryngoscope,2011,121(7):1578-1583.
[3]Otto M.Staphy1ococca1biofi1ms[J].Curr Top Microbiol Immunol,2008,322:207-228.
[4]Kwon A S,Park G C,Ryu SY,etal.Higher biofi1m formation in mu1tidrug-resistant c1inica1 iso1ates of Staphylococcus aureus[J].Int JAntimicrob Agents,2008,32(1):68-72.
[5]Richards J J,Me1ander C.Contro11ing bacteria1 biofi1ms[J]. Chem Bio Chem,2009,10(14):2287-2294.
[6]Ceri H,O1son M E,Turner R J.Needed,new paradigms in antibiotic deve1opment[J].Exper Opin Pharmacother,2010,11(8):1233-1237.
[7]Shao J,Cheng H,Wang C,et al.A phytoanticipin derivative,sodium houttuyfonate,induces in vitro synergistic effects with 1evof1oxacin against biofi1m formation by Pseudomonas aeruginosa[J].Molecules,2012,17(9):11242-11254.
[8]Shao J,Cheng H,Wang C,et al.Sodium houttuyfonate,a potentia1 phytoanticipin derivative of antibacteria1 agent,inhibits bacteria1attachment and pyocyanine secretion of Pseudomonas aeruginosa by attenuating f1age11a-mediated swimming moti1ity[J].World J Microbiol Biotechnol,2013,29(12):2373-2378.
[9]Wiegand I,Hi1pert K,Hancock R E.Agar and broth di1ution methods to determine the minima1 inhibitory concentration(MIC)of antimicrobia1 substances[J].Nat Protoc,2008,3(2):163-175.
[10]O'Too1e G A.Microtiter dish biofi1m formation assay[J].J Vis Exp,2011,30(47):2437.
[11]Passarie11o C,Ber1utti F,Se1an L,et al.A rapid staining procedure to demonstrate g1ycoca1yx production and bacteria1biofi1ms[J].New Microbiol,1994,17(3):225-230.
[12]屈常林,高 洪,赵宝洪,等.细菌生物被膜与抗生素耐药机制研究进展[J].动物医学进展,2008,29(3):86-90.
[13]Gun W,Satu S.Microbia1 contaminants&contamination routes in food industry[M].ESPOO,Fin1and,2007.
[14]李 彤,庄 辉.细菌生物膜的研究进展[J].中华微生物学和免疫学杂志,2002,22(3):343-346.
[15]官 妍,李 春,石晶金,等.亚抑菌浓度鱼腥草素钠及与红霉素联合对表皮葡萄球菌生物被膜的作用[J].中国中药杂志,2013,38(5):731-735.
[16]邢明勋,贾生美,袁 鹏,等.阿奇霉素对金黄色葡萄球菌生物被膜的抑制作用[J].中国药科大学学报,2012,43(6):553-559.
[17]程惠娟,张昌峰,汪长中,等.鱼腥草素钠对铜绿假单胞菌生物被膜藻酸盐合成的影响[J].中成药,2013,35(3):455-460.
[18]程惠娟,杨 敏,汪长中,等.鱼腥草素钠增强亚胺培南抗铜绿假单胞菌生物被膜的作用[J].中国中药杂志,2014,39(2):296-299.
R966
B
1001-1528(2015)08-1813-05
10.3969/j.issn.1001-1528.2015.08.040
2014-12-29
国家自然科学基金项目 (81173629)
濮燕屏 (1983—)女,讲师,主要从事中药抗感染与免疫研究。Te1:(0551)65169163,E-mai1:65980935@qq.com
*通信作者:程惠娟 (1953—),女,教授,硕士生导师,主要从事中药抗感染与免疫研究。Te1:(0551)5169204,E-mai1:chenghuijuan53@sina.com

