采用Box-Behnken Desi gn优化玉米须总黄酮提取工艺*
王燕,赖普辉
(陕西国际商贸学院医药学院,陕西 咸阳712046)
玉米须,又称龙须,为禾本科玉蜀属植物玉米的花柱和柱头[1],其性平、味甘、无毒,具有利尿、平肝、利胆、抗氧化、增强免疫力、清除自由基等功效[2]。玉米须含有生物碱、黄酮、挥发油、维生素C、维生素K、甾醇及各种有机酸等多种活性成分[3~4],是2010版《中国药典》中药一部收录的品种之一,主要用于高血压、糖尿病、水肿、肾结石等疾病的治疗。玉米须中富含具备生理功能的活性物质黄酮。黄酮类物质具有抑菌、止血、抗氧化、保护心脑血管等作用,已引起人们的广泛关注[5]。玉米在中国种植广泛,玉米须长期以来被当作玉米生产中的副产物,仅有少量入药,其余均被丢弃,造成资源极大浪费。从玉米须中提取黄酮类物质,对其进行开发研究,具有广泛的开发前景[6]。
微波辅助提取法与超声波及传统提取方法相比,具有设备简单、高效、节能、污染小等的特点[7],广泛应用生化、食品、天然产物提取等领域。白建华等以微波辅助提取法对玉米须黄酮进行提取,采用正交实验法进行工艺优化,最终提取率为1.13%[8];张艳采用超声波加酶法提取玉米须黄酮,提取率1.26%[9];李侠等将超声波-双酶法结合提取玉米须黄酮,提取率为0.86%,比传统方法提取率高[10];周鸿立等采用正交实验法,对微波法和热回流法提取成熟期玉米须黄酮的工艺进行优化,提取率分别为 4.55%和 3.17%[11]。目前尚未见到响应曲面法优化玉米须总黄酮的微波辅助提取工艺的报道。
本研究以中国丰富的成熟期的玉米须资源为实验材料,采用响应曲面法中Box-Behnken Design(BBD)进行实验设计,对微波辅助法提取玉米须黄酮的工艺进行优化,为深度开发这一天然资源提供实验依据。
1 材料与方法
1.1 材料和仪器
玉米须 (成熟期),产地河南,购自西安药材市场,洗净、晒干、粉碎,干燥通风处保存。芦丁,购自中国 (长春)药品生物制品检定所。氢氧化钠、硝酸铝分析纯、亚硝酸钠、无水乙醇等均为国产分析纯。800型离心沉淀器 (上海手术仪器厂),旋转蒸发器RE-52型 (上海青蒲沪西仪器厂),电子分析天平FA型 (上海恒平科学仪器有限公司),循环水式真空泵SHZ-D(Ⅲ)型 (巩义市英峪仪器厂),电子恒温水浴锅DZKW-4型 (上海金桥科析仪器厂),电热真空干燥箱ZK-82A型(上海试验仪器厂有限公司),紫外可见分光光度计724型 (上海精密仪器有限公司)。
1.2 实验方法
1.2.1 玉米须总黄酮的提取
称取一定量粉碎的玉米须粉,加入一定浓度乙醇溶液,经微波提取后离心,取上层清液备用。
1.2.2 标准曲线的制作
精密称取0.155 0 g芦丁,用70%乙醇溶解后完全转入50 mL容量瓶中,定容。分别取对照品溶液0.0 mL、0.5 mL、1.0 mL、1.5 mL、2.0 mL、2.5 mL、3.0 mL于10 mL棕色容量瓶中,随后用70%乙醇补充至5.0 mL,0.30 mL 4%NaNO2溶液、摇匀、静置5 min后加入0.30 mL 10%的Al(NO3)3溶液,摇匀、静置6 min后加入1 mol/L的NaOH溶液4 mL,静置15 min,以70%乙醇定容至刻度。以70%乙醇为空白,在200~700 nm之间用紫外-可见光进行扫描,测定吸光度,以获取芦丁的最大吸收波长。在最大吸收波长下,以70%乙醇为空白,以不同浓度照品质量浓度C(mg/mL)为横坐标,吸光度值 (A)为纵坐标,绘制标准曲线。
1.2.3 样品的测定
采用硝酸铝-亚硝酸钠-氢氧化钠法,将精密移取0.5 mL提取液于10 mL量瓶中,以试剂空白作为参比,按照1.2.2方法进行测定,计算玉米须总黄酮提取率。
1.2.4 Box-Behnken 实验设计
单因素实验结果表明,影响玉米须总黄酮提取的主要因素:微波功率、提取时间和液固比,将其分别用A、B和C表示。根据响应曲面优化法中的Box-Behnken实验设计原理,对因素的高、中、低水平分别以+1、0、-1进行编码 (表1)。
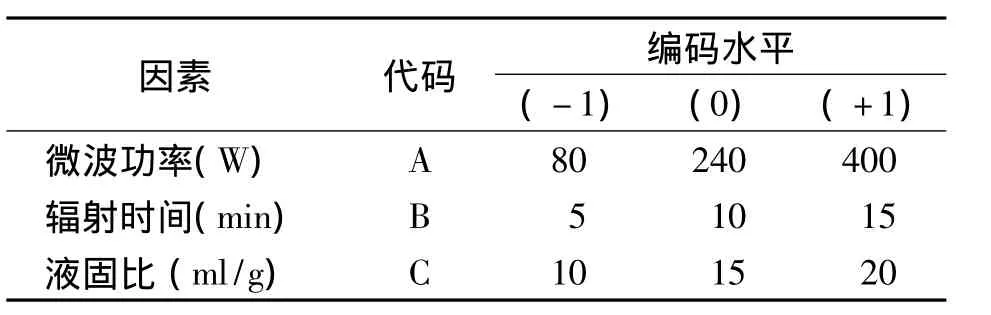
表1 BBD实验设计的因素与水平Tab.1 Experimental levels employed for Box-Behnken design
1.2.5 数据处理
采用用统计软件Design Expert 7.1.0对实验数据进行分析,建立实验模型,并进行相关的显著性检验。
2 结果与讨论
2.1 最大吸收波长的确定
按照1.2.2方法,在200~700 nm间对芦丁对照品溶液进行紫外可见光谱扫描,以波长为横坐标,吸光度为纵坐标的芦丁紫外吸收曲线 (图1)。可以确定的最大吸收波长为510 nm。
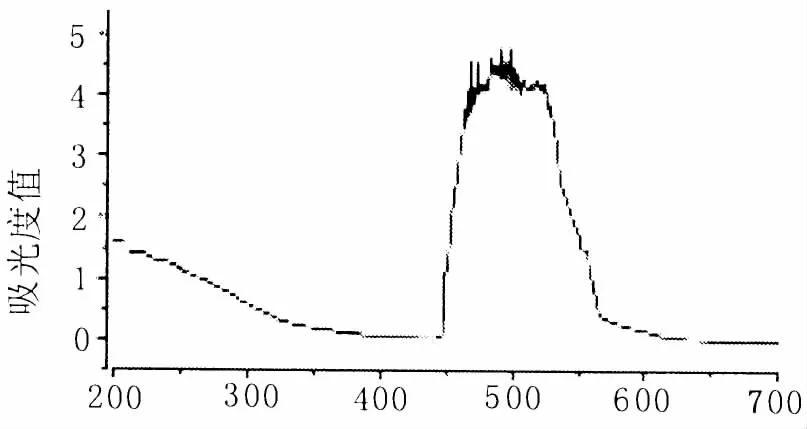
图1 芦丁紫外吸收曲线Fig.1 Rutin UV absorption spectrum
2.2 标准曲线的绘制
在最大吸收波长510 nm条件下,绘制对照品浓度与吸光度的标准曲线 (图2)。对图中的数据进行线性回归得卢丁对照品浓度C(mg/mL)与吸光度值 (A)的方程为 A=0.591C-0.001(R2=0.999 7),呈现良好的线性关系。
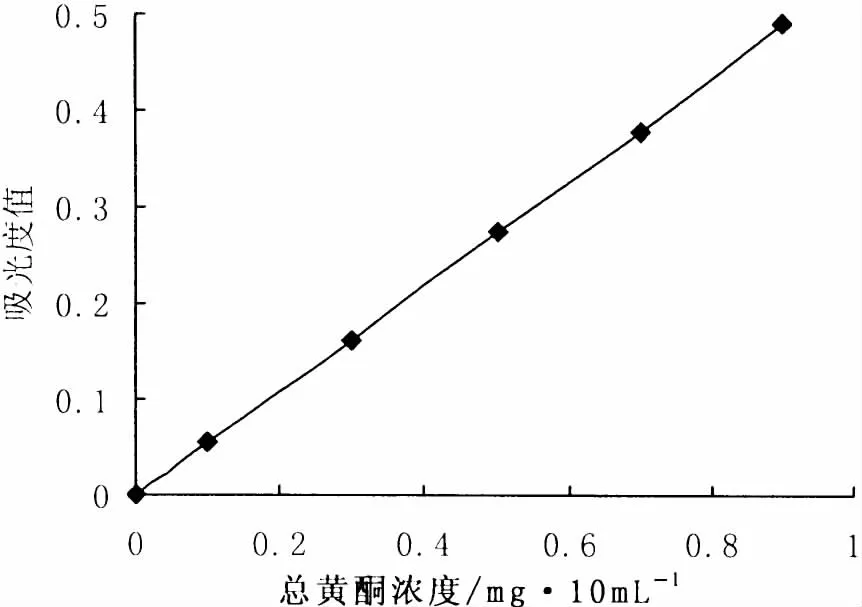
图2 卢丁标准品的标准曲线Fig.2 Standard absorbance curve of Luteolin
2.3 响应曲面实验结果与分析
2.3.1 响应曲面实验结果
按照响应曲面法的BBD设计方法,得到17个实验点的设计方案 (表2)。其中12个实验点为析因点,5个为零点。析因点为自变量取值在A、B、C所构成的三维顶点,零点为区域的中心点,重复试验5次,用以估算试验误差。
2.3.2 回归模型方程的建立及其显著性检验
以总黄酮提取率Y(%)为响应值,通过Design Expert 7.1.0软件对表2试验结果进行拟合分析,获得多元二次回归方程为:Y=1.367-0.081 A+0.117B-0.071C-0.041AB+0.141AC-0.120BC-0.382A2-0.433B2-0.409C2(R2=0.978 4)。
由于回归方程中各项系数绝对值大小反映了各因素对响应值的影响程度,则影响总黄酮提取率的因素大小顺序为B>A>C。为验证模型的有效性,进行方差分析和显著性检验 (表3)。
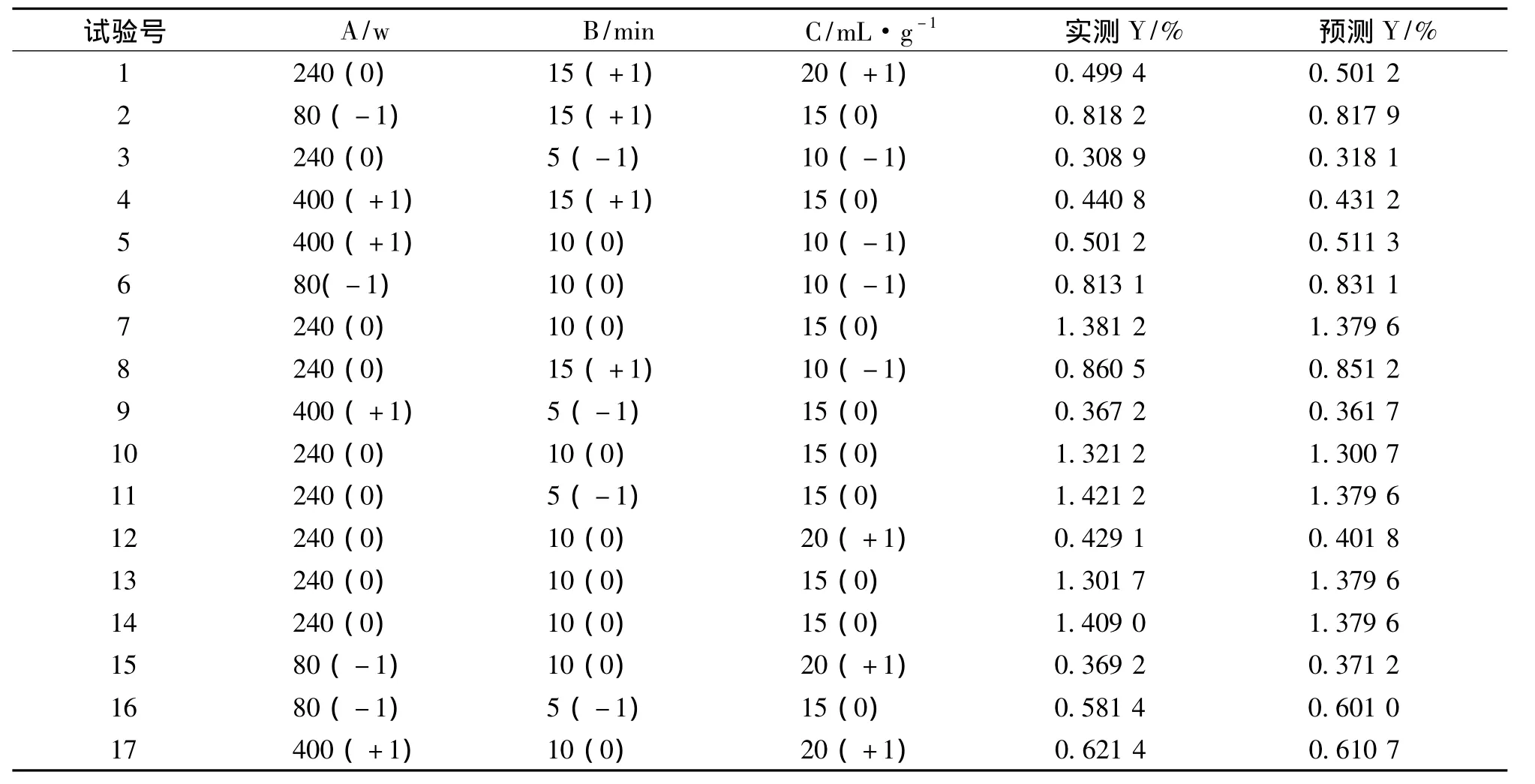
表2 BBD实验设计和实验结果Tab.2 Box-Behnken design and observed responses
模型的P值小于0.05,表明本研究采用的多元二次模型方程具有高度的显著性;失拟项P值为0.062 6,失拟不显著,表明实验误差小,方程拟合程度较好,该方程可以反映出真实的实验过程。相关系数反映各因素与响应值之间的真实关系,分析结果R2=0.978 4表明模型较好地反映了微波功率、提取时间、液固比等三个因素与黄酮提取率间的关系,即可以利用该模型分析和预测不同提取条件下总黄酮的提取率的变化。同时表明,一次项B、二次项A2、B2、C2对黄酮提取率影响极显著;交互项AC、BC对黄酮提取率影响显著。

表3 二次回归模型的方差分析结果Tab.3 Analysis result of variance(ANOVA)for the fitted quadratic polynomial model
2.3.3 响应曲面结果的优化
根据模型方程绘制响应曲面图和等高线图,分别考察微波功率、提取时间和液料比等三个因素对黄酮提取率的影响 (图3~5)。各组图分别直观的反映了各因素及交互作用对总黄酮提取率的影响。
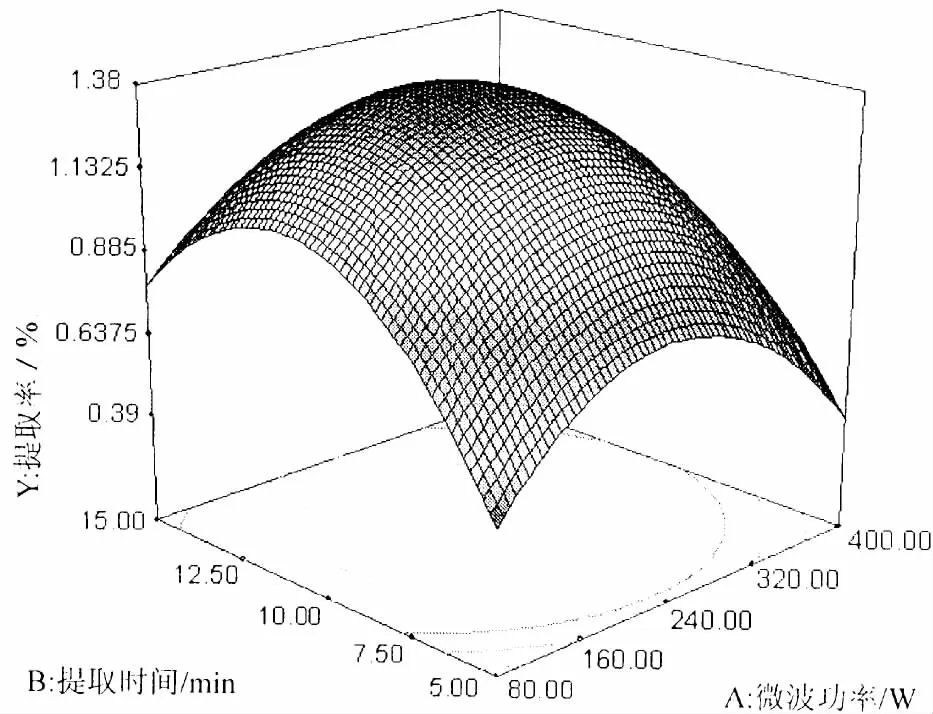
图3 微波功率和提取时间对玉米须总黄酮提取率影响的响应面和等高线图Fig.3 Response surface and contour plots showing the interactive effect of microwave power and extraction time on the extraction rate of total flavonoids
等高线图上,微波功率对提取率的影响曲线比较平缓,表明其对提取率的影响相对较小 (图3);提取时间对提取率的影响比较显著,呈现先升高后降低的趋势。两因素对提取率的影响并非直线关系,并且两因素的交互作用不显著,与方差分析结果一致。响应曲面图开口向下,表明在实验所选范围内存在极大值。可确定的最佳水平范围:微波功率为120~260 W。
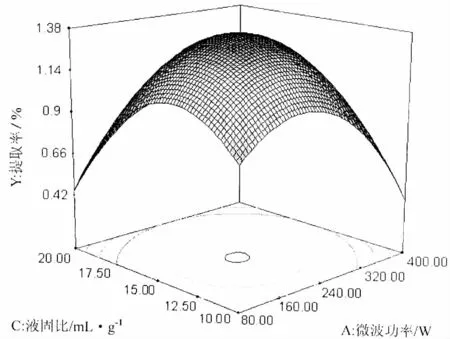
图4 微波功率和液固比总黄酮提取率影响的响应面和等高线图Fig.4 Response surface and contour plots showing the interactive effect of microwave power and liquid to sample ratio on the extraction rate of total flavonoids
微波功率和液固比对提取率的影响曲线均呈现先升高后降低的趋势 (图4),表明二者影响都较为显著,即二者交互作用显著。在实验所选范围内存在极大值。因此可确定的最佳水平范围:提取时间为8-13 min。
等高线上看出,液固比的影响曲线较提取时间的影响曲线较为平缓 (图5),表明提取时间对提取率的影响较液固比的影响更为显著。在实验范围内存在极值。可确定的液固比水平范围为:11~16 mL/g。
综合图3~5表明,因素对提取率的影响大小顺序为:B(提取时间) >C(液固比) >A(微波功率);因素的交互作用对提取率的影响顺序为:AC>BC>AB,与方差分析结果完全一致。
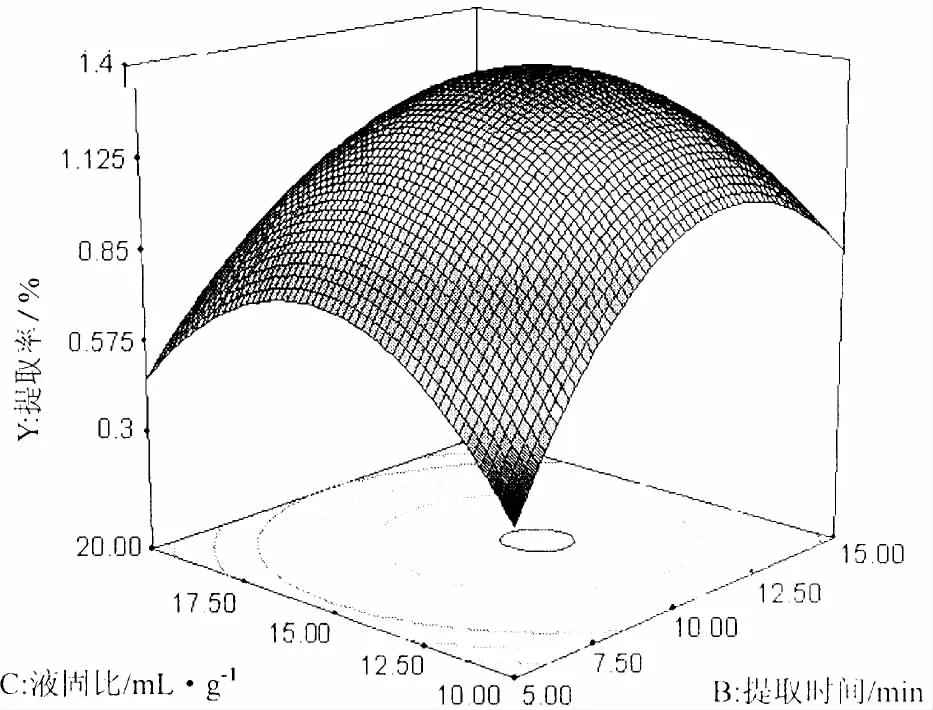
图5 提取时间和液固比对总黄酮提取率影响的响应面图Fig.5 Response surface and contour plots showing the interactive effect of extraction time and liquid to sample ratio on the extraction rate of total flavonoids
2.3.4 最佳工艺条件的确定
对模型方差进行求导计算。得到因素的最优水平分别为微波功率233.2 W,提取时间10.8 min,液固比14.1 mL/g,在该条件下玉米须中总黄酮的提取率为1.421%。考虑到实际操作的情况,将微波功率调整为240 W、提取时间为11 min、液料比14 mL/g,在该条件下平行提取3次,最终得到玉米须总黄酮的实际提取率为1.401%,模型理论预测值为1.432%,偏差仅2.17%。
3 结论
本研究基于微波辅助法的提取优点,以中国资源丰富的成熟期玉米须为研究对象,对陕产玉米须(成熟期)中总黄酮进行了微波辅助法提取,并采用响应曲面法进行了工艺优化,结合实际提取条件,得到玉米须总黄酮的最优提取条件,该工艺下均比文献报道的提取方法总黄酮提取率高。为进一步开发中国资源丰富的玉米须资源提供了参考。
[1]周鸿立,张艳,张扬,等.玉米须的开发利用前景[J].江苏农业科学,2011,39(3):508-509.
[2]陈耀章,马琴国.玉米须降糖、降压、降脂、保肝作用研究[J].中医研究,2014,3:20-22.
[3]刘传水,太志刚,李爱梅,等.云南产玉米须的化学成分研究[J].天然产物研究与开发,2011(12):40-42.
[4]徐燕,邹忠梅,梁敬钰.玉米须的化学成分[J].中国天然药物,2008(5):237-238.
[5]周宗义.玉米须药理作用的研究近况[J].临床军医杂志,2012(6):1562-1565.
[6]纪丽莲.玉米须的食疗价值与开发[J].中国野生植物资源,1997,16(3):24-25.
[7]石国荣,饶力群.微波萃取技术在天然产物活性成分提取中的研究进展[J].化学与生物工程,2003(6):4-6.
[8]白建华,赵昀,郭晓霞.微波辅助提取玉米须黄酮工艺研究[J].中国农学通报,2010,26(2):71-73.
[9]张艳,刘杰,周静姝.超声波加酶法提取玉米须黄酮的工艺研究[J].西北药学杂志,2012,4(2):98-100.
[10]李侠,马艳梅,孙慧娟,等.超声波-双酶法协同提取玉米须黄酮工艺的优化[J].西北农林科技大学学报(自然科学版),2014(4):223-227.
[11]周鸿立,董卫权,肖振晶,等.微波法提取玉米须总黄酮的工艺研究(英文)[J].时珍国医国药,2011,22(2):483-486.

