固相法合成xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2
景其鸣,韩恩山,朱令之,张国伟
(河北工业大学化工学院,天津 300130)
富锂锰基固溶体材料xLi2MnO3·(1-x)LiMO2(M=Mn、Co、Ni1/3Mn2/3、Ni0.4Co0.2Mn0.4和 Ni1/3Co1/3Mn1/3等)因比容量高于250 mAh/g,成为研究热点[1]。锂含量和变价过渡金属得失电子量,决定了材料的理论比容量,改变过渡金属元素比,可提高镍钴锰三元富锂正极材料的性能。Z.J.He等[2]采用喷雾干燥法合成xLi2MnO3·(1-x)LiMn0.5Ni0.4Co0.1O2,当x=0.3时,产物在2.0~4.8 V以12.5 mA/g、25.0 mA/g和50.0 mA/g充放电,首次放电比容量分别为238 mAh/g、229 mAh/g和206 mAh/g。E.S.Han等[3]采用共沉淀法合成了MgO包覆的Li1.17Mn0.48Ni0.23Co0.12O2材料,以2%MgO包覆的材料在2.0~4.8 V以0.1 C循环,首次放电比容量为260.3 mAh/g,循环10次的容量保持率为99.5%。C.Yu等[4]采用熔融法合成了 xLi2MnO3·(1-x)LiMn1/3Ni1/3Co1/3O2,x=0.3的材料在2.0~4.8 V,以50 mA/g循环,首次放电比容量为223.67 mAh/g。以上研究中,为减少循环中层状结构向尖晶石结构的转变,三元相中的锰含量均较低,而提高锰含量,可降低材料的成本。
本文作者设计了镍钴锰三元相锰含量较高的富锂锰基正极材料 xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2(x=0.7、0.6、0.5和0.4),通过改变Li2MnO3相的含量(x),讨论富锂量对产物电化学性能的影响。
1 实验
1.1 xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2的制备
将0.575 4 g Ni(Ac)2·4H2O(天津产,AR)、0.575 9 g Co(Ac)2·4H2O(天津产,AR)和 3.569 9 g Mn(Ac)2·4H2O(天津产,AR)以20 ml无水乙醇(天津产,AR)为分散剂混合,再与0.999 4 g Li2CO3(天津产,AR)在SHQM-0.4L双行星式球磨机(连云港产)中以200 r/min的转速球磨(球料比20∶1)混合5 h;然后在120℃下烘干12 h,再在450℃下预烧5 h,最后在800℃下煅烧12 h,即得到x=0.5样品。
改变各金属盐的用量,采用相同的方法制得其他材料。Ni(Ac)2·4H2O、Co(Ac)2·4H2O、Mn(Ac)2·4H2O 和 Li2CO3的质量在制备x=0.7的样品时分别为0.358 7 g、0.358 9 g、3.823 3 g和1.090 5 g;制备x=0.6的样品时分别为0.468 9 g、0.469 6 g、3.695 4 g和1.044 5 g;制备x=0.4的样品时分别为 0.674 1 g、0.675 0 g、3.486 4 g 和 0.942 6g。
1.2 电池的组装
将制备的正极材料、乙炔黑(焦作产,AR)和聚偏氟乙烯(日本产,AR)按质量比 8∶1∶1充分混合,以 N-甲基吡咯烷酮(天津产,AR)为溶剂制成浆料,涂覆在16 μm厚的铝箔(广东产,AR)集流体上。将涂覆好的极片在120℃下干燥12 h,再冲成直径为0.8 cm的圆片(约含4 mg活性物质)。
以金属锂片(秦皇岛产,99.5%)为负极,Celgard 2400膜(美国产)为隔膜,1 mol/L LiPF6/EC+DMC+EMC(体积比1∶1∶1,韩国产,AR)为电解液,在手套箱内组装内径为15 mm、高为20 mm的模拟电池。
1.3 xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2的分析和性能测试
用D8-Fouse X射线衍射仪(德国产)分析样品的晶体结构,CuKα,波长0.154 06 nm,管流 150 mA、管压 40 kV,步长为0.02 °,扫描速率为6(°)/min。
用CT2001A电池测试系统(武汉产)进行恒流充放电测试,电压2.0~4.8 V,1.0 C=250 mA/g。用 CHI 660C电化学工作站(上海产)进行电化学阻抗谱(EIS)和循环伏安测试。EIS测试的频率为10 mHz~100 kHz,交流振幅为5 mV;循环伏安测试的电压为2.0~4.8 V,扫描速率为0.1 mV/s。
2 结果与讨论
2.1 xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2的结构
图1为 xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2材料的XRD图。
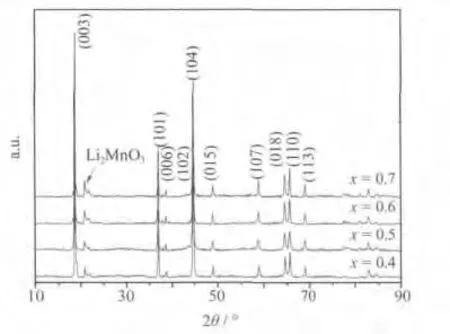
图1 xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2的XRD图Fig.1 XRD patterns of xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2
从图1可知,各材料具有相似的XRD图,均为典型的富锂锰基镍钴锰三元正极材料的特征。该正极材料的衍射峰可大致分为两组:强度较大且轮廓分明,可归属为六方晶系α-NaFeO2层状岩盐结构(空间群R-3m)的衍射峰;20°~25°范围内,由过渡金属层中Li和Mn超晶格排列引起,对应单斜晶系Li2MnO3结构(空间群为C2/m)的衍射峰。此外,各样品的(006)/(102)和(018)/(110)两组峰都有明显的分裂,说明合成的样品都具有良好的层状结构[5]。
为详细考察材料的晶体学特征,对样品的XRD数据进行拟合,所得的晶胞参数见表1。
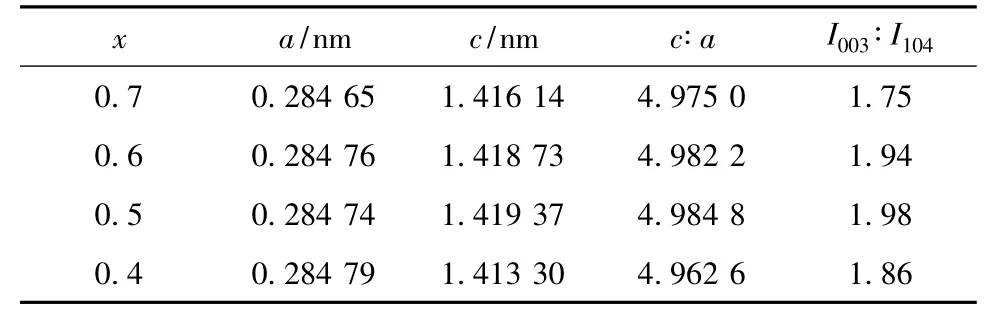
表1 xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2的晶胞参数Table 1 Lattice parameters of xLi2MnO3·(1-x)LiMn0.6Ni0.2 Co0.2O2
从表1可知,各样品的c/a均大于理想立方密堆积结构的特征值4.899,进一步表明各样品均具有良好的层状结构。(003)峰强度I003和(104)峰强度I104之比I003/I104可用来衡量正极材料中阳离子混排程度,I003/I104越大,阳离子混排程度越小[6]。表1中,各样品的I003/I104均大于1.2,证明所制备的xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2材料的阳离子混排程度较小[7]。x=0.5的样品,c/a与 I003/I104最大,表明二维结构稳定性更强,层状特征最明显,阳离子混排程度也最小。良好的层状结构及高度的离子有序度,能提供离子可逆嵌脱的通道,促进Li+的扩散,使材料表现较高的比容量及较好的循环稳定性。
xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2材料的0.1 C 首次充放电曲线见图2。

图2 xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2的首次充放电曲线Fig.2 Initial charge-discharge curves of xLi2MnO3·(1 - x)LiMn0.6Ni0.2Co0.2O2
从图2可知,首次充电过程中出现两个电压平台,显示了典型的富锂锰基三元正极材料特性。充电电压低于4.5 V时,出现随容量升高电压缓慢上升的区域,代表富锂材料中LiMn0.6Ni0.2Co0.2O2相Ni2+和Co2+的氧化及脱锂过程,遵循传统层状材料的嵌脱锂机理;在4.5 V附近出现一个平坦的电压平台,代表Li2MnO3相中脱锂伴随析氧(净脱出Li2O)形成层状MnO2的过程[8]。Li2MnO3相本身不具有电化学活性,但脱除Li2O后,能形成具有嵌锂活性的层状结构,可以提供较高的充电容量,并能在接下来的放电过程中提高放电容量,但Li2MnO3相脱除Li2O具有不可逆性,因此首次循环的库仑效率较低。在x由0.7下降至0.5的过程中,首次充电曲线的第1个电压平台随着x的降低而变长,与材料中LiMn0.6Ni0.2Co0.2O2相所占比例升高相对应;第2个电压平台呈先变长、后基本稳定的趋势,与Li2MnO3相含量变化的趋势不符。由此可知,单纯提高Li2MnO3相的含量,即富锂的程度,不能提高充放电容量,只有两相物质的量比为1∶1,才能确保固溶体材料具有良好的结构,使Li+更好地嵌脱。相比于其他样品,x=0.5的材料的首次充、放电比容量最高,分别为218.0 mAh/g和162.1 mAh/g,库仑效率为74.36%。
xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2材料的倍率性能见图3。动力电池领域大规模的应用,要求锂离子电池在高倍率下具有较高的容量。为了进行定量对比,将不同倍率下的平均放电比容量及容量保持率对放电倍率作图,所得结果见图4。
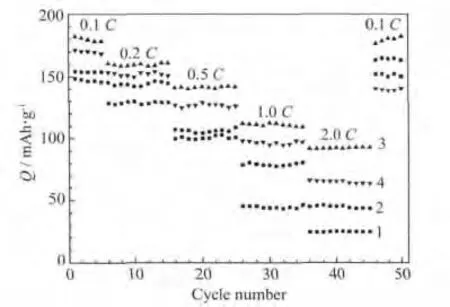
图3 xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2材料的倍率性能Fig.3 Rate capability of xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2
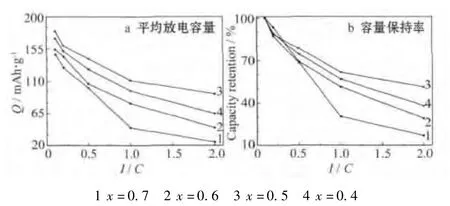
图4 xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2材料不同倍率下平均容量和容量保持率Fig.4 Average discharge capacity and capacity retention of xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2at different rates
从图3、图4可知,x=0.5的样品不仅各倍率下的平均放电比容量高于其他样品,而且容量保持率也较高,尤其是在较高的放电倍率下。x=0.5样品的1.0 C和2.0 C平均放电容量分别为110.9 mAh/g、92.3 mAh/g,分别为0.1 C平均放电比容量的61.64%、51.31%;x=0.7样品的1.0 C和2.0 C平均放电容量分别为44.5 mAh/g、24.7 mAh/g,分别为0.1 C平均放电比容量的30.27%、16.80%。这说明,x=0.5的样品具有最好的倍率性能。x=0.5时,电池在低倍率下的循环性能较好,0.1 C循环5次的容量保持率为97.91%。此外,电池在高倍率下循环后再以低倍率循环,放电比容量恢复得较好,说明电极材料具有良好的结构稳定性。
xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2材料的EIS见图5。
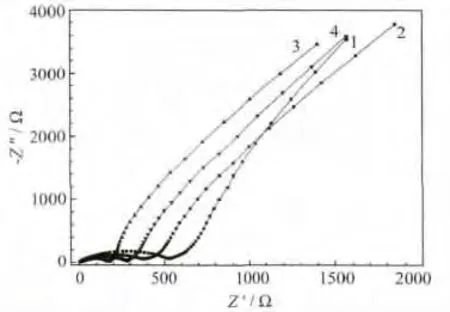
图5 xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2的 EISFig.5 Electrochemical impedance spectrum(EIS)of xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2
一般认为,Li+在电极中的嵌脱过程主要包括以下几个步骤:在电解液中的扩散、在多层固体电解质膜中的扩散、电荷转移和在活性材料体相中的扩散[9]。典型的层状富锂正极材料EIS主要由4部分组成:①超高频区域的溶液阻抗,即与Li+通过电解液、隔膜及导线等过程相关的欧姆电阻,表现为实轴上的一个点,以Rs表示;②高频区域,即与Li+通过活性材料颗粒表面绝缘层(固体电解质膜)过程有关的阻抗,表现为一个半圆弧,以一个RSEI/CSEI并联电路表示;③中频区域,即与电荷转移过程有关的阻抗,也表现为一个半圆弧,以一个Rct/Cdl并联电路表示;④低频区域,即与Li+在活性材料体相的固体扩散过程相关的阻抗,表现为一条斜线,以描述扩散过程的Warburg阻抗W表示。综合考虑上述过程,得到EIS拟合用的等效电路,见图6。

图6 EIS拟合用的等效电路Fig.6 Equivalent circuit to fit Nyquist plots
对EIS拟合所得的动力学参数见表2。
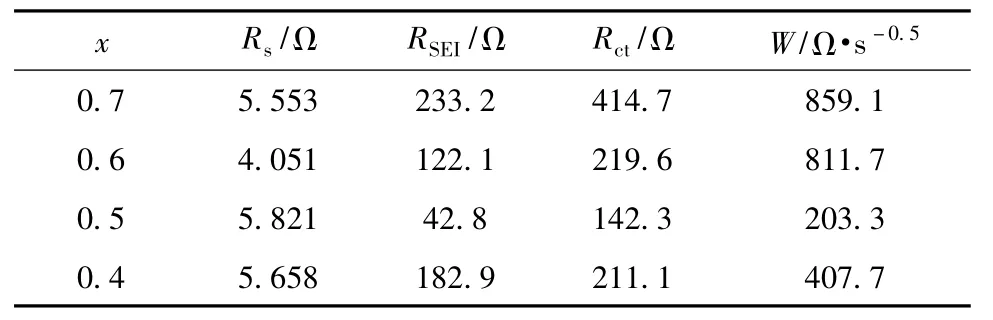
表2 对EIS拟合所得的动力学参数Table 2 Kinetic parameters obtained from fitting EIS
从表2可知,各样品的Rs相差不大,原因是组装电池所用的隔膜、电解液及组装环境相同。RSEI、Rct和W随着x的降低,都呈现先减小、后增大的趋势。x=0.5的样品,RSEI和W均最小,说明该样品更有利于Li+通过SEI膜及在体相材料中的扩散。这缘自XRD分析中所提到的具有良好的层状结构及高度的离子有序度。该样品的Rct也小于其他样品,表明电荷在电极界面间的转移更容易。
xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2材料的首次循环伏安曲线见图7。
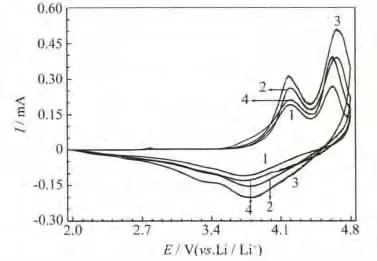
图7 xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2的循环伏安曲线Fig.7 CV curves of xLi2MnO3·(1-x)LiMn0.6Ni0.2Co0.2O2
从图7可知,各样品的首次循环伏安曲线形状相似,在2.0~4.8 V均有两对氧化还原峰。4.2 V附近的氧化峰对应LiMO2结构中Li+的脱出,伴随Ni2+/Ni4+的氧化;4.6 V附近的氧化峰对应Li2MnO3相的活化过程,即Li2MnO3相脱锂,伴随析氧的过程;3.8 V附近的还原峰与Ni4+的还原有关。氧化还原峰的电位差,是衡量电极极化程度的重要指标[10]。x=0.7、0.6、0.5 和 0.4 的样品,氧化还原电位差分别为0.455 V、0.432 V、0.407 V和0.512 V。使用x=0.5的样品制备的电池,在充放电过程中的电极极化最轻,表明该材料的结构稳定性最好,因此具有最好的倍率性能。
3 结论
以过渡金属乙酸盐和碳酸锂为原料,通过简单的固相法合成 xLi2MnO3·(1 - x)LiMn0.6Ni0.2Co0.2O2(x=0.7、0.6、0.5和0.4)材料,考察所合成材料的晶体学特征和电化学性能。
各样品均具有良好的六方晶系α-NaFeO2层状结构,x=0.5的样品0.5Li2MnO3·0.5LiMn0.6Ni0.2Co0.2O2具有最有序的六方层状结构及最好的电化学性能。向LiMn0.6Ni0.2Co0.2O2材料引入Li2MnO3相,可达到富锂的目的,从而提高材料的循环稳定性及放电比容量。当两相的物质的量比为1∶1时,可形成均一的固溶体材料,层状结构良好,阳离子混排程度较轻,放电比容量最高,循环稳定性最好。
[1]Jun W,Bao Q,Cao H L,et al.Electrochemical properties of 0.6Li[Li1/3Mn2/3]O2-0.4LiNixMnyCo1-x-yO2cathode materials for lithium-ion batteries[J].J Power Sources,2012,218:128 - 133.
[2]He Z J,Wang Z X,Guo H J,et al.Synthesis and electrochemical performance of xLi2MnO3·(1 - x)LiMn0.5Ni0.4Co0.1O2for lithium ion battery[J].Powder Technol,2013,235:158 - 162.
[3]Han E S,Li Y P,Zhu L Z,et al.The effect of MgO coating on Li1.17Mn0.48Ni0.23Co0.12O2cathode material for lithium ion batteries[J].Solid State Ionics,2013,255:113 - 119.
[4]Yu C,Wang H,Guan X F,et al.Conductivity and electrochemical performance of cathode xLi2MnO3·(1 - x)LiMn1/3Ni1/3Co1/3O2(x=0.1,0.2,0.3,0.4)at different temperatures[J].J Alloys Comp,2013,546:239 -245.
[5]Han E S,Jing Q M,Zhu L Z,et al.The effects of sodium additive on Li1.17Ni0.10Co0.10Mn0.63O2for lithium ion batteries[J].J Alloys Comp,2015,618:629 -634.
[6]Shi S J,Tu J P,Tang Y Y,et al.Synthesis and electrochemical performance of Li1.13Mn0.50Ni0.24Co0.12O2cathode materials for lithium ion batteries via freeze drying[J].J Power Sources,2012,221:300-307.
[7]LI Zhi-tong(李志同),ZHONG Yao-dong(钟耀东),ZHOU Fengrui(周凤瑞).0.5Li2MnO3·0.5Li[Mn0.45Ni0.45Co0.1]O2的合成及性能[J].Battery Bimonthly(电池),2012,42(4):193-195.
[8]Li F,Zhao S X,Wang K Z,et al.Structural and electrochemical performance of layered high-Mn cathode materials Li1+n[NimComMn1-2m]O2for lithium rechargeable batteries[J].Electrochim Acta,2013,97:17 -22.
[9]ZHUANG Quan-chao(庄全超),XU Shou-dong(徐守冬),QIU Xiang-yun(邱祥云),et al.锂离子电池的电化学阻抗谱分析[J].Progress in Chemistry(化学进展),2010,22(6):1 044 -1 057.
[10]ZHAO Ling(赵玲),HAN En-shan(韩恩山),ZHU Ling-zhi(朱令之),et al.前驱体合成条件对LiCo0.05Mn1.95O4性能的影响[J].Battery Bimonthly(电池),2013,43(4):211-214.

