UPLC-Q-TOF-MS法分析枇杷叶的倍半萜苷类化合物
赵 磊, 陈 剑, 印 敏, 任冰如, 李维林
(江苏省中国科学院植物研究所江苏省抗糖尿病药物筛选服务中心,江苏南京210014)
UPLC-Q-TOF-MS法分析枇杷叶的倍半萜苷类化合物
赵 磊, 陈 剑, 印 敏, 任冰如*, 李维林
(江苏省中国科学院植物研究所江苏省抗糖尿病药物筛选服务中心,江苏南京210014)
目的采用超高效液相-四级杆-飞行时间串联质谱(UPLC-Q-TOF-MS)技术对分离得到的枇杷叶总倍半萜苷类成分进行定性分析,并对其裂解途径进行研究总结。方法枇杷叶乙醇提取物经大孔树脂、聚酰胺柱色谱和RP-18柱色谱处理后,得到的枇杷叶总倍半萜苷采用Agilent ZORBAX SB-C18色谱柱(4.6mm×100mm,1.8μm),甲醇-0.1%甲酸水溶液为流动相进行梯度洗脱,ESI源负离子模式下采集质谱数据。结果从总倍半萜苷中得到5个倍半萜苷类化合物,其二级质谱裂解规律均相同,表现为逐个脱去寡糖链上的糖基,产生特征碎片离子m/z 675、529、383,最后生成m/z205的特征苷元碎片。结论其中2个倍半萜苷类成分可能是仅在苷元C-6和C-7位上构型有差异的loquatifolin A和6,7-cis-nerolidol-3-O-α-L-rhamnopyranosyl-(1→4)-α-L-rhamnopyranosyl-(1→2)-[α-L-rhamnopyranosyl-(1→6)]-β-D-glucopyranoside。
枇杷叶;倍半萜苷;UPLC-Q-TOF-MS;loquatifolin A;6,7-cis-nerolidol-3-O-α-L-rhamnopyranosyl-(1→4)-α-L-rhamnopyranosyl-(1→2)-[α-L-rhamnopyranosyl-(1→6)]-β-D-glucopyranoside
枇杷叶为蔷薇科植物枇杷Friobotrya japonica(Thunb.)Lindl.的干燥叶,是我国传统常用中药,具有清肺止咳,降逆止呕之功效,用于治疗肺热咳嗽、气逆喘急、胃热呕逆、烦热口渴等症状[1]。枇杷叶的主要成分为三萜酸[2-3]、倍半萜苷[4-6]、黄酮[7-8]、多酚[9]等。现代研究表明,枇杷叶具有显著的降血糖作用,所含的萜类成分可能是其主要活性基础物质[3,10]。目前,对枇杷叶三萜酸类化合物已开展了较为系统的研究[2-3,11-12],但对同样具有降血糖作用[13-14]的倍半萜苷类化合物研究相对较少。因此,深入考察该类化合物的结构对阐明其活性物质基础具有重要意义。
如今,从枇杷叶中分离鉴定出的倍半萜苷类化合物一般由苷元和寡糖链两部分组成。其中,苷元主要为橙花叔醇(nerolidol)或异旋花醇(isohumbertiol),而寡糖链一般由1~3个鼠李糖与葡萄糖的C′-2和 (或)C′-6位连接组成,但此类结构较为少见,迄今只在枇杷叶中发现。由于该类型倍半萜苷具有结构相似、连糖多的特点,因此分离和结构鉴定具有一定难度。近几年,迅速发展的超高效液相色谱(UPLC)与四级杆飞行时间质谱(QTOF-MS)联用技术在天然产物的研究中得以广泛应用,为快速分析天然产物中的有效成分,及加快寻找先导化合物的分析途径提供一个高效和切实可行的分析方法。本实验首先通过反复柱层析色谱分离得到枇杷叶总倍半萜苷,然后利用超高效液相-四级杆-飞行时间质谱(UPLC-Q-TOF-MS)技术,结合枇杷叶中已知化合物的相关信息,对倍半萜苷类成分进行分析,旨在总结其裂解规律,并发现未知倍半萜苷,为进一步研究该类化合物提供参考。
1 仪器与试药
1260UPLC-6530Q-TOF-MS,配有电喷雾离子源(ESI)及MassHunter 5.0工作站(美国Agilent Technologies公司)。
枇杷叶采自江苏省苏州市,由江苏省中国科学院植物研究所郭荣麟研究员鉴定为枇杷Friobotrya japonica(Thunb.)Lindl.的干燥叶,标本保存于江苏省中国科学院植物研究所标本馆 (编号328636)。枇杷叶倍半萜苷对照品nerolidol-3-O-α-L-rhamnopyranosyl-(1→4)-α-L-rhamnopyranosyl-(1→2)-[α-L-rhamnopyranosyl-(1→6)]-β-D-glucopyranoside(Ⅰ)和nerolidol-3-O-α-L-rhamnopyranosyl-(1→4)-α-L-rhamnopyranosyl-(1→2)-β-D-glucopyranoside(Ⅱ)(自制,纯度95%以上,化学结构式见图1);甲醇为色谱纯农残级(美国Tedia公司);甲酸为色谱纯 (美国ROE公司);水为屈臣氏蒸馏水 (屈臣氏集团有限公司);其他试剂均为分析纯 (国药集团化学试剂有限公司)。
2 方法与结果
2.1 样品制备 取干燥枇杷叶10 kg,粉碎,80%乙醇回流提取2次,合并提取液浓缩离心,取上清液,经 XAD16大孔树脂柱,水、40%、60%、90%乙醇梯度洗脱。之后,洗脱液经HPLC检测,与对照品Ⅰ、Ⅱ的紫外吸收和保留时间进行比对,发现倍半萜苷类化合物主要存在于60%乙醇洗脱部位。将该部位浓缩后进一步经聚酰胺柱色谱,水-乙醇梯度洗脱,HPLC和TLC跟踪检测后可知,经聚酰胺处理后的倍半萜苷主要集中于水洗部位。将该部位继续经RP-18柱色谱,水-甲醇 (50%、100%甲醇)梯度洗脱,得到纯化后的总倍半萜苷2.2 g(100%甲醇部位)。所得成分及对照品Ⅰ、Ⅱ用甲醇溶解,经0.45μm微孔滤膜过滤后进样分析。
2.2 分析条件
2.2.1 色谱条件 Agilent ZORBAX SB-C18色谱柱(4.6 mm×100 mm,1.8μm);流动相为甲醇(A)-0.1%甲酸水溶液 (B),梯度洗脱 (0~25 min,60%~68%A;25~35 min,68%~77%A);柱温35℃;体积流量0.5 mL/min;进样量10μL;检测波长210 nm。
2.2.2 质谱条件 电喷雾离子源 (ESI),负离子模式;质量扫描范围m/z100~1 500;毛细管电压3 500 V;碎裂电压180 V;干燥气 (N2)体积流量10 L/min;干燥气温度350℃;雾化气压力50 psi(1 psi=6.895 kPa);碰撞诱导解离(CID)能量40 eV;碰撞气为N2。实验数据采用Masshunter Qualitative Analysis(B.05.00)分析软件处理。
2.3 色谱分析 实验表明,枇杷叶醇提物经多种柱层析色谱处理后,有利于倍半萜苷的富集和进一步分析检测。利用UPLC-Q-TOF-MS法分析总倍半萜苷,发现在 “2.2.1”项条件下的混合物得到较好分离,其UPLC图及对应的总离子流色谱图见图2。通过与对照品Ⅰ、Ⅱ的紫外吸收光谱进行比对,并结合相对分子质量信息 (表1),可初步推断所得的总倍半萜苷中含有5个倍半萜苷类化合物(峰1~峰5),其余峰吸收相对较大,结合紫外吸收、高分辨率质谱和碎片离子,推断它们为非倍半萜苷类成分,值得进一步研究。

图2 总倍半萜苷的色谱图Fig.2 Chromatogram s of the m ixture of total sesquiterpene glycosides
2.4 质谱分析
2.4.1 一级质谱分析 以0.1%甲酸溶液为流动相,在负离子模式全扫描质谱图中,峰1~峰5均产生[M-H]-准分子离子峰和[M+HCOO]-加合离子峰,几乎没有碎片离子,故易于确定化合物的相对分子质量。其中,峰1和峰4为同分异构体,均产生[M-H]-离子(m/z 821.53)和[M+ HCOO]-离子 (m/z 867.54);峰3和峰5为同分异构体,均产生 [M-H]-离子 (m/z 675.46)和[M+HCOO]-离子(m/z721.47);峰2产生[MH]-离子(m/z 807.517 4)和[M+HCOO]-离子(m/z853.526 4)。
2.4.2 二级质谱分析 为进一步确定峰1~峰5所对应化合物的结构,通过质谱的碰撞诱导解离(CID)实验,获得二级质谱信息 (表1,碎片离子采用Costello命名法[15])。由于倍半萜苷化合物具有基本骨架相同和结构相似的特点,故比较其结构和质谱信息时发现,它们在软电离状态下均产生一系列糖苷键断裂的碎片离子 (以下研究中,m/z值用整数表示)。
对峰1和峰4的准分子离子[M-H]-(m/z 821)进行二级质谱研究,发现两者均产生碎片离子m/z675、529、383、291、205。由此可知,m/z675离子为母离子[M-H]-失去Rha残基(146 u)产生的碎片,即Rha为末端取代糖;进一步丢失1个Rha残基 (146 u)产生离子m/z 529和383,说明有3个Rha取代;继续丢失1个Glc-O残基(162 u+ 16 u),生成苷元碎片离子m/z205,表明Glc直接与苷元相连。另外,m/z 291离子显示有两个Rha直接相连(Rha-Rha)。综上所述,峰1和峰4均有3个Rha和1个Glc取代,糖体连接顺序如下。

表1 枇杷叶倍半萜苷的质谱数据Tab.1 M ass spectrometry data of sesquiterpene glycosides from the leaves of Eriobotrya japonica

与对照品比较发现,峰1的保留时间和二级质谱数据与对照品Ⅰ完全一致,因此确定峰1即为化合物Ⅰ。同时,结合文献 [4]可知,峰4与已知化合物loquatifolin A的分子质量和糖链结构一致,故推断峰4可能为6,7-trans-nerolidol-3-O-α-L-rhamnopyranosyl-(1→4)-α-L-rhamnopyranosyl-(1→2)-[α-L-rhamnopyranosyl-(1→6)]-β-D-glucopyranoside,与化合物Ⅰ仅在苷元C-6和C-7位上的构型有差异。
选择峰3和峰5的[M+HCOO]-离子(m/z 721)进行二级质谱研究,发现两者均产生碎片离子m/z675、529、383、205,与峰1和峰4基本相同,推断其裂解途径一致。经分析可知,m/z 675离子为母离子[M+HCOO]-丢失甲酸根产生的准分子离子[M-H]-;母离子丢失HCOOH和Rha残基 (46 u+146 u),产生碎片离子m/z529,表明Rha为末端取代糖;进一步丢失1个Rha残基(146 u),产生离子m/z383,说明只有2个Rha取代;继续丢失1个Glc-O残基 (162 u+16 u),产生m/z 205碎片离子,即为苷元的特征碎片离子,同时也显示Glc直接与苷元相连。另外,m/z 291离子只出现在峰3的二级图谱中,说明两个Rha直接相连(Rha-Rha)。综上所述,峰3和峰5均有2个Rha和1个Glc取代,但糖体连接顺序不同,如下所示。

将峰3和峰5的保留时间和二级质谱数据与对照品比较,发现峰3与对照品Ⅱ完全一致,因此确定峰3即为化合物Ⅱ。同时,结合文献 [5]可知,峰5可能为nerolidol-3-O-α-L-rhamnopyranosyl-(1→2)-[α-L-rhamnopyranosyl-(1→6)]-β-D-glucopyranoside。值得注意的是,先前报道的该成分为化合物Ⅰ的水解产物,而本实验表明,它在枇杷叶中也天然存在,其一级和二级质谱图见图3。
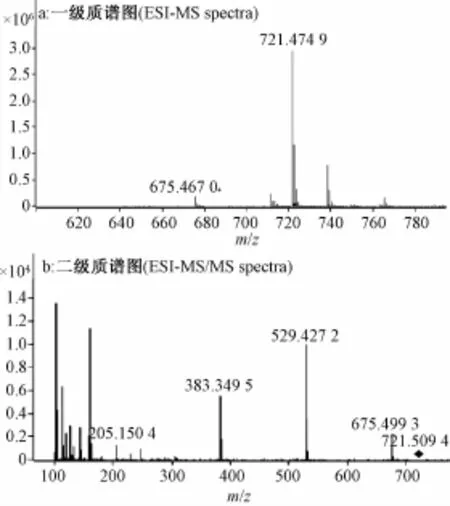
图3 峰5的一级 (a)和二级图谱 (b)Fig.3 ESI-M S spectra(a)and ESI-MS/MS spectra (b)of the peak 5
对峰2的准分子离子[M-H]-(m/z 807)进行二级质谱研究,发现亦产生碎片离子m/z 675、 529、383、205,说明与峰1和峰4存在相同的裂解途径。经分析考证,m/z675离子为母离子 [MH]-失去一个五碳糖残基 (pentose,132 u)产生的碎片,即为末端取代糖;进一步丢失1个Rha残基(146 u),产生离子m/z 529和m/z 383,说明有2个Rha取代;继续丢失1个Glc-O残基(162 u+16 u),产生苷元的特征碎片离子m/z205,表明Glc直接与苷元相连。另外,m/z 277离子说明末端五碳糖与1个Rha直接相连。综上所述,峰2有1个五碳糖、2个Rha和1个Glc取代,糖体连接顺序如下。

目前,枇杷叶橙花叔醇型倍半萜苷中尚未报道有五碳糖取代基存在,因此推测峰2可能为新化合物,值得进一步分离和鉴定,其一级和二级质谱图见图4。
3 结论
本实验利用UPLC-Q-TOF-MS分析技术对所得枇杷叶总倍半萜苷进行定性分析,同时鉴定出5个倍半萜苷类化合物成分,并发现了1个新倍半萜苷和1个新天然产物,这为进一步开发利用相关化合物提供了研究基础。从二级质谱图来看,这5个倍半萜苷类成分裂解途径相似,均为逐个脱去寡糖链上的糖基,最后生成m/z205的特征苷元碎片。这些碎片特征和裂解规律也将为结构相似的该类化合物苷元及糖链的结构解析提供重要依据。

图4 峰2的一级 (a)和二级图谱 (b)Fig.4 ESI-MS spectra(a)and ESI-MS/ MS spectra(b)of the peak 2
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:190-191.
[2]吕 寒,陈 剑,李维林,等.枇杷叶中三萜类化学成分的研究[J].中药材,2008,31(9):1351-1354.
[3]LüH,Chen J,LiW L,etal.Hypoglycemic and hypolipidemic effects of the total triterpene acid fraction from Folium Friobotryae[J].J Fthnopharmacol,2009,122(3):486-491.
[4]Yanagisawa H,Ohshima Y,Okada Y,et al.A sesquiterpene glycoside,loquatifolin A,from the leaves of Friobotrya japonica[J].Chem Pharm Bull,1988,36(4):1270-1274.
[5]De TommasiN,De Simone F,Aquino R P,et al.Plantmetabolites.New sesquiterpene glycosides from Friobotrya japonica[J].JNat Prod,1990,53(4):810-815.
[6]De TommasiN,Aquino R P,De Simone F,et al.Plantmetabolites.New sesquiterpene and ionone glycosides from Friobotrya japonica[J].JNat Prod,1992,55(8):1025-1032.
[7]Kawahara N,Satake M,Goda Y.A new acylated flavonol glycoside from the leaves of Friobotrya japonica[J].Chem Pharm Bull,2002,50(12):1619-1620.
[8]LüH,Chen J,LiW L,et al.Hypoglycemic effect of the total flavonoid fraction from Folium Friobotryae[J].Phytomedicine,2009,16(10):967-971.
[9]Ito H,Kobayashi E,Takamatsu Y,etal.Polyphenols from Friobotrya japonica and their cytotoxicity against human oral tumor cell lines[J].Chem Pharm Bull,2000,48(5):687-693.
[10]LiW L,Wu JL,Ren B R,et al.Pharmacological studies on anti-hyperglycemic effect of Folium Friobotryae[J].Am JChin Med,2007,35(4):705-711.
[11]吕 寒,陈 剑,李维林,等.枇杷叶中三萜酸类成分的提取工艺研究[J].时珍国医国药,2007,18(11):2791-2792.
[12]蔡雪萍,李振华,华俊磊,等.一测多评法测定枇杷叶有效部位中6种三萜酸成分的量[J].中草药,2013,44(21):3057-3062.
[13]De Tommasi N,De Simone F,Cirino G,et al.Hypoglycemic effects of sesquiterpene glycosides and polyhydroxylated triterpenoids of Friobotrya japonica[J].Planta Med,1991,57(5):414-416.
[14]Chen J,LiW L,Wu JL,etal.Hypoglycemic effects ofa sesquiterpene glycoside isolated from leaves of loquat(Friobotrya japonica(Thunb.)Lindl.)[J].Phytomedicine,2008,15(1):98-102.
[15]Domon B,Costello CE.A systematic nomenclature for carbohydrate fragmentations in FAB-MS/MS spectra of glycoconjugates[J].Glycoconjugate J,1988,5(4):397-409.
Analysis of sesquiterpene glycosides from loquat leaves by UPLC-Q-TOF-MS
ZHAO Lei, CHEN Jian, YIN Min, REN Bing-ru*, LIWei-lin
(Institute of Botany,Jiangsu Province and Chinese Academy of Sciences;Jiangsu Provincial Service Center for Anti-diabetic Drugs Screening,Nanjing 210014,China)
AIMTo analyze chemical constituents and fragmentation pathways of sesquiterpene glycosides isolated from loquat(Friobotrya japonica)leaves by ultra-performance liquid chromatography-quadrupole time-of-flight mass spectrometry(UPLC-Q-TOF-MS).METHODSAlcohol extract of loquat leafwas subjected to a variety of column chromatographies,then UPLC was performed on Agilent ZORBAX SB-C18column with methyl alcohol-0.1%formic acid in water asmobile phase in a gradient elution mode.Themass spectrometer equipped with electrospray ionization source was used as a detector under the negative ionmode.RESULTS5 sesquiterpene glycosides had similar fragmentation pathways.The cleavage was presented in consecutive lose in monosaccharide residue of oligosaccharide chain to give specific product ions at m/z675,529,383,finally yielding a signature aglycone ion at m/z205.CONCLUSIONThese characteristic fragmentationsmay be loquatifolin A and 6,7-cis-nerolidol-3-O-α-L-rhamnopyranosyl-(1→4)-α-L-rhamnopyranosyl-(1→2)-[α-L-rhamnopyranosyl-(1→6)]-β-D-glucopyranoside,which exist the difference only at6,7-C configuration.
loquat(Friobotrya japonica)leaves;sesquiterpene glycosides;UPLC-Q-TOF-MS;loquatifolin A;6,7-cis-nerolidol-3-O-α-L-rhamnopyranosyl-(1→4)-α-L-rhamnopyranosyl-(1→2)-[α-L-rhamnopyranosyl-(1→6)]-β-D-glucopyranoside
R284.1
:A
:1001-1528(2015)07-0000-00
10.3969/j.issn.1001-1528.2015.07.022
2014-08-22
国家自然科学基金项目 (21102058);江苏省自然科学基金项目 (BK20141387);江苏省科技基础设施建设计划—科技公共服务平台项目 (BM2011117)
赵 磊(1989—),男,硕士,从事天然药物化学研究。E-mail:zhaoleilearning@126.com
*通信作者:任冰如 (1964—),女,研究员,从事经济和药用植物资源的评价和开发利用。E-mail:bingruren@126.com
——结构和生物活性

