健康志愿者多剂量服用左金丸对CYP3A4活性的影响
刘松灿, 裘福荣, 缪 萍, 朱蕾蕾, 曾 金, 李秋月, 贺 敏, 蒋 健
(上海中医药大学附属曙光医院临床药理科,上海201203)
[临床]
健康志愿者多剂量服用左金丸对CYP3A4活性的影响
刘松灿, 裘福荣*, 缪 萍, 朱蕾蕾, 曾 金, 李秋月, 贺 敏, 蒋 健*
(上海中医药大学附属曙光医院临床药理科,上海201203)
目的研究健康受试者口服左金丸对细胞色素P450酶3A4(CYP3A4)活性的影响。方法采用随机开放两周期试验设计,16名健康受试者 (男女各半)口服左金丸7 d(每天2次,每次3 g)前、后再分别单剂量口服咪达唑仑15 mg,LC-MS/MS测定咪达唑仑及其代谢物1-羟基咪达唑仑在24 h内不同时间点的血药浓度,WinNonlin软件计算咪达唑仑及1-羟基咪达唑仑的主要药代动力学参数。结果服用左金丸前后,受试者血浆中咪达唑仑的Cmax分别为(138.44±62.55)ng/mL、 (132.99±64.74)ng/m L;AUC0-24分别为 (305.25±112.05)ng·h/mL、(343.68± 149.39)ng·h/mL;tmax分别为 (0.5,0.25-2)h、(0.5,0.25-3)h;t1/2分别为 (3.52±1.06)h、(3.99±1.30)h;清除率 (CL/F)分别为 (54.65±17.65)L/h、(49.74±17.88)L/h;Cmax代谢比分别为(0.60±0.24)、(0.42± 0.18);AUC0-24代谢比分别为 (0.53±0.18)、(0.41±0.14)。结论口服左金丸7 d对CYP3A4有弱抑制作用。
左金丸;细胞色素P450酶3A4;咪达唑仑;药物相互作用
随着中医药在临床上的广泛应用,中西药间的相互作用(herb-drug interaction)日益受到人们的关注。细胞色素P450 3A(CYP3A)是CYP主要亚家族,参与50%以上药物代谢,而左金丸与CYP3A4底物药联用在临床上十分普遍。左金丸为临床常用中成药,具有泻火疏肝和胃止痛的功效,临床上用于治疗肝火犯胃证[1-2],现代研究认为,左金丸具有镇痛、抗炎、抗溃疡,抑制胃液、胃酸、胃泌素分泌和胃蛋白酶活性,目前用于治疗各种胃病[3]。左金丸由黄连与吴茱萸质量比6∶1组成,其中有效成分为小檗碱、黄连碱、巴马汀、药根碱等黄连生物碱和吴茱萸碱、吴茱萸次碱等吴茱萸生物碱组成[1-2]。有报道黄连生物碱对人CYP3A4酶有轻度抑制作用[4],小檗碱具有轻度抑制人体内CYP3A4活性[5]。吴茱萸次碱在人肝微粒体中对CYP3A4有抑制作用[6-7]。Iwata报道吴茱萸次碱在人肝微粒体中具有机制性抑制作用[8]。所以选用健康志愿者口服CYP3A4体内探药马来酸咪达唑仑片进行左金丸对人体CYP3A4是否具有抑制作用的研究,该研究结果对临床合理使用左金丸具有指导作用。
1 材料、对象与方法
1.1 药品、试剂与仪器 左金丸,规格为每瓶18 g,批号120301(湖北诺得胜制药有限公司);马来酸咪达唑仑片 (商品名力月西),规格为每片15 mg,批号20111201(江苏恩华药业股份有限公司);咪达唑仑对照品 (纯度 >98%,批号171265-201001)、地西泮对照品 (内标,纯度 >98%,批号115-9302),均由中国食品药品检定研究院提供;1′-羟基咪达唑仑对照品,纯度>99%,批号59468858(美国Sigma公司)。甲醇和乙腈为色谱纯 (美国Tedia公司);甲酸和乙酸铵为分析纯 (国药集团化学试剂有限公司);实验用水为去离子水(美国Millipore公司超纯水系统制备)。
API 4000串联质谱仪,配置电喷雾离子化源(ESI)、三级四极杆质量分析器和Analyst 1.4.2数据处理软件(美国ABI/SCIEX公司);Agilent1200高效液相色谱仪,配置四元梯度泵、在线脱气机、自动进样器和柱温箱(美国Agilent公司);Thermo超低温冰箱(美国Thermo Fisher Scientific公司);XS-105电子天平(瑞士Mettler Toledo公司);Millpore-Q纯水系统(美国Millipore公司);Labconco离心浓缩仪(美国Labconco公司);Backman Allegra 64R高速冷冻离心机(美国Backman Coulter公司);漩涡混合器 (上海沪西分析仪器厂);电热恒温振荡水槽 (上海一恒科技有限公司)。
1.2 受试者选择 16名健康受试者,男、女各半,年龄 (24.38±1.96)岁,体质量 (60.6± 8.09)kg。试验前经血尿常规、血生化、胸片、心电图检查均未发现异常;受试者无药物过敏史和药物依赖史,无精神病史及其他慢性病史。试验前2周内未服任何药物。受试者均知情同意并签署知情同意书。
1.3 给药方案与血样采集 采用随机开放2周期试验设计[9-10],试验方案经上海中医药大学附属曙光医院医学伦理委员会批准。
受试者于试验前晚住院观察,禁食10 h后,于受试日早晨8点空腹口服马来酸咪达唑仑片15 mg,用温开水200 mL送服。服药后2 h自由饮水,4 h后统一进餐。试验期间禁烟、酒及含咖啡因的饮料,避免剧烈活动。
分别于服药前 (0 h)及服药后0.25、0.5、0.75、1、1.5、2、3、4、6、8、10、12、24 h采集上肢静脉血4 m L,置肝素化离心管中,3 000 r/min离心10 min,分离血浆,-80℃保存,待测。受试者自第2天起口服左金丸,每次3 g,每天2次,连续服用7 d,于第7天晚入住Ⅰ期病房。第8天早晨空腹口服马来酸咪达唑仑片15 mg和左金丸3 g,采血时间点、分离血浆及保存样本同前。
1.4 血浆中咪达唑仑及1-羟基咪达唑仑测定方法[11-12]
1.4.1 血浆样品处理 取血浆样本300μL,加入地西泮乙腈溶液 (内标100 ng/mL)10μL及1 mol/L NaOH 30μL,涡旋混匀30 s后,加入乙酸乙酯1.5 mL,涡旋振荡3 min,12 000 r/min离心10 min。转移上清液置于1.5 mL离心管中,55℃下氮气吹干,残渣用流动相100μL溶解,混匀后,12 000 r/min离心10 min,取上清液进入LC-MS/ MS分析。
1.4.2 色谱条件 Aglient Eclipse XDB-C18色谱柱(150 mm×4.6 mm,5μm);流动相为4 mmol/L乙酸铵和0.08%甲酸水溶液-甲醇 (30∶70);柱温30℃;体积流量0.8 m L/min;进样量10μL。
1.4.3 质谱条件 电喷雾离子源 (ESI);多反应检测 (MRM)模式扫描;极性正离子 (+);喷射电压 (IS)4 500 V,离子化温度 (TEM)400℃,喷雾气压(GS1)50 psi(1 psi=6.895 kPa),辅助气压(GS2)50 psi;咪达唑仑m/z326.4→291.2,去簇电压(DP)105.14 V,碰撞电压(CE)35.88 V,碰撞室射出电压 (CXP)13 V;1-羟基咪达唑仑m/z342.2→324.0,DP 91.05 V,CE 33V,CXP 17.94 V;内标地西泮m/z 285.2→193.1,DP 98.06 V,CE 43 V,CXP 12 V。
1.5 方法学考察 在上述色谱条件下,咪达唑仑、1-羟基咪达唑仑和内标 (地西泮)的保留时间分别为2.63、2.21和3.15 min,峰形良好,血浆中内源性物质及其他杂质不干扰测定。血浆中咪达唑仑及其代谢物1-羟基咪达唑仑的质量浓度线性范围分别为0.25~250 ng/mL和0.15~150 ng/mL,定量下限分别为0.25 ng/mL和0.15 ng/mL。线性回归方程分别为Y=1.66X+0.038 8(r=0.998 0)和Y=1.31X+0.036 8(r=0.996 5)。咪达唑仑和1′-羟基咪达唑仑的低、中、高3个质量浓度质控样品的日内、日间RSD均<15%,提取回收率>90%,无基质效应。咪达唑仑和1′-羟基咪达唑仑储备液于4℃存放1周、血样在室温中存放4 h、血样处理后在自动进样器放置24 h、3次反复冻融、-80℃长期保存2月时皆稳定,符合生物样品分析方法的要求。
1.6 数据处理与分析 试验数据采用WinNonlin软件(4.1版,美国Pharsight公司)计算药代动力学参数。达峰浓度Cmax和达峰时间tmax为实测值,末段消除斜率 (λ)为对数血药浓度-时间曲线末端直线部分的斜率,消除半衰期t1/2=0.693/λ,梯形法计算血药浓度-时间曲线下面积AUC0-t值和AUC0-∞值,清除率(CL/F)=D/AUC0-∞,D为服用的药物剂量。AUC的代谢比(MRAUC)为1-羟基咪达唑仑的AUC/咪达唑仑的AUC;Cmax的代谢比(MRCmax)为1-羟基咪达唑仑Cmax/咪达唑仑Cmax。
药代动力学参数数据均用x±s表示,tmax用(中位数,最小值-最大值)。Cmax、AUC0-t和AUC0-∞在经对数转换后,由SAS 9.3软件中的GLM程序进行方差分析,并计算口服左金丸7 d与基线相比的几何均值及其90%可信区间,等效区间设定:Cmax为70.00%~143.00%,AUC0-t和AUC0-∞为80.00%~125.00%。tmax采用Willcoxon符号秩检验分析,Cmax,AUC0-t,AUC0-∞,t1/2和CL/F采用配对t检验分析,显著标准为P<0.05。
2 结果
2.1 血药浓度-时间曲线 16名健康受试者口服左金丸7 d前、后单剂量服用CYP3A4探药马来酸咪达唑仑片15 mg后,咪达唑仑及1-羟基咪达唑仑的平均血药浓度-时间曲线见图1。
2.2 药动学参数 16名受试者口服左金丸7 d前、后单剂量服用马来酸咪达唑仑片 (15 mg)的咪达唑仑及其代谢物1-羟基咪达唑仑的主要药动学参数见表1。
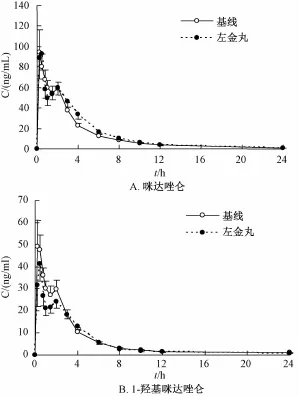
图1 咪达唑仑和1-羟基咪达唑仑的平均血药浓度-时间曲线Fig.1 Plasma concentration-time profiles ofm idazolam (A),and 1-hydroxylm idazolam(B)
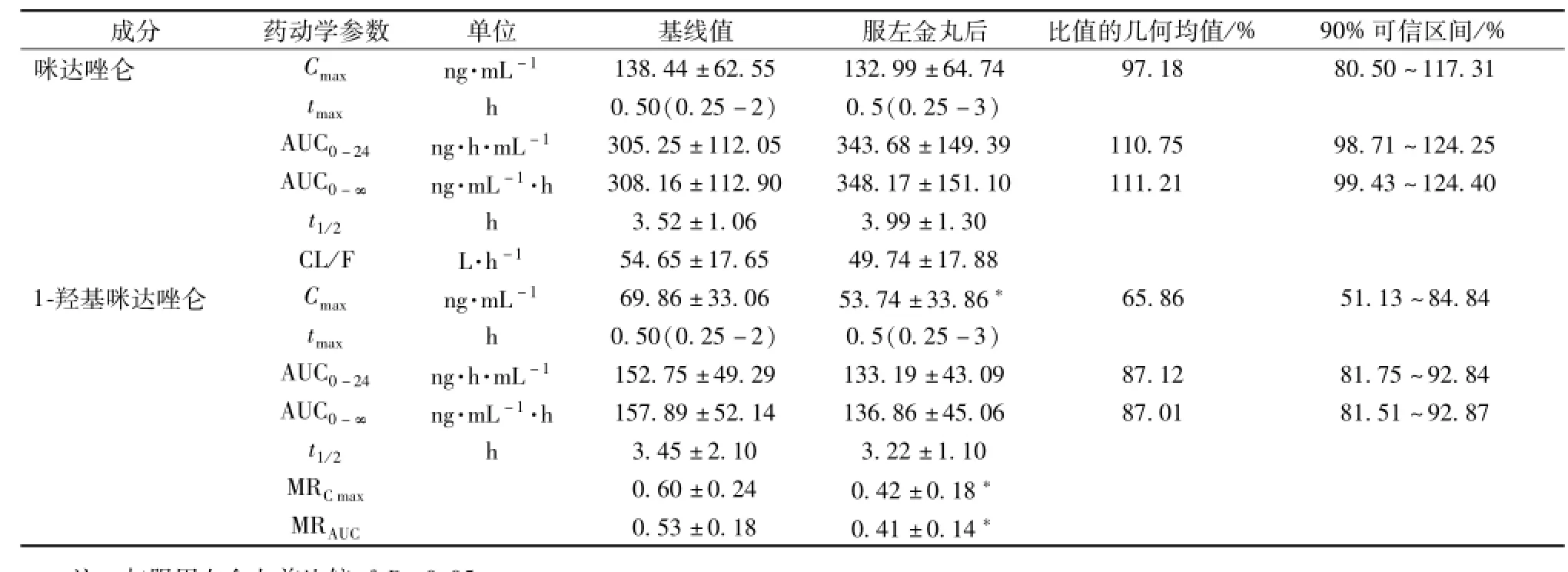
表1 咪达唑仑和1-羟基咪达唑仑的药代动力学参数Tab.1 Pharmacokinetics parameters ofm idazolam and 1-hyd roxylm idazolam
与服用左金丸前的基线相比,服用左金丸7 d后,咪达唑仑Cmax、AUC0-24、AUC0-∞、tmax、CL/ F和t1/2经统计分析差异无显著意义 (P>0.05),Cmax、AUC0-24、AUC0-∞90%可信区间在等效范围内,AUC0-24和 AUC0-∞的几何均值分别为110.75%和111.21%。
与服用左金丸前的基线相比,服用左金丸7 d后,1-羟基咪达唑仑的AUC0-24、AUC0-∞、tmax和t1/2经统计分析,差异无显著意义 (P>0.05),而Cmax明显低于基线值 (P<0.05),Cmax90%可信限低值小于70%,AUC0-24和AUC0-∞90%可信区间在等效范围内。
与服用左金丸前的基线相比,服用左金丸7 d后,AUC0-24代谢比和 Cmax代谢比减少 (P<0.05)。
3 讨论
因咪达唑仑经CYP3A代谢,主要产生1-羟基咪达唑仑,FDA将咪达唑仑作为表示体内外CYP3A催化活性的探药。本研究受试者口服左金丸3 g/次,每天2次,连服7 d后,咪达唑仑AUC0-24、AUC0-∞90%可信区间在80%~125%范围内,但接近上限,几何均值高出基线值约11%;1-羟基咪达唑仑Cmax的90%可信区间在低限之外,几何均值为62.58%,AUC0-24和AUC0-∞90%可信区间在80%~125%范围内,但接近下限,其几何均值低于基线值11%左右;AUC0-24和Cmax代谢比明显减少 (P<0.05)。受试者口服左金丸7 d后,由咪达唑仑经CYP3A代谢生成1-羟基咪达唑仑量减少,导致1-羟基咪达唑仑的体内暴露量相对减少,提示CYP3A酶被抑制。CYP3A在肠道和肝脏中有高表达[11-12],受试者口服左金丸7 d后,咪达唑仑吸收增多,其代谢物1-羟基咪达唑仑吸收相对减少,说明左金丸抑制肠腔CYP3A;但吸收入血咪达唑仑的消除半衰期 (t1/2)无明显变化,说明左金丸对肝脏CYP3A无抑制作用,对咪达唑仑的消除无影响。可能与左金丸抑制CYP3A的成分在肠腔的浓度较高,吸收进入肝脏的量较少有关[13]。
在前期体外研究发现,左金丸中的黄连提取物、吴茱萸提取物对CYP3A有抑制作用,IC50分别为140.8μg/mL和240.4μg/m L(数据未发表)。口服左金丸3 g/次,每天2次,肠腔中抑制CYP3A成分可达到抑制浓度[14]。
临床所用药物有50%是CYP3A4底物药,而左金丸是临床常用中成药,与其他药物联用可能性大。当左金丸与CYP3A4联用时,可能会引起代谢性相互作用,虽抑制程度较轻,但也应注意不良反应发生。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:630.
[2]张保国,刘庆芳.左金丸现代临床新用[J].中成药,2010,32(8):1408-1411.
[3]杨宏博,肖小河,赵艳玲,等.黄连、吴茱萸药对的研究进展[J].中国药房,2010,21(15):1432-1434.
[4]Han Y L,Yu H L,LiD,et al.In vitro inhibition of Huanglian[Rhizoma coptidis(L.)]and its six active alkaloids on six cytochrome P450 isoforms in human livermicrosomes[J].Phytother Res,2011,25(11):1660-1665.
[5]Guo Y,Chen Y,Tan Z R,et al.Repeated administration of berberine inhibits cytochromes P450 in humans[J].Fur JClin Pharmacol,2012,68(2):213-217.
[6]余 奇,郭 澄,程泽能.吴茱萸次碱的研究进展[J].药学实践杂志,2007,25(6):353-357.
[7]曹亚杰,曹 伟,余 奇,等.吴茱萸次碱在人肝微粒体中对细胞色素P450酶的抑制作用[J].中南药学,2005,3(4):243-245.
[8]Iwata H,Tezuka Y,Kadota S,et al.Mechanism-based inactivation of human liver microsoma CYP3A4 by rutaecarpine and limonin from Evodia fruit extract[J].Drug Metab Pharmacokinet,2005,20(1):34-45.
[9]Food and Drug Administration.Guidance for industry:drug interaction studies-study design,data analysis,implications for dosing and labeling recommendations[EB/OL].[2012-02]. http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm292362.pdf
[10]Bjomsson TD,Callaghan JT,Einolf H J,etal.The conductof in vitro and in vivo drug-drug interaction studies:a Pharmaceutical Research and Manufacturersof America(PhRMA)perspective[J].JClin Pharmacol,2003,43(5):443-469.
[11]Qiu F,Jiang J,Ma Y,etal.Opposite effectsofsingle-doseand multidose administration of the ethanol extract of Danshen on CYP3A in healthy volunteers[J].Fvid Based Complement Alternat Med,2013,2013:1-8.
[12]Qiu F,Wang G,Zhang R,etal.Effectof Danshen extracton the activity of CYP3A4 in healthy volunteers[J].Br J Clin Pharmacol,2011,69(6):656-662.
[13]华雯妍,张全英,丁 黎,等.LC-MS法研究健康人体盐酸小檗碱片的药代动力学[J].药学与临床研究,2009,17(6):465-468.
[14]张新峰,裘福荣,蒋 健,等.LC-MS/MS同时测定左金丸和香连丸中6种生物碱的含量[J].中成药,2010,32(4):597-600.
Activity of CYP3A4 influenced by Zuojin Pills taken in healthy Chinese volunteers
LIU Song-can, QIU Fu-rong*, MIAO Ping, ZHU Lei-lei, ZENG Jin, LIQiu-yue, HE Ming,JIANG Jian*
(Department of Clinical Pharmacology,Shuguang Hospital Affiliated to Shanghai University of Traditional ChineseMedicine,Shanghai201203,China)
Zuojin Pills;CYP3A4;midazolam;herb-drug interaction
R287
:A
:1001-1528(2015)07-1427-04
10.3969/j.issn.1001-1528.2015.07.008
2014-04-18
国家科技部新药重大创制项目 (2012ZX09303009-001);国家自然科学基金项目 (81173118);上海中医临床重点实验室项目 (C10dZ2220200)。
刘松灿,男,博士,研究方向为中药临床药理学。
*通信作者:裘福荣 (1966—),男,博士,硕士生导师,主任药师,研究方向为临床药代动力学。E-mail:Furong_qiu@126.com蒋 健(1956—),男,博士,博士生导师,主任医师,研究方向为中药临床药理学。E-mail:jiangjiansg@126.com
——以吴茱萸为例

