七福饮对血管性痴呆大鼠认知障碍及神经病理改变的影响
程 玥, 张 雪, 陈淑娴, 张晓双, 刘继平*
(1. 陕西中医药大学药理实验中心,陕西 咸阳712046;2. 陕西中医药大学中药药理实验室,陕西 咸阳712046)
血管性痴呆(VD)是老年痴呆的常见类型之一,是由一系列脑血管疾病导致脑组织损害所致的严重认知功能障碍综合征,以记忆、认知功能缺损为主要表现,可伴有语言、运动及人格障碍等[1-4]。我国65 岁以上的老年人痴呆发病率逐渐增高,其中血管性痴呆仅次于阿尔兹海默病,排第二位[5],现代医学对血管性痴呆的治疗主要在严格控制、积极防治血管性痴呆危险因素的基础上,采用改善脑循环及促智力药物、脑代谢激活剂、抗胆碱酯酶药物、脑血管扩张剂、抗自由基药物等方面的药物,上述药物均有其局限性,近年来医家尝试中医药用于血管性痴呆的治疗,取得了很好的疗效,为了进一步开发治疗血管性痴呆的新型药物,相关领域的基础研究显得十分必要[6-8]。本课题组在前期文献及实验研究的基础上,通过对明代张景岳的名方七福饮改善认知障碍及神经病理改变的作用及其作用机制进行研究,为本方的临床应用提供进一步的科学依据。
1 材料
1.1 药品与试剂 七福饮水煎液(100%),自制,方剂组成为人参、熟地、当归、白术(炒)、炙甘草、酸枣仁和远志(制用),以上药材均购自咸阳天天乐医药超市;胆碱酯酶(CHE)试剂盒,批号20131203;超氧化物歧化酶(SOD)试剂盒,批号20131128;丙二醛(MDA)试剂盒,批号20131126;谷胱甘肽过氧化物歧化酶(GSH-PX)试剂盒,批号20131121;考马斯亮兰蛋白试剂盒,批号20131202,均购自于南京建成生物工程研究所;Bcl-2、Bax免疫组化试剂盒,购自武汉博士德生物工程有限公司。
1.2 仪器 Morris 水迷宫(上海吉量软件科技有限公司);DMBH200 显微镜(舜宇光学科技有限公司);Thermo-86度低温冰箱;BT224S 电子天平(赛多利斯科学仪器有限公司);微量移液器(上海求精生化试剂仪器有限公司);752 紫外分光光度计。
1.3 动物 清洁级雄性SD 大鼠,体质量250 ~300 g,第四军医大学实验动物中心提供,合格证号SCXK (军)2012-006。动物分笼饲养,饲养于陕西中医药大学药理实验中心,保持12 h 昼夜节律,室温(22 ±1)℃,自由摄食饮水。
2 方法
2.1 造模与分组 参考文献[9]方法采用双侧颈总动脉结扎的方法制作VD 模型。具体方法如下:所有大鼠禁食不禁水8 h 后腹腔注射10%水合氯醛350 mg/kg 麻醉,颈部皮肤去毛后进行消毒并在正中切口,钝性分离出双侧颈总动脉,假手术组大鼠的双侧颈总动脉不结扎只分离,进行皮肤缝合;其余大鼠以“4”号丝线双重结扎其双侧颈总动脉并从中间剪断动脉。术后连续5 d 肌注庆大霉素5 mg/kg。1 个月后,大鼠按体质量随机分为假手术组、模型组、七福饮低、高剂量组,开始灌胃,七福饮低、高剂量组分别灌服100%七福饮水煎液,剂量分别为2.15 g/kg、4.3 g/kg;假手术组和模型组均给予等容量生理盐水灌胃,每天1 次,共30 d。
2.2 Morris 水迷宫实验 第30 天灌胃1 h 后,每组随机取大鼠10 只,连续4 d 对大鼠进行训练,每天分两个时间段(上午、下午),每个时间段分别从Ⅰ、Ⅱ、Ⅲ、Ⅳ4 个象限的正中位置将大鼠面向池壁投入水中,记录大鼠120 s内潜伏期以及搜索距离,如果大鼠在120 s 内还没有找到平台,将大鼠用棍子引导至平台,在平台停留20 s 后取出,潜伏期以120 s 计算。于第5 天撤除平台,随机选取1个象限的正中位置将大鼠面向池壁投入水中,记录大鼠120 s 内跨过虚拟平台的穿越次数及大鼠在原站台Ⅱ象限(目标象限)的游泳时间。
2.3 取材与标本处理 水迷宫实验结束后,每组随机取4只大鼠,麻醉后,4%多聚甲醛0.1 mol/L 磷酸缓冲液(pH 7.4)心内灌注固定,待固定充分后,开颅取脑,冠状位取视交叉向尾端3 ~4 mm 组织块,投入相同固定液于4 ℃固定1 周后,常规石蜡包埋,冠状切片,进行HE 染色、Bax、Bcl-2 免疫组化染色;Bax、Bcl-2 每个指标选取切片于40 倍显微镜下,运用IBM 摄像系统进行采图,各组选取海马部位共8 个不重复视野,用显微生物图像分析系统对所采集图像进行病理图像分析,统一光饱和度、亮度和色调,测量平均灰度值。
每组剩余大鼠处死取脑,迅速放入冰冷的生理盐水中进行漂洗,滤纸吸干水分后进行海马组织的分离并称定质量,在冰浴下用匀浆器匀浆,制成质量体积比为10%的组织匀浆,3 500 r/min 离心10 min,取上清液,冻存,备用,按照试剂盒说明测定SOD、MDA、GSH-PX 和CHE 各项指标。
3 结果
3.1 对血管痴呆模型大鼠水迷宫实验成绩的影响 水迷宫实验第1 天各组间潜伏期、探索距离基本无显著性差异,第2 天起,与假手术组比较,模型组的逃避潜伏期、探索距离显著延长(P <0.01 或P <0.05),目标象限游泳时间明显缩短、站台穿越次数明显减少(P <0.01);与模型组相比,假手术组、七福饮低、高剂量组逃避潜伏期、探索距离明显缩短(P <0.05 或P <0.01),目标象限(II 象限)的游泳时间明显延长(P <0.01),站台穿越次数增多(P <0.01)(见表1 ~表3,图1)。
表1 七福饮对血管痴呆模型大鼠水迷宫试验潜伏期的影响(±s,n=10)

表1 七福饮对血管痴呆模型大鼠水迷宫试验潜伏期的影响(±s,n=10)
注:与假手术组比较,△△P <0.01;与模型组比较,▲P <0.05,▲▲P <0.01
组别 剂量/(g·kg -1) 潜伏期/s 1 d 2 d 3 d 4 d假手术组 — 73.20 ±41.61 58.45 ±45.55 38.02 ±43.14 26.89 ±34.24模型组 — 119.36 ±0.50 106.02 ±34.71△△ 98.03 ±36.26△△ 97.86 ±35.38△△七福饮低剂量组 2.15 94.11 ±39.15 76.81 ±40.09 64.16 ±45.55▲ 60.29 ±43.60▲七福饮高剂量组 4.3 89.04 ±47.09 56.35 ±33.48▲▲ 51.75 ±23.90▲▲ 50.18 ±25.21▲▲
表2 七福饮对血管痴呆模型大鼠水迷宫试验探索距离的影响(±s,n=10)
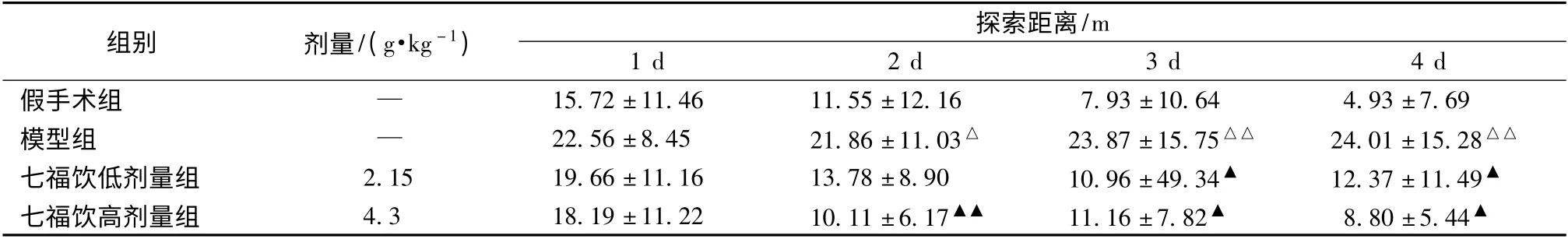
表2 七福饮对血管痴呆模型大鼠水迷宫试验探索距离的影响(±s,n=10)
注:与假手术组比较,△P <0.05,△△P <0.01;与模型组比较,▲P <0.05,▲▲P <0.01
组别 剂量/(g·kg -1) 探索距离/m 1 d 2 d 3 d 4 d假手术组 — 15.72 ±11.46 11.55 ±12.16 7.93 ±10.64 4.93 ±7.69模型组 — 22.56 ±8.45 21.86 ±11.03△ 23.87 ±15.75△△ 24.01 ±15.28△△七福饮低剂量组 2.15 19.66 ±11.16 13.78 ±8.90 10.96 ±49.34▲ 12.37 ±11.49▲七福饮高剂量组 4.3 18.19 ±11.22 10.11 ±6.17▲▲ 11.16 ±7.82▲ 8.80 ±5.44▲
表3 七福饮对血管痴呆大鼠水迷宫试验目标象限时间和穿越次数的影响(±s,n=10)
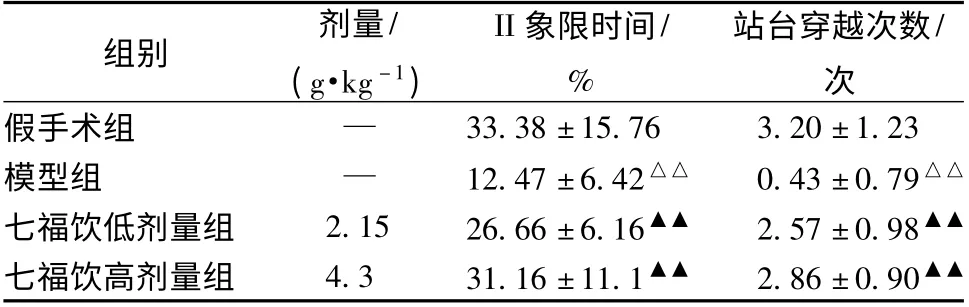
表3 七福饮对血管痴呆大鼠水迷宫试验目标象限时间和穿越次数的影响(±s,n=10)
注:与假手术组比较,△△P <0.01;与模型组比较,▲▲P <0.01
组别 剂量/(g·kg -1)II 象限时间/%站台穿越次数/次33.38 ±15.76 3.20 ±1.23模型组 — 12.47 ±6.42△△ 0.43 ±0.79△△七福饮低剂量组 2.15 26.66 ±6.16▲▲ 2.57 ±0.98▲▲七福饮高剂量组 4.3 31.16 ±11.1▲▲ 2.86 ±0.90假手术组 —▲▲
3.2 对血管痴呆模型大鼠海马组织SOD、MDA、GSH-PX活性明显降低(P <0.05 或P <0.01),CHE 活性和MDA水平显著升高(P <0.05);与模型组比较,七福饮低、高剂量组SOD、GSH-PX 活性显著升高 (P <0.01 或P <0.05),MDA 低剂量组水平显著性降低(P <0.05),CHE活性无显著性差异,见表4。
3.3 对大鼠海马组织病理改变的影响 HE 染色结果显示,假手术组大鼠海马区神经元排列规则,胞质丰富,胞核较大。模型组大鼠海马神经元大量变性、死亡,细胞体积缩小,周围出现空晕,呈深红色染色,核固缩,破裂明显。七福饮与模型组比较,海马区神经元变性死亡明显减轻,海马区神经元胞体缩小,但形状与假手术组接近,见图2。
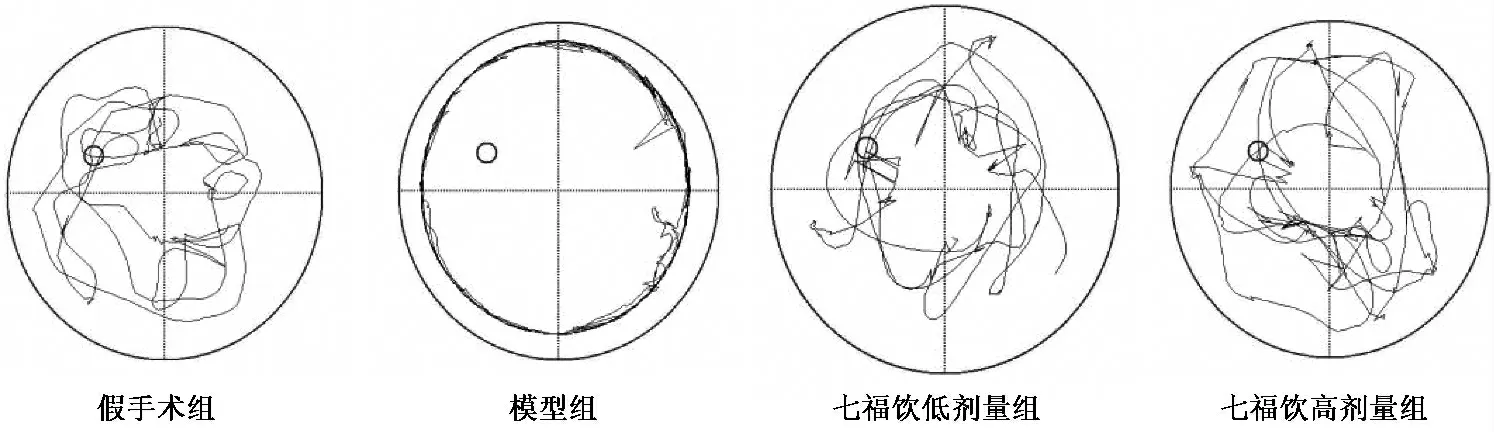
图1 七福饮对血管痴呆模型大鼠Morris 水迷宫游泳轨迹的影响
表4 七福饮对血管痴呆大鼠海马组织SOD、MDA、GSH-PX 和CHE 的影响(±s,n=10)
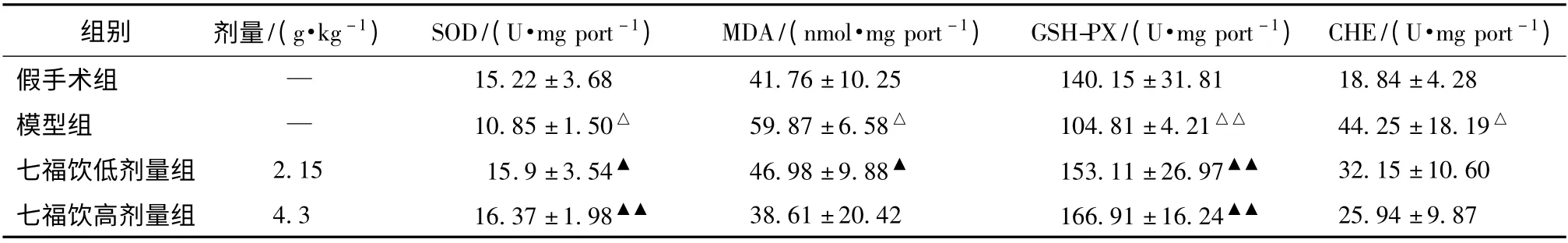
表4 七福饮对血管痴呆大鼠海马组织SOD、MDA、GSH-PX 和CHE 的影响(±s,n=10)
注:与假手术组比较,△P <0.05,△△P <0.01;与模型组比较,▲P <0.05,▲▲P <0.01
组别 剂量/(g·kg -1) SOD/(U·mg port -1) MDA/(nmol·mg port -1) GSH-PX/(U·mg port -1) CHE/(U·mg port -1)假手术组 — 15.22 ±3.68 41.76 ±10.25 140.15 ±31.81 18.84 ±4.28模型组 — 10.85 ±1.50△ 59.87 ±6.58△ 104.81 ±4.21△△ 44.25 ±18.19△七福饮低剂量组 2.15 15.9 ±3.54▲ 46.98 ±9.88▲ 153.11 ±26.97▲▲ 32.15 ±10.60七福饮高剂量组 4.3 16.37 ±1.98▲▲ 38.61 ±20.42 166.91 ±16.24▲▲25.94 ±9.87
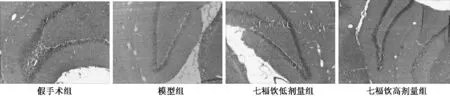
图2 七福饮对血管痴呆模型大鼠HE 染色的影响
免疫组化染色显示,与假手术组比较,模型组Bax 免疫阳性细胞数明显增多,着色明显加深,平均灰度值明显降低(P <0.01);与模型组比较,七福饮高、低剂量组Bax 免疫阳性细胞数明显降低,着色较浅,与假手术组接近,平均灰度值明显升高(P <0.01 或P <0.05),见图3、图4、表5。与假手术组比较,模型组Bcl-2 免疫阳性细胞数明显减少,着色偏淡,平均灰度值明显升高 (P <0.01);与模型组比较,七福饮各剂量组Bcl-2 免疫阳性细胞数明显增多,着色明显加深,与假手术组接近,平均灰度值明显降低(P <0.05)。
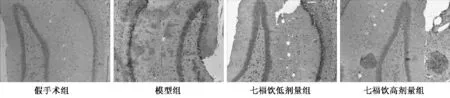
图3 七福饮对血管痴呆模型大鼠海马组织凋亡的影响(Bax 染色)

图4 七福饮对血管痴呆模型大鼠海马组织凋亡的影响(Bcl-2 染色)
表5 七福饮对血管痴呆模型大鼠海马组织中Bax、Bcl-2表达平均灰度值的影响(±s)

表5 七福饮对血管痴呆模型大鼠海马组织中Bax、Bcl-2表达平均灰度值的影响(±s)
注:与假手术组比较,△△P <0.01;与模型组比较,▲P <0.05,▲▲P <0.01
组别 剂量/(g·kg -1)Bax 平均灰度值 Bcl-2平均灰度值假手术组 —135.90 ±10.70 122.01 ±1.23模型组 — 104.61 ±7.76△△ 156.46 ±9.28△△七福饮低剂量组 2.15 117.70 ±7.01▲ 146.07 ±8.71七福饮高剂量组 4.3 121.43 ±7.70▲▲ 141.43 ±7.89▲
3 讨论
由于大脑组织缺血缺氧,导致智力、记忆力进行性衰退,学习记忆障碍是血管性痴呆患者普遍而严重的表现[10]。通过水迷宫进行大鼠神经认知模型的验证和神经认识治疗可行性的评估[11-12],大鼠逃避时间、摸索距离越短,穿越次数、目标象限活动时间越长,提示大鼠学习记忆能力越强。水迷宫实验结果提示,七福饮能减少大鼠逃避潜伏期和摸索距离,增加穿越次数和目标象限活动时间,表明七福饮可明显改善血管性痴呆大鼠的学习记忆能力。
血管性痴呆病人大脑皮层和海马中的病理改变主要为皮质弥漫性萎缩,沟回增宽,脑室扩大,神经元大量减少,神经原纤维结等病变,以乙酰胆碱(Ach)及胆碱乙酰化酶的含量显著减少为典型生理表现,乙酰胆碱由胆碱酯酶分解,海马组织中胆碱酯酶水平增加,加快Ach 的水解,Ach 水平减少[13],所以稳定体内乙酰胆碱含量,为治疗和改善老年痴呆症的一条有效途径。与模型组比较,七福饮能抑制胆碱酯酶的活性,减少Ach 的水解,但没有显著性差异。
机体内氧自由基的含有量过多可引起组织过氧化损伤,这也是产生血管性痴呆的重要原因之一,清除过多的自由基可以延缓痴呆患者的病情恶化[14]。MDA 是脂类过氧化生成物,会引起蛋白质、核酸等生命大分子的交联聚合,且具有细胞毒性。SOD、GSH-PX 是体内的抗氧化系统,能及时修复受损细胞,减少因氧自由基对细胞造成的损害。七福饮可显著减少血管性痴呆模型大鼠MDA 的生成,提高SOD、GSH-PX 活力,提示七福饮具有较好的抗氧化能力。
血管性痴呆发病时,海马神经细胞存在细胞凋亡,而Bcl-2 家族是细胞凋亡机制中重要的调节因子,该基因是抗细胞凋亡基因,Bax 基因是促细胞凋亡基因,本研究表明七福饮能够减少血管性痴呆大鼠海马组织的Bax 阳性表达,增加Bcl-2 阳性表达,能够抑制海马组织神经元的凋亡,进而改善血管性痴呆模型大鼠的学习记忆功能。
综上所述,七福饮对血管性痴呆大鼠的记忆障碍有改善作用,能明显减少大鼠在水迷宫试验中的逃避潜伏期和探索距离,增加穿越次数和目标象限活动时间;可提高SOD、GSH-PX 活性,减少MDA 水平,降低CHE 的活性,能够减少VD 大鼠海马组织的Bax 表达,增加Bcl-2 表达,以上研究结果可为临床治疗提供参考依据。
[1] 曹金梅,毕巧莲,赵京伟. 醒脑化痰针法治疗血管性痴呆的临床观察[J]. 河南中医,2007,27(9):29-30.
[2] 王建明. 七福饮加味治疗老年性痴呆32 例[J]. 辽宁中医杂志,2002,29(1):43.
[3] 贾海龙. 加味七福饮治疗老年痴呆30 例临床观察[J]. 北方药学,2012,9(6):22.
[4] 李雪琴,王致道. 七福饮加减治疗血管性痴呆30 例疗效观察[J]. 中国中医急症,2010,19(3):417.
[5] 田金洲. 血管性痴呆[M]. 北京:人民卫生出版社,2003:210.
[6] 罗 康. 扶正涤痰法治疗VD68 例临床观察[J]. 广西中医药,2000,25(3):1-3.
[7] 冀 宏. 当归芍药散治疗血管性痴呆的临床研究[J]. 山西中医,2000,16(2):10-11.
[8] 路 辉,王炎焱,陈 馥,等. 中药胶囊治疗脑血管性痴呆的临床观察[J]. 中医药信息,2000,17(1):19-20.
[9] 李 斌,刘汇波,郭德玉,等. 双侧颈总动脉结扎大鼠行为学观察[J]. 中国实验动物学杂志,2000,10(1):15-18.
[10] 黄红莉,陈保健,周 昊. 血管性痴呆[J]. 基础医学与临床,1998,18(5):26-30.
[11] Hartman R E,Lee J M,Zipfel G J,et al. Characterizing learning deficits and hippocampalneuron loss following transientglobal cerebral ischemia in rats[J]. Brain Res,2005,1043(1-2):48-56.
[12] 叶翠飞,张 丽,艾厚喜,等. 两种水迷宫实验对拟痴呆模型学习记忆功能测试的比较[J]. 中国行为医学科学杂志,2004,13(3):252-253.
[13] 盛树力. 老年痴呆从分子生物学到临床诊治[M]. 北京:科学技术文献出版社,1999:93-124.
[14] 徐 青,孙强三,王晓红,等. 升黄益智方对痴呆模型小鼠脑组织SOD 活性的影响[J]. 中国老年学杂志,2007,27(8):734-735.

