土壤来源链霉菌KIB-H91 次级代谢产物的分离鉴定
喻明明,苏 灿,马亚团,颜一军,黄胜雄*,薛大权
1 湖北中医药大学中药资源与中药复方教育部重点实验室,武汉 430065;2中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,昆明 650201
微生物次级代谢产物是天然产物研究的重要组成部分,不仅因为其庞大的数量和结构的多样性,更因为其中许多化合物都具有一定的生物活性。据统计,天然产物总量一半左右来源于微生物,且抗生素中约70%的化合物由放线菌产生[1]。虽然近年来由于抗生素耐受问题的出现,抗生素药物的研发趋向于停滞,但是市场对于新颖抗菌药物尤其是抑制革兰氏阴性菌药物的需求仍然极为迫切[2]。天然产物家族中,醌类化合物大多具有抗氧化和抗肿瘤活性。迄今为止,已经上市的醌类药物有丝裂霉素、艾地苯醌、塞曲司特等。其中丝裂霉素就是一种由头状链霉菌分泌的抗生素,一直以来被用于胃癌、肝癌、胰腺癌等癌症的治疗[3]。
本研究从云南昆明植物园采集的土壤样本中分离得到一株链霉菌,命名为Streptomyces sp.KIBH91。在前期的发酵液活性筛选实验中,我们发现其发酵液提取物有明显的抑菌活性。因此,我们选取该菌株进行大量发酵并对发酵液中的次级代谢产物进行提取分离,最终得到了4 个主要化合物。通过分析其理化性质和波谱数据,分别将其鉴定为endocrocin(1)、laccaic acid D(2)、sarubicin A(3)和sarubicin B(4)(见图1),其中化合物3 和4 显示较好的抗菌活性。
1 材料与方法
1.1 仪器与材料

图1 化合物1~4 的化学结构Fig.1 Chemical structures of compounds 1-4
Bruker AvanceIII-600 MHz 型核磁共振仪;Bruker AV-400 型核磁共振仪;Waters Xevo TQ-S 型超高压液相三重四极杆联用质谱仪;XRC-1 型熔点仪(四川大学科学仪器厂生产);LC3000 型高效液相色谱仪(北京创新通恒科技有限公司生产);Hitachi Chromaster 5430 型高效液相色谱仪;YMC-Triat C18型液相色谱柱(250×10 mm I.D.);柱层析硅胶G,200~300 目(青岛海洋化工厂生产);柱层析硅胶RP18,230~400 目(德国EMD 化学试剂公司生产);其他化学试剂均为国产分析纯。
1.2 发酵菌株
发酵菌株Streptomyces sp.KIB-H91 为从昆明植物园(东经102°45',北纬25°9')采集的土壤样本中分离得到,通过16S RNA 测序分析,确定其为链霉属(经比对与已知链霉菌Streptomyces lienomycini HBUM174506 相似性为100%)。菌株保存在昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室。
1.3 培养基及培养条件
固体培养基:为MS 培养基,配方为大豆粉20 g/L(煮沸过滤取滤液),甘露醇20 g/L,技术琼脂粉20 g/L,pH=7.0。
种子培养基:为TSB 培养基,配方为胰蛋白胨17 g/L,大豆蛋白胨3 g/L,氯化钠5 g/L,磷酸氢二钾2.5 g/L,右旋葡萄糖2.5 g/L,pH=7.3±0.2。
发酵培养基:大豆蛋白胨6 g/L,右旋葡萄糖5 g/L,可溶性淀粉20 g/L,碳酸钙2 g/L,pH=7.0。
将在MS 平板上活化好的菌株接种到20 只装有50 mL 种子液的250 mL 三角瓶中,置于27 ℃,250 rpm 摇床上培养2 d。
将种子液按10%接种量转接到40 只盛有250 mL 发酵培养基的1 L 三角瓶中,置于27 ℃,250 rpm 摇床上培养5 d。
1.4 提取与分离
将发酵液收集,于6000 rpm 转速下离心20 min。上清液用等体积的乙酸乙酯萃取三次;菌丝体用500 mL 丙酮浸泡过夜后过滤。合并乙酸乙酯与丙酮相,用无水硫酸钠干燥,有机相减压浓缩,得到3.1 g 粗提物。粗提物经硅胶柱层析,用石油醚-乙酸乙酯(100∶0,50∶50,0∶100)及乙酸乙酯-甲醇(50∶50)梯度洗脱,共得到4 个组分(F1~F4)。用HPLC 分析极性段F2 的成分(见图2),分析方法为:10%~100%甲醇-水梯度洗脱20 min,第21~25 min 再用100%甲醇等度洗脱,之后用10%甲醇-水等度洗脱3 min 结束;柱温箱恒定在28 ℃,检测器为DAD 检测器。F2 经反相硅胶柱层析,用甲醇-水(20∶80,40∶60,60∶40,80∶20,100∶0)梯度洗脱,得到5 个极性段(F2-1~F2-5)。其中F2-3 经高效液相色谱制备,用18%甲醇-水等度洗脱,得到两个化合物,分别是1(6.1 mg)和3(11.8 mg)。F2-4 也用HPLC 制备,以30%甲醇-水为流动相,洗脱得到化合物2(4.9 mg)和4(5.5 mg)。
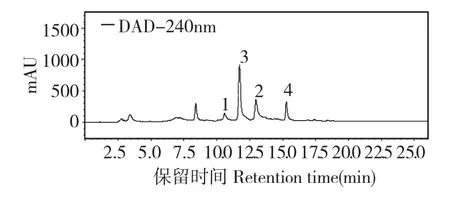
图2 极性段F2 的高效液相色谱分析结果Fig.2 HPLC chromatogram of F2 fraction
1.5 抗菌敏感性试验
按照美国临床与实验室标准研究所(CLSI)出版的有关规程操作[4],采用微量稀释法测定化合物1~4 对大肠杆菌(Escherichia coli ATCC 8099)、金黄色葡萄球菌(Staphylococcus aureus ATCC 6538)、枯草芽孢杆菌(Bacillus subtilis ATCC 6633)和斜卧青霉(Penicillium decumbens ATCC 10436)四种病原菌的最小抑制浓度(MIC)。试验中,每个化合物分别配制成800、400、200、100、50、25、12.5、6.25(μg/mL)八个稀释浓度,并以制霉菌素为阳性对照,加入等体积50% DMSO-无菌水的孔为阴性对照,不接菌悬液的孔为空白对照。
2 结果与分析
2.1 结构鉴定
化合物1 黄色粉末;分子式为C16H10O7;ESIMS m/z:313[M-H]-;1H NMR(DMSO-d6,600 MHz)δ:13.12(1H,s,1-OH),11.12(1H,brs,COOH),7.56(1H,s,H-4),7.03(1H,d,J=2.4 Hz,H-5),6.55(1H,d,J=2.4 Hz,H-7),2.56(3H,s,ArCH3);13C NMR(DMSO-d6,150 MHz)δ:188.9(C-9),182.1(C-10),168.3(COOH),165.6(C-6),165.2(C-8),158.2(C-1),143.1(C-3),135.1(C-4a),133.1(C-10a),130.4(C-2),121.5(C-4),113.2(C-9a),110.3(C-8a),109.4(C-5),108.2(C-7),19.8(ArCH3)。以上数据与文献报道基本一致[5],确定化合物1 为endocrocin。
化合物2 红褐色粘稠固体;分子式为C16H10O7;ESI-MS m/z:313[M-H]-;1H NMR(DMSO-d6,600 MHz)δ:13.57(1H,s,8-OH),10.95(1H,brs,COOH),7.26(1H,s,H-4),7.12(1H,brs,6-OH),7.01(1H,d,J=2.4 Hz,H-5),6.56(1H,d,J=2.4 Hz,H-7),3.01(3H,s,ArCH3);13C NMR(DMSOd6,150 MHz)δ:188.1(C-9),183.0(C-10),169.6(COOH),169.5(C-3),164.4(C-6),163.5(C-8),148.3(C-1),136.2(C-10a),134.2(C-4a),125.3(C-2),119.6(C-9a),114.9(C-4),110.9(C-8a),108.5(C-7),106.4(C-5),20.5(ArCH3)。以上数据与文献报道基本一致[6],确定化合物2 为laccaic acid D。
化合物3 红色针晶(CH3OH);mp.196~199℃;分子式为C13H14N2O6;ESI-MS m/z:293[MH]-;1H NMR(methanol-d4,400 MHz)δ:4.93(1H,t,J=3.6 Hz,H-8),3.82(1H,d,J=8.0 Hz,H-6),3.63(1H,q,J=6.4 Hz,H-10),2.60 and 1.34(each 1H,m,H2-7),0.96(3H,d,J=6.4 Hz,H-11);13C NMR(methanol-d4,100 MHz)δ:204.1(C-10),180.4(C-1 and C-4),170.3(C-9),155.1(C-3),142.8(C-5),135.7(C-7),133.9(C-8a),129.3(C-6),127.2(C-8),126.3(C-4a),99.7(C-2),30.6(C-11)。以上数据与文献报道基本一致[7],确定化合物3 为sarubicin A。
化合物4 黄色针晶(CH3OH);mp.284~285℃;分子式为C13H10N2O4;ESI-MS m/z:257[MH]-;1H NMR(DMSO-d6,600 MHz)δ:10.82(1H,s,3-NHa),9.08(1H,s,CONHa),8.31(1H,s,3-NHb),8.16(1H,dd,J=4.2,6.0 Hz,H-8),7.93(1H,t,J=6.0 Hz,H-7),7.56(1H,overlapped,H-5),7.56(1H,overlapped,CONHb),2.44(3H,s,H3-11);13C NMR(DMSO-d6,150 MHz)δ:182.6(C-1),180.2(C-4),172.3(C-9),155.3(C-3),149.2(C-4a),135.6(C-8a),99.0(C-2),79.8(C-5),73.6(C-10),72.2(C-6),63.5(C-8),37.6(C-7),17.1(C-11)。其1H 核磁数据与文献报道基本一致[8],且HMBC 相关信号(见表1)也验证了化合物4 的结构为sarubicin B。

表1 化合物3 和4 的核磁信号归属Table 1 1H and13C NMR data of compounds 3 and 4

2.2 化合物抗菌活性
抗菌敏感性试验结果显示,4 个化合物均对金黄色葡萄球菌和斜卧青霉没有抑制作用;化合物3对大肠杆菌ATCC 8099 的MIC 值为25 μg/mL,化合物4 对枯草芽孢杆菌ATCC 6633 的MIC 值为12.5 μg/mL,表现出很好的抑菌效果(见表2)。
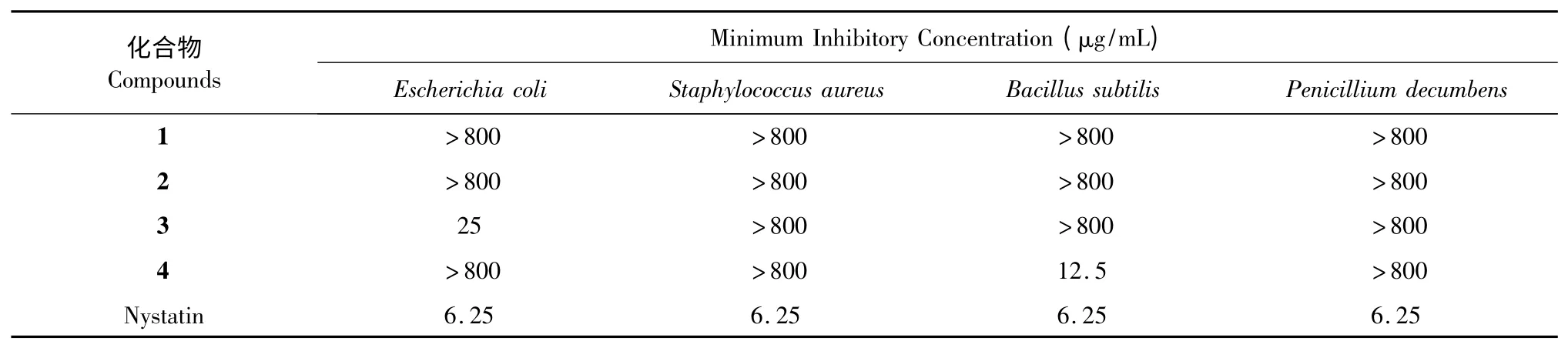
表2 化合物1~4 的抗菌活性Table 2 The antimicrobial activities of compounds 1-4
3 讨论
本文分离得到的4 个代谢产物中,化合物2 是最初从紫梗原虫胶中分离的一种色素[9],其后在植物及真菌中均有发现,但其正确核磁数据直到2006年才由Usama 等人给出[6]。我们对其HSQC 和HMBC 解析的结果,也与Usama 等人报道的结构一致。化合物4 由Eckardt 等人在1982 年首次分离,但一直未有碳谱和二维核磁数据的报道[10]。通过初步的抗菌敏感性试验,我们发现化合物3 和4 是链霉菌Streptomyces sp.KIB-H91 次级代谢产物中的主要活性物质。这两个化合物都具有一个3-氨基-1,4-苯醌-2-甲酰胺单元,在天然抗生素中结构十分独特。从生源途径看,可以认为sarubicin B(4)是由sarubicin A(3)脱去两分子水得来。我们首次从同一株链霉菌中分离得到这两个化合物,也从侧面验证了它们在生物合成上的联系。
1 Bérdy J.Bioactive microbial metabolites,a personal view.J Antibiot,2005,58:1-26.
2 Mark SB,Mark AB,Matthew AC.Antibiotics in the clinical pipeline in 2013.J Antibiot,2013,66:571-591.
3 Huang JQ(黄健强),Mao YQ(毛应清),Yang YL(杨蕴刘).Research and perspective on mitomycin.World Notes on Antibiotics(国外医药抗生素分册),1999,20:37-42.
4 Clinical and Laboratory Standards Institute.Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically;approved standard-ninth edition.Wayne,PA:Clinical and Laboratory Standards Institute,2012,32:2.
5 Chiang YM,Szewczyk E,Davidson AD,et al.Characterization of the Aspergillus nidulans monodictyphenonegene cluster.Appl Environ Microbiol,2010,76:2067-2074.
6 Usama WH,Mohamed AE,Hartmut L.A new α-methylanthraquinoneglucoside from Emexspinosus.Nat Prod Res,2006,20:742-747.
7 Tresselt D,Eckardt K,Ihn W,et al.Antibiotics from actinomycetes,chemical constitution of antibiotic sarubicin A.Tetrahedron,1981,37:1961-1965.
8 Tresselt D,Eckardt K,Ihn W et al.The chemical structure of antibiotic sarubicin B.Zeitschrift für Chemie,1983,23:217-218.
9 Mehandale AR,Rama AV,Shaikh IN,et al.Desoxyerythrolaccin and laccaic acid D.Tetrahedron Lett,1968,9:2231-2234.
10 Eckardt K,Tresselt D,Ihn W et al.Sarubicin B,a new quinoneantibiotic,isolated from the fermentation broth of a Streptomyces strain.J Antibiot,1982,35:1638-1640.

