开菲尔乳饮料益生功能及生产研究进展
陆 娟,唐 俊,屈长青,2*
1阜阳师范学院生物与食品工程学院;2 抗衰老中草药安徽省工程技术研究中心,阜阳 236037
开菲尔(Kefir)是一种味酸、粘稠的乳酒饮料,由包裹于“开菲尔粒”(Kefir Grain)中的细菌和酵母菌发酵羊乳或牛乳而来[1]。开菲尔粒呈无规则的花椰菜状、珊瑚状或爆米花状,白色或淡黄色,大小不等,直径在0.3~3 cm 之间。相传,开菲尔起源于1000 年以前的中亚高加索地区,但蛋白质组学证据证明开菲尔最早起源于3800 年前青铜器时代早期的中国新疆[2]。目前,开菲尔已广泛分布于世界各地,如波兰[3]、中国[4]、巴西[5]、伊朗[6,7]、土耳其[8]、葡萄牙[9]等地。开菲尔除了具有一般酸奶所没有的口感和风味外,还具有抗病原菌、抗毒素、免疫调节、抗肿瘤等多种益生功能。本文对开菲尔粒的结构及生长机制、开菲尔的益生功能、应用和生产等方面进行了综述。
1 开菲尔粒的结构及生长机制
开菲尔粒以非溶解性的蛋白和多糖为基质,其中共生有约30 种乳酸菌[乳杆菌(Lactobacillus)、乳球菌(Lactococcus)和明串株菌(Leuconostoc)等]和酵母菌[酵母(Saccharomyces)、克鲁维酵母菌(Kluyveromyces)、念珠菌(Candida)、假丝酵母(Mycotorula)、有孢圆酵母(Torulaspora)、隐球菌(Cryptococcus)和毕赤酵母(Pichia)等][3]。开菲尔粒的菌相组成已经比较清楚,但乳酸菌和酵母菌的分布仍存争议。利用电镜扫描技术,Bottazzi 等发现乳杆菌主要存在于开菲尔粒的外部,酵母菌存在于开菲尔粒的中间,在乳酸菌大量存在的区域几乎没有酵母菌,酵母菌大量存在的区域几乎不存在细菌[10,11];而Magalhaes 等发现酵母菌和乳酸菌以一定的比例分布于开菲尔粒中[12];Leite 等却发现,杆状菌存在于开菲尔粒的内部和外部,酵母菌则主要存在于外部[13]。
作为发酵剂,开菲尔粒起初呈薄片状,一面平而光滑,一面卷曲而粗糙,成熟以后则呈卷轴或牛肠卷状。Marshall 等研究发现,在光滑面和粗糙面中间的多糖区域存在大量长而弯曲的细菌,它们可能就是开菲尔粒基质多糖产生菌[11]。结构表明,片状开菲尔粒的生长经历了弯曲、折叠、再折叠成为卷轴状过程。因此,粘附在粗糙面的酵母菌在经过折叠后大量存在于开菲尔粒的中间[11]。
Wang 等进一步提出了开菲尔粒折叠的可能机理[14]。开菲尔粒中大部分的乳酸菌是亲水性的,细胞表面存在有负电荷。在开菲尔粒的生长过程中,首先,具有自我聚集能力的开菲尔基质乳杆菌(Lactobacillus kefiranofaciens)HL1 和图列茨酵母(Saccharomyces turicensis)进行自我聚集形成小颗粒;然后,具有生物膜形成功能的开菲尔乳杆菌(Lactobacillus kefiri)粘附于小颗粒的表面,并和奶中其它微生物和成分共聚集形成开菲尔粒;最后,更多的微生物粘附于颗粒物上,开菲尔粒慢慢长大。Xie 等也证明了:开菲尔粒中细菌细胞壁表面的蛋白质和酵母菌细胞壁多糖在共聚集和微生物吸附中起着非常重要的作用,其中酵母菌与提高聚集能力、吸附能力和在不良环境中生存能力等密切相关[4]。
2 开菲尔的益生功能
开菲尔中的多种组成菌都是益生菌,如嗜酸乳杆菌(Lactobacillus acidophilus)、干酪乳杆菌(Lactobacillus casei)、副干酪乳杆菌(Lactobacillus paracasei)、发酵乳杆菌(Lactobacillus fermentum)和酿酒酵母(Saccharomyces cerevisiae)等,因此开菲尔具有较好的益生功能。
开菲尔具有抗病原菌、促益生菌作用。2014年,Carasi 等发现来源于开菲尔的6 株开菲尔乳杆菌(Lactobacillus kefiri)CIDCA 8321、CIDCA 8345、CIDCA 8348、CIDCA 83115、CIDCA 83111、CIDCA 83113 对蜡样芽胞杆菌(Bacillus cereus)和金黄色葡萄球菌(Staphylococcus aureus)都有抑制作用,但对大肠杆菌(Escherichia coli)都不具有抑制作用;阳性病原细菌和阴性病原细菌对6 株菌都敏感,并且阳性病原菌的敏感性比阴性病原菌强[15]。开菲尔不仅具有抗阳性病原细菌、阴性病原细菌的作用,还具有抗真菌的作用。2011 年,Ismaiel 等发现与中性化的开菲尔悬浮液和纯化的开菲尔多糖(0.35 mg/mL、0.70 mg/mL)相比,发酵24 h 的开菲尔悬浮液对粪链球菌(Streptococcus faecalis)KR6 和禾谷镰刀菌(Fusarium graminearum)CZ1 的抗性最高,抑菌圈直径都达到15.0 mm;当黄曲霉(Aspergillus flavus)AH3 在添加有发酵开菲尔滤出液(7%~10%,v/v)的肉汤培养基中培养10 d 时,其孢子化被完全抑制;并且高浓度(10%)发酵开菲尔滤出液可以完全抑制黄曲霉的菌丝体生长[16]。2014 年,Londero 等发现:24 h 后100 g/L 开菲尔发酵乳清对黄曲霉、寄生曲霉(Aspergillus parasiticus)、土曲霉(Aspergillus terreus)、烟曲霉(Aspergillus fumigatus)、皮壳青霉(Penicillium crustosum)、长梗木霉(Trichoderma longibrachiatum)、根霉(Rhizopus)等多种真菌都具有抗性,对它们分生孢子发生的抑制率高达70%以上;并且,家禽饲料在添加发酵乳清(1 L/kg)后可以提高其抗真菌感染能力2~4 倍[17]。另外,开菲尔也具有促进益生菌生长的作用。2014 年,Serafini 等发现,开菲尔或开菲尔多糖可以促进双歧双歧杆菌(Bifidobacterium bifidum)PRL2010 生长,增加双歧双歧杆菌中与食用多糖代谢有关酶基因的转录;并且,双歧双歧杆菌可以进入开菲尔多糖基质中,增加开菲尔粒的菌相组成[18]。
开菲尔具有抗毒素功能。2011 年,Ismaiel 等发现高浓度(10%)发酵开菲尔滤出液可以完全抑制黄曲霉AH3 产生黄曲霉毒素B1[16]。2013 年,Bolla等发现:来源于开菲尔的乳酸乳球菌(Lactococcus lactis)亚种CIDCA 8221 可以产生一种分子量超过10 kDa 的物质,这种物质可以通过体外抑制来源于艰难梭状芽胞杆菌(Clostridium difficile)的细胞毒素TcdA 和TcdB 导致的细胞毒效应而保护真核Vero细胞,但是它在100 °C 处理15 min 后失去该功效[19]。同年,Kakisu 等研究发现:来源于开菲尔的胚芽乳杆菌(Lactobacillus plantarum)CIDCA 83114可以降低大肠杆菌O157:H7 69160 菌株产生的Ⅱ类志贺毒素(Stx2)的细胞毒性而保护Vero 细胞;胚芽乳杆菌的细胞壁也具有该功效,但经热或蛋白酶处理后失去该功能,因此,他们推断胚芽乳杆菌的细胞壁存在一种蛋白或肽类与保护机理有关,并且得出胚芽乳杆菌的细胞壁通过与志贺毒素B 亚基结合而降低该毒素的毒性[20]。
开菲尔具有免疫调节活性。2005 年,Vinderola等发现开菲尔可以增加小鼠小肠和支气管粘膜上IgA+细胞的数量[21]。2010 年,Romanin 等发现来源于开菲尔的酵母菌比乳杆菌能更好的调节肠上皮先天的免疫反应[22]。2014 年,屈长青等也发现1%和5%剂量的藏灵菇乳清都具有提高小鼠腹腔巨噬细胞吞噬率的作用[23]。
开菲尔也具有降胆固醇活性。2013 年,Zheng等发现将添加有藏灵菇源嗜酸乳杆菌LA15 的高胆固醇食物饲喂Sprague-Dawley 大鼠4 周,大鼠血清中的总胆固醇、甘油三酸酯和低密度脂蛋白胆固醇水平明显降低(P<0.05),而排泄物中的胆固醇水平却明显升高(P<0.05)[24]。同年,Huang 等将藏灵菇源的胚芽乳杆菌Lp27 饲喂高胆固醇血症大鼠4 周,大鼠血清中的总胆固醇、甘油三酸酯和低密度脂蛋白胆固醇水平降低,并且大鼠肝脏中的总胆固醇、甘油三酸酯也得到了降低[25]。
开菲尔还具有抗肿瘤活性。2011 年,Maalouf等发现不含有细菌部分的开菲尔通过上调TGF-β1和下调TGF-α 可有效抑制恶性T 淋巴细胞增殖并诱导其凋亡[26]。2012 年,Gao 等发现不含细菌的藏灵菇通过上调bax(凋亡启动子)、下调bcl-2(凋亡抑制子)发挥体外诱导胃癌细胞凋亡的作用[27]。2014年,Ghoneum 等发现一种新的开菲尔粒产物(PFT,主要含有开菲尔乳杆菌P-IF 菌株),该PFT 以一种穿洞模式剂量依赖性的体外诱导骨髓白血病细胞(HL60/AR)凋亡,当浓度为5 mg/mL 时细胞凋亡率达到最高,为67.5%[28]。
开菲尔还可以缓解乳糖不耐受性疾病症状。乳糖不耐受性疾病是由于患者的小肠中缺乏β-半乳糖苷酶,不能将乳糖水解为半乳糖和葡萄糖,患者在吸食乳糖后产生腹胀、腹泻、恶心等症状。和其他发酵乳一样,发酵后开菲尔中的乳糖浓度降低,而且由于开菲尔中某些具有β-半乳糖苷酶活性的菌在被饮用后可能存活于小肠中,通过细胞裂解释放β-半乳糖苷酶而消化半乳糖,或通过改变细胞膜通透性而使乳糖能轻易进入细胞,因而乳糖不耐受性疾病症状得到缓解[29]。
不同来源的开菲尔益生功能不一,目前我们课题组研究发现藏灵菇乳清具有免疫调节活性[23],下一步计划深入研究其它益生功能,分离纯化乳清蛋白,开发相应产品,推进产学研合作。
3 开菲尔的应用
3.1 医药方面
开菲尔及其多糖不仅具有抗病原菌、抗毒素、免疫调节、抗肿瘤等多种益生功能,在临床上,开菲尔还可以有效治疗接种有金黄色葡萄球菌的伤口,并且成疤效果比新霉素氯睾酮阳性对照好[30];在治疗烧伤时,开菲尔也比阳性对照磺胺嘧啶能更好的使烧伤处形成上皮、结疤[31]。因此开菲尔在医药方面具有巨大的应用潜能。
3.2 食品方面
开菲尔可以广泛应用于食品工业。一般地,食品在工业应用前要经过严格的毒理测试和市场调查,而开菲尔及其相关产物因乳酸菌本身具有安全性而备受工业生产者的青睐[32]。开菲尔多糖具有提高酸化牛奶的流变性功能,可以作为食品级生物活性添加剂使用[33];它还具有冰点胶化入口即化的特性,因此在胶状食品中也具有强大的市场魅力[33,34]。此外,开菲尔多糖具有抗菌、免疫调节等活性,可以作为功能食品添加剂使用[33]。在乳酪制造业,以开菲尔为发酵剂可以增加奶酪的结构、风味和延长上架时间;可以延长上架时间,这对身负利用天然产物代替化学防腐剂重压的生产者来说绝对是一个利好的消息[35,36]。作为食品外包装的材料,开菲尔多糖以甘油为增塑剂制成的膜因具有阻止湿气、氧气、脂类、香味转移功能而防止食品变质、延长食品上架时间[37];除此以外,开菲尔多糖制成可食用并可生物降解的膜与以石油衍生物为材料制成的膜相比,前者更易于被有健康意识和环保意识的当代人接受[38]。另外,在烘焙面包时,以开菲尔粒作为酵母比以野生菌作为酵母烘焙出的面包具有更长的保鲜期,保鲜期被延长1 倍,这与面包中乳酸浓度和乙酸浓度大幅增加有关[39]。
4 开菲尔的生产
4.1 开菲尔的生产方法
开菲尔的生产有传统方法与现代方法之分(图1)。传统的开菲尔生产是人工将不定量的开菲尔粒接种到巴氏灭菌或未灭菌牛奶(25 ℃)中,20~25℃发酵18~24 h,过滤除去开菲尔粒得到过滤液,将过滤液4 ℃冷藏成熟即为开菲尔乳饮料。而现代的开菲尔生产主要包括两个步骤,第一步是制备母发酵剂,类似于传统方法;第二步是将母发酵剂按1%~3%接种巴氏灭菌牛奶,发酵,冷藏成熟。
受开菲尔粒中的菌相组成和开菲尔的加工过程的影响,传统的开菲尔生产因开菲尔粒回收过程繁琐、发酵不均一、生产不具有一致性而不适于大规模生产,因此,把开菲尔粒中的某些菌株纯化培养再混合发酵的现代生产方法成为广大研究者们开发开菲尔商品的一个关注热点。目前,开菲尔的工业化生产不是直接以过滤得到的开菲尔粒作为母发酵剂,而是从开菲尔粒中分离得到纯培养物或购买商品式纯培养物制备母发酵剂,不再需要过滤回收开菲尔粒[40],节省了大量的人力、物力和财力。Chen 等将细菌和酵母菌按照开菲尔粒中的分布比例分别制成细菌微球和酵母菌微球,这两种微球可以作为发酵剂进行开菲尔发酵,并且可以循环利用28 个周期[41]。Nambou 等将不同来源的6 株菌马克斯克鲁维酵母(Kluyveromyces marxianus)BD01004、德氏乳杆菌保加利亚亚种(Lactobacillus delbruekii ssp.bulgaricus)BD00014、开菲尔乳杆菌BD00002、嗜热链球菌(Streptococcus thermophilus)BD00089、乳酸乳球菌(Lactococcus lactis)BD00736 和肠膜状明串珠菌(Leuconostoc mesenteroides)BD01701 进行纯化培养,然后按照不同的浓度接入复配脱脂乳(10%,w/w)进行发酵,可以得到与传统基本相同的开菲尔乳饮料[42]。
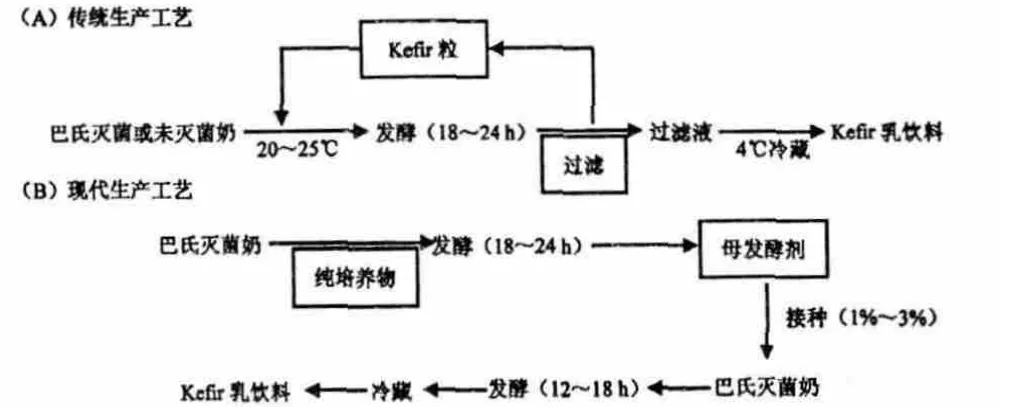
图1 Kefir 乳饮料的两种生产工艺Fig.1 Two processes of kefir production
4.2 开菲尔生产的影响因素
目前,在研究影响开菲尔生产的因素时大都考虑它们对开菲尔粒中生物量的影响。在开菲尔生产中,多种因素如碳源、氮源、培养温度、接种量、无机盐和培养时间等都可以影响开菲尔粒中的生物量[6,8,43-46](表1)。Gao 等发现在最优条件(脱脂乳41.6%、发酵温度30.05 ℃、接种量1.86%、转速0 rpm、发酵时间20 h)下,藏灵菇生长率为14.33%,比未优化前增加了39.4%[43]。而Ghasemlou 等却发现当最优条件为乳清乳糖88.4 g/L、酵母粉21.3 g/L、pH 5.2、发酵温度20 ℃时,伊朗开菲尔粒中的生物量可以增加81.34%[6]。在土耳其开菲尔粒接入牛奶(脂肪含量为0.1%)、25 ℃、100 rpm 培养24 h 的过程中,三种矿物质CuSO4·H2O、MnSO4·H2O和Na3PO4·12H2O(Cu2+、Mn2+和PO3?4浓度都为0.30 g/L)中除CuSO4·H2O 外后两者都可以增加开菲尔粒中的生物量,但维生素B1、B6、B9、B12 和维生素C 却抑制开菲尔粒中生物量的增加[8]。
另外,添加蜂蜜[47]、酪蛋白酸[48]等物质或改变培养温度[48]都可以改变开菲尔的流变性。
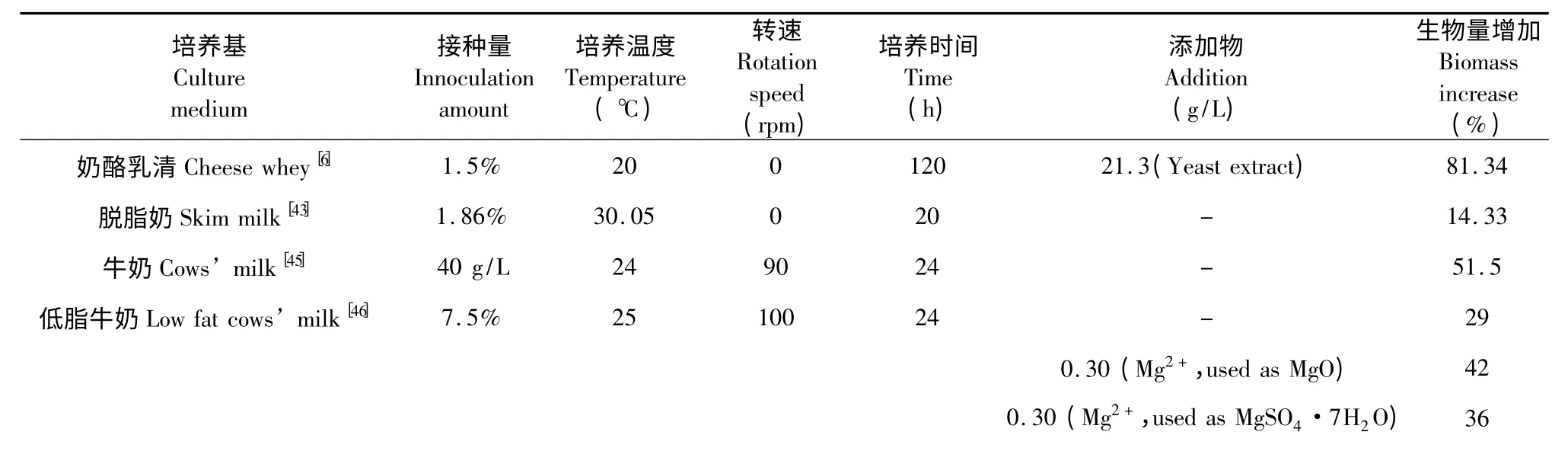
表1 影响开菲尔粒中生物量的因素Table 1 Factors effect on biomass increase in kefir grain

4.3 开菲尔混合饮料的开发
开菲尔混合饮料的开发研究也得到了广泛的关注。在奶或乳清中添加水果或其他原料(如石榴[7]、蜂蜜[47]、燕麦[49]、麦芽[50])一起进行发酵,可以得到口味不同的混合乳饮料。2014 年Sabokbar等发现:把石榴汁与乳清混合作为原料接入伊朗开菲尔粒可以生产新型的开菲尔果汁乳饮料,饮料的pH 降低、酸度增加、产生乳酸和乙酸、柠檬酸水平降低,并且这些变化与培养温度(19 ℃或25 ℃)和接种量(5%或8%,m/v)密切相关,当培养温度为25℃、接种量为8%时变化最大[7]。
5 展望
开菲尔具有抗病原菌促益生菌、抗毒素、免疫调节、降胆固醇、抗肿瘤和缓解乳糖不耐受性疾病症状等益生功能,在医药方面和食品工业具有巨大的应用潜能,体现出巨大的潜在市场价值。传统开菲尔乳饮料的生产主要受不同来源开菲尔粒的菌相组成和加工条件的影响,使其因开菲尔粒回收过程繁琐、发酵不均一、生产不一致而不适于大规模生产;目前商品化的开菲尔乳饮料生产主要利用从开菲尔粒中分离纯化的纯培养物进行工业发酵而来。但是,在功效上工业化生产的开菲尔与传统小规模生产相比都不太成功,可能开菲尔的益生功能、治疗特性与开菲尔粒中微生物的多样性、它们的互作有关或者与不同开菲尔粒来源的少量特定菌群有关[51]。目前奶片深受消费者的喜爱,而藏灵菇益生菌奶片也有研究报道[52]。因此,大规模工业化生产具有传统功效的开菲尔乳饮料、增加开菲尔产品类型已经成为开发开菲尔乳饮料的趋势,这需要加强研究,准确分离开菲尔粒中有益微生物,确定它们的互作性,这些研究成果必将推动传统功效开菲尔乳饮料大规模工业化生产,进而使开菲尔的应用价值得到更大程度的开发和体现。
1 Garrote GL,et al.Chemical and microbiological characteristization of kefir grains.J Dairy Res,2001,68:639-652.
2 Yang Y,et al.Proteomics evidence for kefir dairy in early bronze age China.J Archaeol Sci,2014,45:178-186.
3 Kolakowski P,et al.Restoration of kefir grains subjected to different treatments.Int J Dairy Technol,2012,65:140-145.
4 Xie N,et al.Kefir yeasts enhance probiotic potentials of Lactobacillus paracasei H9:the positive effects of coaggregation between the two strains.Food Res Int,2012,45:394-401.
5 Leite A,et al.Microbiological and chemical characterization of Brazilian kefir during fermentation and storage processes.J Dairy Sci,2013,96:4149-4159.
6 Ghasemlou M,et al.Enhanced production of Iranian kefir grain biomass by optimization and empirical modeling of fermentation conditions using response surface methodology.Food Bioproc Technol,2012,5:3230-3235.
7 Sabokbar N,et al.Characterization of pomegranate juice and whey based novel beverage fermented by kefir grains.J Food Sci Technol,2014,14:12-19.
8 Demirhan E,et al.Influence of vitamin (B1,B6,B9,B12,C)and ions (Cu2+,Mn2+,PO3-4)on kefir grain biomass growth.Food Sci Biotechnol,2013,22:1007-1013.
9 Santos A,et al.The antimicrobial properties of different strains of Lactobacillus spp.isolated from kefir.Syst Appl Microbiol,2003,26:434-437.
10 Bottazzi V,et al.A note on scanning electron microscopy of micro-organisms associated with the kefir granule.J Appl Bacteriol,1980,48:265-268.
11 Marshall VM,et al.Observations on the structure of kefir grains and the distribution of the microflora.J Appl Bacteriol,1984,57:491-497.
12 Magalhaes KT,et al.Brazilian Kefir:structure,microbial communities and chemical composition.Braz J Microbiol,2011,42:693-702.
13 Leite AMO,et al.Microbiological,technological and therapeutic properties of kefir:a natural probiotic beverage.Braz J Microbiol,2013,44:341-344.
14 Wang SY,et al.Investigation of microorganisms involved in biosynthesis of the kefir grain.Food Microbiol,2012,32:274-285.
15 Carasi P,et al.Safety characterization and antimicrobial properties of kefir-isolated Lactobacillus kefiri.Biomed Res Int,2014,2014:208974.
16 Ismaiel AA,et al.Milk kefir:ultrastructure,antimicrobial activity and efficacy on aflatoxin B1 production by Aspergillus flavus.Curr Microbiol,2011,62:1602-1609.
17 Londero A,et al.Fermented whey as poultry feed additive to prevent fungal contamination.J Sci Food Agric,2014,94:3189-3194.
18 Serafini F,et al.Kefir fermented milk and kefiran promote growth of Bifidobacterium bifidum PRL2010 and modulate its gene expression.Int J Food Microbiol,2014,178:50-59.
19 Bolla PAI,et al.Kefir-isolated Lactococcus lactis subsp.lactis inhibits the cytotoxic effect of Clostridium difficile in vitro.J Dairy Res,2013,80:96-102.
20 Kakisu E,et al.Lactobacillus plantarum isolated from kefir protects vero cells from cytotoxicity by type-II shiga toxin from Escherichia coli O157:H7.J Dairy Res,2013,80:64-71.
21 Vinderola CG,et al.Immunomodulating capacity of kefir.J Dairy Res,2005,72:195-202.
22 Romanin D,et al.Down-regulation of intestinal epithelial innate response by probiotic yeasts isolated from kefir.Int J Food Microbiol,2010,140:102-108.
23 Qu CQ (屈长青),et al.Antioxidant and immunological activity of whey isolated from Tibetan kefir milk.Nat Prod Res Dev (天然产物研究与开发),2014,26:1117-1119.
24 Zheng YC,et al.Probiotic properties of Lactobacillus strains isolated from Tibetan kefir grains.Plos one,2013,8:e69868.
25 Huang Y,et al.Characterization of Lactobacillus plantarum Lp27 isolated from Tibetan kefir grains a potential probiotic bacterium with cholesterol-lowering effects.J Dairy Sci,2013,96:2816-2825.
26 Maalouf K,et al.Kefir induces cell-cycle arrest and apoptosis in HTLV-1-negative malignant T-lymphocytes.Cancer Manag Res,2011,3:39-47.
27 Gao J,et al.Induction of apoptosis of gastric cancer cells SGC7901 in vitro by a cell-free fraction of Tibetan kefir.Int Dairy J,2012,30:14-18.
28 Ghoneum M,et al.Apoptotic effect of a novel kefir product,PFT,on multidrug-resistant myeloid leukemia cells via a hole-piercing mechanism.Int J Oncol,2014,44:830-837.
29 Hertzler SR,et al.Kefir improves lactose digestion and tolerance in adults with lactose maldigestion.J Am Diet Assoc,2003,103:582-587.
30 Rodrigues KL,et al.Antiinflammatory properties of kefir and its polysaccharide extract.Inflammopharmacology,2005,13:485-492.
31 Huseini H,et al.Evaluation of wound healing activities of kefir products.Burns,2012,38:719-723.
32 Patel S,et al.Potentials of exopolysaccharides from lactic acid bacteria.Indian J Microbiol,2012,52:3-12.
33 Piermaria J,et al.Gelling properties of kefiran,a food grade polysaccharide obtained from kefir grains.Food Hydrocoll,2008,22:1520-1527.
34 Pintado ME,et al.Microbiological and rheological studies on Portuguese kefir grains.Int J Food Sci Technol,1996,31:15-36.
35 Katechak IE,et al.Production of hard-type cheese using free or immobilized freeze-dried kefir cells as a starter culture.J Agric Food Chem,2008,56:5316-5323.
36 Kourkoutas Y,et al.Evaluation of freeze-dried kefir coculture as starter in feta-type cheese production.Appl Environ Microbiol,2006,72:6124-6135.
37 Piermaria J,et al.Kefiran films plasticized with sugars and polyols:water vapor barrier and mechanical properties in relation to their microstructure analyzed by ATR/FT-IR spectroscopy.Food Hydrocoll,2011,25:1261-1269.
38 Motedayen AA,et al.Development and characterization of composite films made of kefiran and starch.Food Chem,2013,136:1231-1238.
39 Mantzourani I,et al.Study of kefir grains application in sourdough bread regarding rope spoilage caused by Bacillus spp.Food Chem,2014,143:17-21.
40 Beshkova D,et al.Pure cultures for making kefir.Food Microbiol,2002,19:537-544.
41 Chen T,et al.Microbiological and chemical properties of kefir manufactured by entrapped microorganisms isolated from kefir grains.J Dairy Sci,2009,92:3002-3013.
42 Nambou K,et al.A novel approach of direct formulation of defined starter cultures for different kefir-like beverage production.Int Dairy J,2014,34:237-246.
43 Gao J,et al.Culture conditions optimization of Tibetan kefir grains by response surface methodology.Proced Eng,2012,37:132-136.
44 Bekatorou A,et al.Effect of various carbohydrate substrates on the production of kefir grains for use as a novel baking starter.Food Chem,2004,88:237-242.
45 Gorsek A,et al.Quantitative examination of process parameters during kefir grain biomass production.Int J Chem React Eng,2007,5:1-7.
46 Demirhan E,et al.A modelling study on kefir grain biomass growth:Influence of various minerals.Int J Dairy Technol,2011,64:402-407.
47 Dogan M.Rheological behaviour and physicochemical properties of kefir with honey.J Verbr Lebensm,2011,6:327-332.
48 Dimitrelia G,et al.Effect of incubation temperature and caseinates on the rheological behaviour of kefir.Procedia Food Sci,2011,1:583-588.
49 Zhang Z (张喆),et al.Fermentation technology of oat and milk with the Tibetan mushroom.China Brewing (中国酿造),2009,212:160-164.
50 Yue C (岳春),et al.The research of Tibetan kefir fermenting wort drink.China Brewing (中国酿造),2012,31:183-187.
51 Oliveira Leite AM,et al.Microbiological,technological and therapeutic properties of kefir:a natural probiotic beverage.Brazilian J Microbiol,2013,44,2:341-349.
52 Yuan YL (袁祎琳),et al.Production and quality analysis of Tibetan kefir milk slice.Trans CSAE (农业工程学报),2013,11:278-285.

