槲皮素-3-O-乙酸酯、槲皮素-3-O-丙酸酯的制备及抗血小板聚集活性
朱玉凤,薛 敏,段 煜
潍坊医学院药学院,潍坊 261053
营养学和流行病学研究表明黄酮的摄入量与心血管疾病的发生率呈反比关系[1-3]。槲皮素日摄入量约占黄酮日总摄入量的60%[4]。槲皮素具有显著的抗血小板聚集活性[5-9],这与其防治心血管疾病有直接的相关性,因此,槲皮素在制备防治心血管疾病的功能食品和药物中具有广泛的应用前景。然而,槲皮素在各类溶剂中的溶解性低、稳定性差,特别是在水中几乎不溶,这些性质影响了槲皮素的生物利用度和应用。
槲皮素的溶解性差,部分由于其平面的分子构型。分子间紧密堆砌,不利于溶剂进入分子间隙。通过酰化槲皮素的羟基将短脂肪烃基链引入槲皮素能破坏这种分子排列,从而改善溶解性。槲皮素的活性基团包括B 环的邻二酚羟基和C 环的4 位羰基及2、3 位间的双键[10,11]。保持这些活性基团完好,通过区域选择性酰化,将短脂肪烃基链引入槲皮素的3 位羟基,这是改善溶解性而保持生物活性的最佳方法。Saija 等和Montenegro 等的研究表明,将短脂肪烃基链引入槲皮素的3 位羟基不仅赋予槲皮素衍生物适宜的物理化学性质,而且保持了槲皮素的抗氧化性[12,13]。
目前,黄酮类化合物的区域选择性酰化多采用酶法或化学-酶结合法[14-20],而较少采用传统的化学酰化法。这是由于采用传统的化学酰化法,黄酮类化合物的多位羟基都可能被酰化而生成酰化混合物,导致生物活性降低甚至丧失。然而,目前有很多关于采用传统化学法合成其他类黄酮衍生物的报道,报道中均采用“活性基团保护-衍生化-去保护”的合成路线[21-24]。该合成路线为采用传统化学酰化法合成黄酮区域选择酰化衍生物提供了有价值的参考。
为了改善槲皮素的水溶性而不影响其抗血小板聚集活性,本文中以芦丁作为原料,采用“苄化-水解-酰化-加氢还原”四步化学合成法,合成了两个槲皮素酰化衍生物:槲皮素-3-O-乙酸酯(Q-ac)和槲皮素-3-O-丙酸酯(Q-pr),并用反相色谱法测定了这两个衍生物的水溶性,同时,采用体外和体内动物实验初步测定了这两个衍生物抗二磷酸腺苷(ADP)诱导的血小板聚集活性。
1 材料与方法
1.1 仪器和试剂
仪器:半制备高效液相色谱仪(Agilent1200,美国Agilent 公司),核磁共振仪(AVANCE 600,法国Bruker 公司),液相色谱-质谱联用仪(Agilent 6410,美国Agilent 公司),分析型高效液相色谱仪(LC-20AT,日本Shimadzu 公司),血小板聚集仪(LBYNJ4A,北京普利生仪器有限公司)。
试剂:芦丁(≥98%),生化试剂,购自南京替斯艾么中药技术研究所,临用前在110 ℃、1.3×103Pa下放置12 h 去除结晶水;乙酸酐和丙酰氯,均为分析纯,购自阿拉丁试剂有限公司;溴化苄,化学纯,N,N-二甲基甲酰胺(DMF),分析纯,均购自国药集团化学试剂有限公司,临用前重蒸;三乙胺,分析纯,购自天津科密欧化学试剂有限公式,临用前脱水;ADP,生化试剂,Sigma 公司产品,用前溶于生理盐水中;钯炭催化剂,10%,国药集团化学试剂有限公司;其他化学试剂购自当地化学试剂供应商。
1.2 实验动物
新西兰兔,体重2.0~3.0 kg,雄性,由山东鲁抗制药有限公司实验动物中心提供,合格证号:鲁实动证字0017075 号。
Wistar 大鼠,体重250~300 g,雄性,由山东鲁抗制药有限公司实验动物中心提供,合格证号:鲁实动证字0010061 号。
所有动物实验均获得潍坊医学院医学伦理委员会批准。
1.3 Q-ac、Q-pr 的合成
以芦丁为原料,采用四步合成路线“苄化-水解-酰化-加氢还原”制备Q-ac 和Q-pr。
第一步,苄化。根据Wuts 报道的方法[25],芦丁(24.42 g,40 mmol)和无水K2CO3(18.35g,133 mmol)依次在氮气氛下加入到160 mL 的DMF 中,室温下搅拌1 h,之后缓慢滴加溴化苄(16 mL,133 mmol)。滴加完毕后,于氮气氛下40 ℃搅拌反应3 h。反应完毕后,在冰浴下用10 %(体积比)的乙酸溶液调pH 为6.0,之后加入300 mL 去离子水,离心,弃上清,沉淀即为苄化产物。
第二步,水解。将苄化产物溶于600 mL 95 %(体积比)的乙醇中,加入90 mL 36 %(质量比)的浓盐酸,70 ℃下回流水解2 h。过滤,滤饼用去离子水洗至中性即得水解产物。
第三步,酰化。水解产物溶于200 mL 的DMF中,加入乙酸酐(44 mmol)或丙酰氯(44 mmol)和三乙胺(44 mmol),室温下搅拌反应。用硅胶60-GF254薄层层析板监测反应进程,展开剂,乙酸乙酯/甲醇/乙酸(6∶4∶0.1,体积比),在波长为254 nm 的紫外光下观察。反应直到原料点消失为止。加入400 mL 去离子水,过滤,滤饼即为酰化产物。
第四步,加氢还原。酰化产物溶解于5 L 的乙醇/二氧六环(1∶1,体积比)的混合溶剂中,加入2 g的钯炭催化剂,氢气氛下室温搅拌反应2 h。过滤除去催化剂,滤液真空脱溶剂即得Q-ac 或Q-pr 的粗品。
1.4 Q-ac、Q-pr 的纯化
Agilent 1200 半制备高效液相色谱仪用于纯化得到Q-ac 和Q-pr 的纯品。色谱柱:Agilent ZORBAX-SB C18半制备柱(250×9.4 mm,5 μm)。色谱条件:上样量200 μL;流速5 mL/min;柱温室温;流动相组成,Q-ac,乙腈/水(40∶60,体积比),Q-pr,乙腈/水(30∶70,体积比);254 nm 紫外检测。
1.5 水溶性的测定
槲皮素、Q-ac 和Q-pr 水溶性的测定依据Bonina等采用的方法[26]。具体为,过量的化合物溶解于含2 mL 去离子水的玻璃瓶中,聚四氟乙烯塞子密封,室温下磁力搅拌24 h,过滤。滤液为化合物的饱和水溶液,其浓度用Shimadzu LC-20AT 高效液相色谱仪测定,检测重复10 次。色谱柱:Shimadzu Shimpack VP-ODS C18色谱柱(250×4.60 mm,5 μm)。色谱条件:上样量20 μL;流速1 mL/min;柱温室温;流动相组成,水/甲醇(30∶70,体积比);254 nm 紫外检测。
1.6 抗血小板聚集活性的测定
1.6.1 体外实验
富血小板血浆(PRP)和贫血小板血浆(PPP)的制备依据文献[27],具体为,新西兰兔颈动脉取血,以3.8%枸橼酸钠抗凝(血与抗凝剂的体积比为9∶1),收集于塑料离心管中,室温下以1400 rpm 离心8 min,取上层液即为PRP,剩余血液继续以4000 rpm离心15 min,取上层液即为PPP。测定时,用PPP 调PRP 中的血小板数为约5×108cell/mL。
比浊法测定血小板聚集率[27]。首先用300 μL的PPP 调零,之后比浊管中加入300 μL 的PRP,药物组分别加入不同浓度的槲皮素、Q-ac 及Q-pr 的二甲基亚砜(DMSO)溶液各3 μL(DMSO 的终体积不得超过1.0%,防止引起假阳性结果),阴性对照组加入3 μL 的DMSO。37℃孵育5 min 后,加入ADP溶液,使其终浓度为7 μmol/L,记录5 min 内的最大聚集率。血小板聚集抑制率按下式计算:抑聚率(%)=[(1-药物组聚集率/阴性对照组聚集率)]×100
1.6.2 体内实验
Q-ac、Q-pr 和槲皮素分别溶解于30%的丙二醇水溶液中。
Wistar 大鼠随机分为4 组,每组8 只。Q-ac 组、Q-pr 组、槲皮素组分别尾静脉注射给药,剂量参照文献[7],均为30 μmol/kg。阴性对照组,尾静脉注射0.5 mL 30%的丙二醇水溶液。给药30 min 后,心脏取血。血样处理和血浆制备与体外实验相同。
比浊法测定血小板聚集率。首先用300 μL 的PPP 调零,之后比浊管中加入300 μL 的PRP,37 ℃孵育5 min 后,加入ADP 溶液,使其终浓度为7 μmol/L,记录5 min 内的最大聚集率。血小板聚集抑制率的计算同体外实验。
2 结果与讨论
2.1 槲皮素的区域选择性酰化
槲皮素分子中有五个化学性质相似的羟基,为确保酰化选择性发生在槲皮素的3 位羟基,我们选用芦丁为原料,采用了“活性基团保护-衍生化-去保护”的合成策略。合成路线包括四个步骤,见图1。
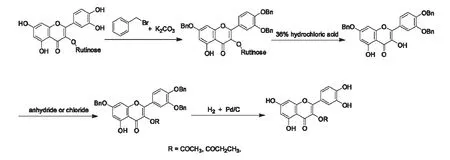
图1 槲皮素3-O-酰化衍生物的合成路线Fig.1 The four step synthetic route of quercetin-3-O-acylated derivatives
第一步,苄化。加入3.3 倍摩尔量的无水K2CO3作为催化剂,使槲皮素的3'、4'和7 位羟基形成氧负离子,而5 位羟基与4 位羰基形成分子内氢键而无法形成氧负离子[28]。加入3.3 倍摩尔量的苄化溴,使氧负离子形成苄氧基,生成3',4',7-O-三苄基芦丁。为了避免产生C-烷基化的衍生物,非质子溶剂DMF 作为反应溶剂。第二步,水解3',4',7-O-三苄基芦丁的苷键,暴露3 位羟基。第三步,酰化。虽然3 位和5 位的羟基均有可能与4 位羰基形成分子内氢键,但是氢键具有方向性和饱和性,5 位羟基更容易形成分子内氢键而呈现反应惰性[29]。加入稍微过量即1.1 倍摩尔量的三乙胺作为碱性催化剂和1.1 倍摩尔量的酰基供体(乙酸酐或丙酰氯),仅3 位羟基发生酰化,生成3',4',7-O-三苄基-3-O-酰化槲皮素。第四步,加氢还原反应脱去3'、4'、7 位的苄基,生成槲皮素3-O-酰化衍生物的粗产物。
半制备型高效液相色谱纯化粗产物,得到两个高度纯化的Q-ac 和Q-pr,其产率分别为75%,81%,均为黄色粉末。
2.2 酰化衍生物的结构表征
酰化衍生物中脂肪酰基的数量和位置由1H NMR、13C NMR 和MS 谱进行了表征。
1H NMR 谱中,两个酰化衍生物的3'位、4'位、7位和5 位羟基中的活泼质子都消失了,这是3-取代槲皮素的显著特征,如芦丁。13C NMR 谱中,Q-ac 和Q-pr 的酯羰基碳的化学位移分别在168.50 ppm 和171.78 ppm,这表明成功将脂肪酰基引入槲皮素;槲皮素3 位碳的化学位移在136.18 ppm,而Q-ac 和Q-pr 3 位碳的化学位均向高频移动,分别在130.06 ppm 和130.06 ppm;此外,槲皮素2 位碳的化学位移在147.30 ppm,而Q-ac 和Q-pr 2 位碳的化学位移均向低频移动,分别在150.32 ppm 和156.36 ppm;衍生物和槲皮素的其它碳的化学位移相同。上述分析表明,酰化选择性地发生在槲皮素的3 位羟基。(见图1)。
酰化衍生物的MS 谱进一步证实了其分子结构。对于Q-ac,367.1 m/z 分子离子峰与Q-ac 和Na+的分子量之和相一致;对于Q-pr,381.1 m/z 分子离子峰与Q-pr 与Na+的分子量之和相一致。
槲 皮 素,1H NMR(DMSO-d6,600 MHz)δ:12.50(1H,s,5-OH),10.77(1H,s,7-OH),9.35(3H,br s,3,3',4'-OH),7.68(1H,d,H-2'),7.55(1H,dd,H-6'),6.89(1H,d,H-5'),6.41(1H,d,H-8),6.19(1H,d,H-6);13C NMR(DMSO-d6,600 MHz)δ:176.31(C-4),164.35(C-7),161.20(C-9),156.62(C-5),148.17(C-4'),147.30(C-2),145.53(C-3'),136.18(C-3),122.44(C-1'),120.44(C-6'),116.07(C-5'),115.56(C-2'),103.49(C-10),98.65(C-6),93.81(C-8).
Q-ac,1H NMR(DMSO-d6,600 MHz)δ:7.33(1H,d,H-2'),7.27(1H,d,H-6'),6.92(1H,d,H-5'),6.48(1H,d,H-8),6.25(1H,d,H-6),2.68(2H,t,CH2),1.15(3H,t,CH3);13C NMR(DMSOd6,600 MHz)δ:175.41(C-4),168.50(C=O),165.18(C-7),161.58(C-9),156.72(C-5),150.32(C-2),148.27(C-4’),146.22(C-3'),130.06(C-3),122.98(C-1'),121.12(C-6'),116.51(C-5'),115.46(C-2'),103.71(C-10),98.85(C-6),94.75(C-8),20.80(CH3);ESI-MS m/z 367.1(calcd for C17H12O8·Na+,367.1)。
Q-pr,1H NMR(DMSO-d6,600 MHz)δ:12.23(1H,s,5-OH),10.67(1H,br,s,7-OH),9.72(3H,br s,3,3',4'-OH),7.33(1H,d,H-2'),7.27(1H,d,H-6'),6.92(1H,d,H-5'),6.48(1H,d,H-8),6.25(1H,d,H-6),2.68(2H,t,CH2),1.15(3H,t,CH3);13C NMR(DMSO-d6,600 MHz)δ:175.39(C-4),171.78(C=O),165.18(C-7),161.54(C-9),157.08(C-5),156.36(C-2),149.78(C-4’),145.95(C-3'),130.06(C-3),120.98(C-1'),120.08(C-6'),116.45(C-5'),115.46(C-2'),103.89(C-10),99.55(C-6),94.56(C-8),27.08(CH2),9.32(CH3);ESI-MS m/z 381.1(calcd for C18H14O8·Na+,381.1)
2.3 Q-ac 和Q-pr 的水溶性
Q-ac、Q-pr 和槲皮素的色谱保留时间分别为5.2 min、10.13 min 和7.3 min,见图2。
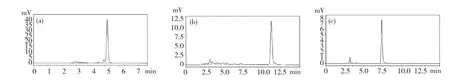
图2 Q-ac(a)、Q-pr(b)和槲皮素(c)的高效液相色谱图Fig.2 HPLC chromatograms of Q-ac(a),Q-pr(b)and quercetin(c)
经测定,Q-ac、Q-pr 及槲皮素在水中的溶解度分别为243.27±19.27 μg/mL、8.13±0.88 μg/mL和1.98±0.11 μg/mL。Q-ac 的水溶性远大于槲皮素,溶解度是槲皮素的122.9 倍。Q-pr 的溶解度也大于槲皮素,且具有显著性差异(P<0.001)。说明,通过区域选择性酰化,在槲皮素的3 位羟基引入短脂肪烃链能显著增加水溶性,这与Saija 等和Montenegro 等的研究结果相似[12,13]。这很可能是因为短脂肪烃基链破坏了槲皮素分子间的紧密堆砌,溶剂更容易进入分子间隙,从而增大溶解性。随着脂肪烃基链增长,疏水性增大,衍生物的水溶性下降,因此Q-pr 的溶解度小于Q-ac。
Q-ac、Q-pr 及槲皮素在水中的溶解度与参考文献[12,13]不一致。可能是由于色谱条件不同。Saija等[12]采用水/乙腈/四氢呋喃/三氟乙酸(58.8∶40∶1.2∶0.06)为流动相,紫外检测波长为254 nm,Montenegro 等[13]采用乙腈/0.17 mol/L 的醋酸(35∶65)为流动相,紫外检测波长为350 nm。对于难溶甚至不溶的槲皮素及槲皮素-3-O-脂肪酸衍生物,出峰的强度与其在流动相中的溶解度及紫外吸收波长有直接关系。虽然各种条件下测定的结果均不同,但都能得到结论:通过酰化将短脂肪碳链引入槲皮素3 位能够改善水溶性。
2.4 抗血小板聚集活性
通过体外和体内动物实验初步评价了Q-ac、Qpr 和槲皮素抗ADP 诱导的血小板聚集,实验结果见图3 和图4。

图3 Q-ac、Q-pr 和槲皮素体外抗ADP 诱导的血小板聚集(n=6)Fig.3 Q-ac,Q-pr and quercetin inhibited platelet aggregation induced by ADP in vitro(n=6)
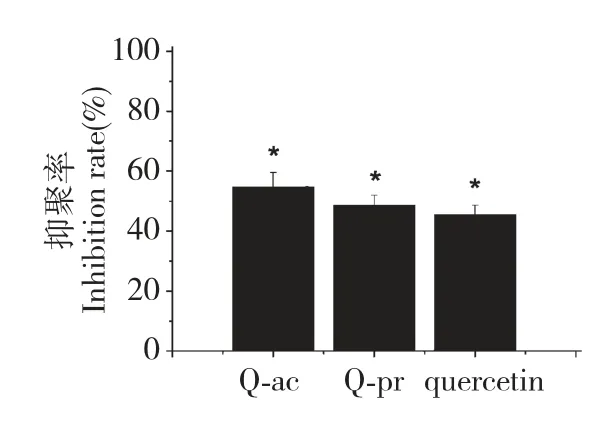
图4 Q-ac、Q-pr 和槲皮素体内抗ADP 诱导的血小板聚集(n=6)Fig.4 Q-ac,Q-pr and quercetin inhibited platelet aggregation induced by ADP in vivo(n=6)
酰化区域选择性地发生在槲皮素的3 位羟基,而其它活性基团没有变化,预期衍生化不会影响抗血小板聚集活性。实验结果正如我们预期,在体外实验中,Q-ac 和Q-pr 均能抑制ADP 诱导的血小板聚集,抑聚率均呈良好的浓度依赖性(见图3)。Qac、Q-pr 和槲皮素的体外IC50分别为94.1 μmol/L、204.9 μmol/L 和255.7 μmol/L。Q-ac 和Q-pr 的IC50均小于槲皮素,其中Q-ac 最小,其次为Q-pr。体内实验中,Q-ac 和Q-pr 的抑聚率均大于槲皮素的抑聚率(见图4)。体外和体内实验均表明,Q-ac 和Q-pr 比它们的前体槲皮素具有更显著的抗血小板聚集活性。这大概是由于Q-ac 和Q-pr 具有适当的水溶性,利于它们迁移穿过水性环境插入到血小板的生物膜,并定位于疏水内核。Saija 等人用差示扫描量热法研究了Q-ac、Q-pr、槲皮素-3-O-棕榈酸酯与二磷酸胆酰碱多层囊泡、单层囊泡的相互作用,认为,引入短脂肪烃基链使槲皮素衍生物具有了适宜的物化性质,能够迁移通过水性环境,并与双层膜发生相互作用[12]。这很可能是Q-ac 和Q-pr 具有比槲皮素更强的抗血小板聚集活性的原因。
3 结论
槲皮素具有显著的抗血小板聚集活性,本研究用含有短脂肪烃基链的酰基供体选择性酰化槲皮素的3 位羟基,生成的衍生物Q-ac 和Q-pr 具有更高的水溶性和更强的抗血小板聚集活性,对开发槲皮素为防治心血管疾病的功能性食品和药物具有研究和应用意义。
1 Peterson JJ,Dwyer JT,Jacques PF,et al.Associations between flavonoids and cardiovascular disease incidence or mortality in European and US populations.Nutr Rev,2012,70:491-508.
2 Arab L,Khan F,Lam H.Tea consumption and cardiovascular disease risk.Am J Clin Nutri,2013,98:1651S-1659S.
3 Dam VRM,Naidoo N,Landberg R.Dietary flavonoids and the development of type 2 diabetes and cardiovascular diseases:review of recent findings.Curr Opin Lipidol,2013,24:25-33.
4 Hertog MGL,Hollman PCH,Katan MB,et al.Intake of potentially anticarcinogenic flavonoids and their determinants in adults in The Netherlands.Nutri Cancer,1993,20:21-29.
5 Pignatelli P,Pulcinelli FM,Celestini A,et al.The flavonoids quercetin and catechin synergistically inhibit platelet function by antagonizing the intracellular production of hydrogen peroxide.Am J Clin Nutri,2000,72:1150-1155.
6 Leyre NN,María LL,Constantino M,et al.Effect of quercetin on platelet spreading on collagen and fibrinogen and on multiple platelet kinases.Fitoterapia,2010,81:75-80.
7 Mosawy S,Jackson DE,Woodman OL,et al.Treatment with quercetin and 3',4'-dihydroxyflavonol inhibits platelet function and reduces thrombus formation in vivo.J Thromb Thrombolysis,2013,36:50-57.
8 Oh WJ,Endale M,Park SC,et al.Dual roles of quercetin in platelets:phosphoinositide-3-kinase and MAP kinases inhibition,and cAMP-dependent vasodilator-stimulated phosphoprotein stimulation.Evid Based Complement Alternat Med,2012,2012:4852-4862.
9 Chen Y,Deuster P.Comparison of quercetin and dihydroquercetin:antioxidant-independent actions on erythrocyte and platelet membrane.Chem Biol Interact,2009,182:7-12.
10 Hou LF,Zhou B,Yang L,et al.Inhibition of human low density lipoprotein oxidation by flavonols and their glycoside.Chem Phys Lipids,2004,129:209-219.
11 Vayaa J,Mahmooda S,Goldblumb A,et al.Inhibition of LDL oxidation by flavonoids in relation to their structure and calculated enthalpy.Phytochemistry,2003,62:89-99.
12 Saija A,Tomaino A,Trombetta D,et al.“In vitro”antioxidant and photoprotective properties and interaction with model membranes of three new quercetin esters.Eur J Pharm Biopharm,2003,56:167-174.
13 Montenegro L,Carbone C,Maniscalco C,et al.In vitro evaluation of quercetin-3-O-acyl esters as topical prodrugs.Int J Pharm,2007,336:257-262.
14 Chebil L,Anthoni J,Humeau C,et al.Enzymatic acylation of flavonoids:effect of the nature of substrate,origin of lipase,and operating conditions on conversion yield and regioselectivity.J Agric Food Chem,2007,55:9496-9502.
15 Duan Y,Du ZL,Yao YY,et al.Effect of molecular sieves on lipase-catalyzed esterification of rutin with stearic acid.J Agric Food Chem,2006,54:6219-6225.
16 Katsoura MH,Polydera AC,Tsironis L,et al.Use of ionic liquids as media for the biocatalytic preparation of flavonoid derivatives with antioxidant potency.J Biotechnol,2006,123:491-503.
17 Ma X,Yan R,Yu S,et al.Enzymatic acylation of isoorientin and isovitexin from bamboo-leaf extracts with fatty acids and antiradical activity of the acylated derivatives.J Agric Food Chem,2012,60:10844-10849.
18 Sardone L,Pignataro B,Castelli F,et al.Temperature and pressure dependence of quercetin-3-O-palmitate interaction with a model phospholipid membrane:film balance and scanning probe microscopy study.J Colloid Interf Sci,2004,271:329-335.
19 Patti A,Piattelli M,Nicolosi G.Use of Mucor miehei lipase in the preparation of long chain 3-O-acylcatechins.J Mol Catal B:Enzym,2000,10:577-582.
20 Lambusta D,Nicolosi G,Patti A,et al.Enzyme-mediated regioprotection-deprotection of hydroxyl groups in(+)-catechin.Synthesis,1993,1993:1155-1158.
21 Thapa M,Kim Y,Desper J,et al.Synthesis and antiviral activity of substituted quercetins.Bioorg Med Chem Lett,2012,22:353-356.
22 Wang RE,Kao JLF,Hilliard CA,et al.Inhibition of heat shock induction of heat shock protein 70 and enhancement of heat shock protein 27 phosphorylation by quercetin derivatives.J Med Chem,2009,52:1912-1921.
23 Madhukar M,Sawraj S,Sharam PD.Design,synthesis and evaluation of mutual prodrug of 4-biphenylacetic acid and quercetin tetramethyl ether(BPA-QTME)as gastroparing NSAID.Eur J Med Chem,2010,45:2591-2596.
24 She J(佘戟),Mo LE(莫丽儿),Kang TB(康铁邦),et al.Synthesis and biological activity of water-soluble derivative of quercetin.Chin J Med Chem(中国药物化学杂志),1998,8:287-289.
25 Wuts PGM,Greene TW.Greene’s Protective Groups in Organic Synthesis,Fourth Edition.New Jersey:JohnWiley &Sons,Inc,2007.370-406.
26 Bonina FP,Montenegro L,Capraris PD,et al.1-Alkylazacycloalkan-2-one esters as prodrugs of indomethacin for improved delivery through human skin.Int J Pharm,1991,77:21-29.
27 Chen P(陈鹏),Yang LC(杨丽川),Lei WY(雷伟亚),et al.Effects of polydatin on platelet aggregation and cytosolic calcium.Nat Prod Res Dev(天然产物研究与开发),2005,17:21-25.
28 Li HJ(李化军).Studies on the synthesis of the 3-substituted quercetin.Beijing:Academy of Military Medical Sciences(军事医学科学院),MsD.2004.
29 Wang KJ(王克军),Li HJ(李华军),Zhao YM(赵毅民).Phase-transter-catalyzed synthesis of hirsutrin and hyperin.Pharm.J Chin PLA(解放军药学学报),2005,21:85-87.

