反柄紫芝中二个新生物碱
田 磊,王心龙,王彦志,程永现*
1 河南中医学院,郑州 450008;2中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,昆明 650201
灵芝是我国传统名贵中药,素有“仙草”之美称,最早记载于《神农本草经》,被列为上品[1],灵芝属种类较多,《中华人民共和国药典》仅收载了赤芝(Ganoderma lucidum)或紫芝(G.sinensis)的干燥子实体作为药材正品来源[2],其实灵芝属多种真菌在我国民间被广泛应用并在药材市场流通。以往研究发现灵芝可调节人体代谢和内分泌功能,对免疫系统、神经系统、心血管系统、呼吸系统等均具有较好的干预效果,同时还具有保肝、抗肿瘤、抗氧化、延缓衰老、抗炎等作用[3],临床上或民间被广泛用于治疗多种疾病,如慢性支气管炎、消化不良、神经衰弱、慢性肝炎、高血压、肿瘤、AIDS 等[4]。虽然灵芝属的研究已进行多年,但其化学成分多局限于三萜、多糖和生物碱[5,6],近年,我们从灵芝中发现了一系列活性杂萜,引起了业界高度关注[7-9]。反柄紫芝与紫芝功能相近,形态上反柄紫芝的柄是反背而生,前期我们对其进行了研究,曾报道灵芝杂萜cochlearols A和B 的结构及其肾保护作用[10]。进一步对其进行深入研究过程中,从中分离得到6 个化合物,其中2个为新生物碱,该研究将进一步丰富人们对灵芝化学的认识。
1 仪器与材料
Shimazu UV2401PC 紫外可见光分光光度计,Waters Xevo TQ-S 质谱仪及API QSTAR Pulsar i 质谱仪;Bruker AM-400 及Avance III 600 MHz 核磁共振仪(TMS 作为内标,δ 为ppm,J 为Hz);200~300目柱色谱用硅胶、硅胶H 和GF254 薄层色谱用硅胶(青岛海洋化工厂);45~75 μm MCI gel CHP 20P(日本三菱公司产品);25~100 μm Sephadex LH-20(Pharmacia 公司);40~63 μm RP-18(日本Daiso)。
反柄紫芝于2013 年9 月购自中国广东省广州同康药业有限公司,样品经中国科学院昆明植物研究所杨祝良研究员鉴定,凭证标本(CHYX-0570)保存于中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室。
2 提取与分离
取反柄紫芝子实体100 kg,粉碎后用70%的乙醇室温提取(6×300 L×48 h),浓缩得总提物(10 kg)。总提物用水适当稀释后用乙酸乙酯萃取3 次,得到乙酸乙酯部分2 kg。经硅胶色谱柱进行分离,以氯仿-甲醇(100∶1~1∶1)梯度洗脱,得到7 个组分(F1~F7)。F5(61 g)经MCI gel CHP 20P 柱以甲醇-水(10%~100%)梯度洗脱得到3 个组分(F5.1、F5.2、F5.3)。F5.2(14 g)经正相柱硅胶色谱柱,以氯仿-甲醇(50∶1~1∶1)梯度洗脱得到4 段组分(F5.2.1~F5.2.4)。F5.2.3(3 g)经Sephadex LH-20 柱(MeOH),RP-18 柱,以甲醇-水(50%~70%)洗脱,得到化合物1(4 mg)和2(1 mg)。F5.2.4(4 g)经MCI gel CHP 20P 柱,以甲醇-水(10%~50%)梯度洗脱,制备薄层,用氯仿-甲醇(10∶1)展开,再经Sephadex LH-20 柱(MeOH),得化合物3(2 mg)。F5.3(5 g)经RP-18 柱,以甲醇-水(60%~90%)洗脱,再经 Sephadex LH-20 柱(MeOH),得化合物4(2 mg)、5(6 mg)和6(1 mg)。
3 结构鉴定
化合物1 黄色粉末,由13C NMR、DEPT 谱及高分辨质谱{m/z:228.1022[M+H]+(calcd for C14H14NO2,228.1025)}确定其分子式为C14H13NO2,计算其不饱和度为9。化合物1 的1H NMR 谱芳香区出现三个质子信号[δH7.27(1H,brs),δH6.78(2H,overlapped)],提示结构中可能含有一个ABX 系统;低场区的二个质子信号δH8.38(1H,s)和δH7.85(1H,s),提示结构中还可能含有一个1,2,4-三取代芳杂环;高场区显示三个亚甲基信号[δH3.02(2H,t,J=7.5 Hz),δH2.98(2H,t,J=7.5 Hz),δH2.15(2H,q,J=7.5 Hz)]。13C NMR 和DEPT 谱显示14个碳信号,包括3 个sp3杂化的亚甲基,5 个sp2杂化的次甲基,6 个烯区/芳香区季碳。以上信号与化合物sinensine D 相似[11],提示它们是类似物,其区别在于化合物sinensine D 的6-OH 在化合物1 中消失,这可从1H-1H COSY 谱中H-4/H-5/H-6(δH2.98)的相关加以证明(图1),同时,H-4/C-3,C-9和H-6/C-7,C-8 的HMBC 相关也进一步表明了五元环的连接位置(图1)。化合物1 与sinensine D 的另一区别是化合物sinensine D 中的酚羟基已成环,而化合物1 中的2'-OH 是游离的,这可由1H NMR(DMSO-d6)谱显示两个游离羟基质子信号5'-OH(1H,δH8.88,s)和2'-OH(1H,δH13.63,s)得到证明。另外,HMBC 谱中H-6'/C-2,C-5'(δC112.9)的相关进一步证明了苯环上OH 位置。因此,化合物1 的结构得以确定,其为一个新的生物碱,命名为ganocochlearine A。

图1 化合物1 的关键HMBC 和COSY 相关Fig.1 Key HMBC and COSY correlations for compound 1
化合物2 黄色粉末,由13C NMR、DEPT 谱及高分辨质谱{m/z:242.1177[M+H]+(calcd for C15H16NO2,242.1181)}确定其分子式为C15H15NO2,计算其不饱和度为9。1H NMR 谱和13C NMR 谱与化合物1 相比较较为相似,提示它们是类似物,其区别在于化合物2 较化合物1 多了一个甲基信号,HMBC谱中H3-10/C-6,C-7,C-8 的相关表明H3-10 与C-6相连。化合物1 和2 的另一区别是五元环的位置发生了变化。HMBC 谱中H-3/C-9,C-2,H-6',H-7/C-2,H-5/C-8,C-6 的相关表明了五元环的连接位置(图2)。至此可确定化合物2 为一个新的生物碱,命名为ganocochlearine B。
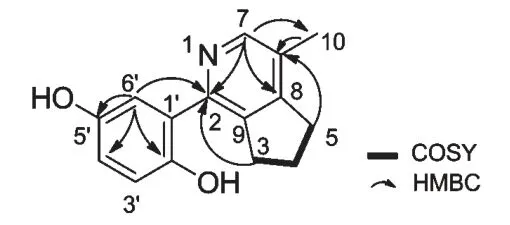
图2 化合物2 的关键HMBC 和COSY 相关Fig.2 Key HMBC and COSY correlations for compound 2
化合物1 黄色粉末,UV(MeOH)λmax(log ε)343(3.83),265(4.15),213(4.41)nm;ESI-MS:m/z 228[M+H]+,HR-ESI-MS:m/z 228.1022[M+H]+(calcd for C14H14NO2,228.1025);1H NMR(400 MHz,CD3OD)及13C NMR(150 MHz,CD3OD)数据见表1。
化合物2 黄色粉末,UV(MeOH)λmax(log ε)336(3.33),255(3.64),205(4.10)nm;ESI-MS:m/z 242[M+H]+,HR-ESI-MS:m/z 242.1177[M+H]+(calcd for C15H16NO2,242.1181);1H NMR(600 MHz,CD3OD)及13C NMR(150 MHz,CD3OD)数据见表1。
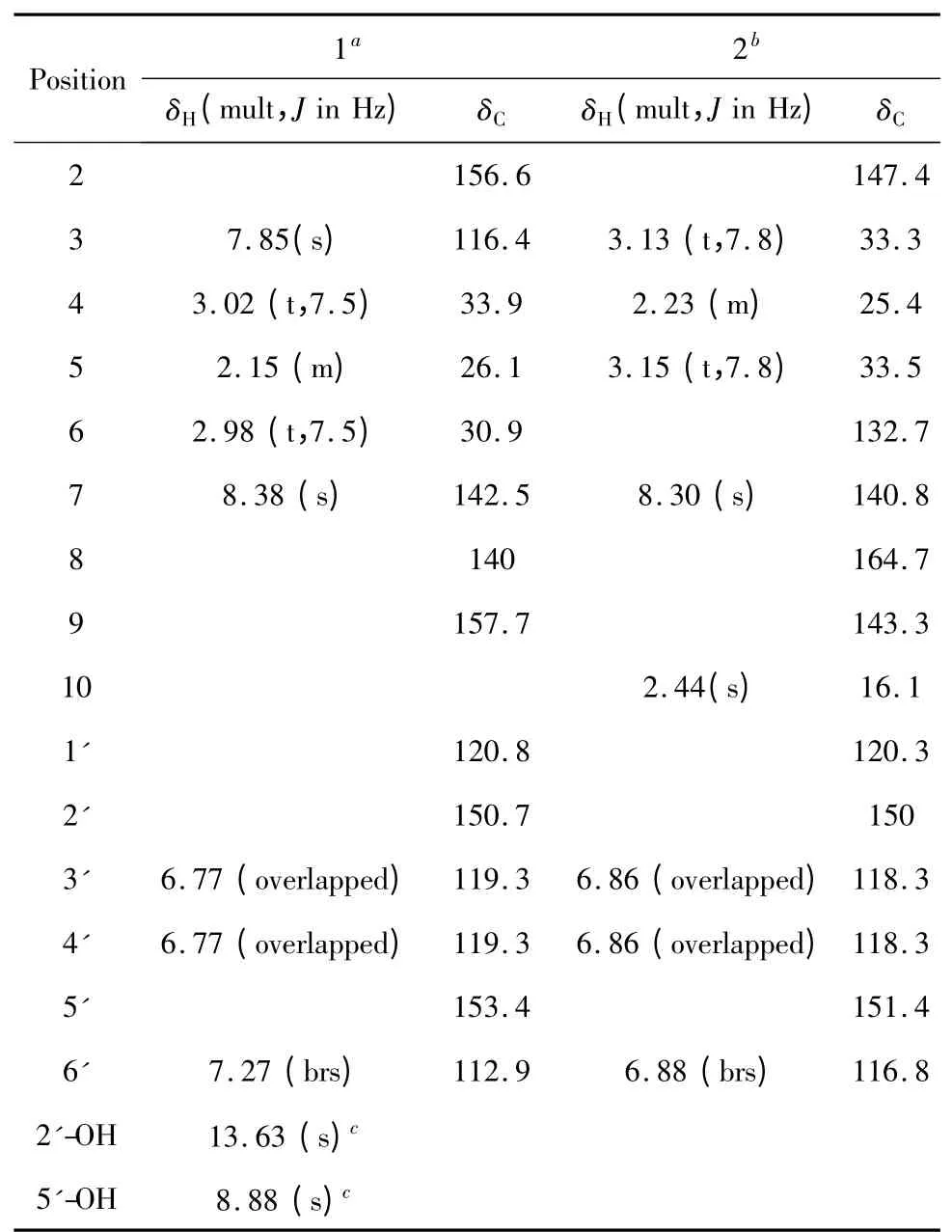
表1 化合物1 和2 在氘代甲醇中的核磁共振数据Table 1 NMR data of 1 and 2 in methanol-d4(δ,ppm)
化合物3 淡黄色粉末,1H NMR(400 MHz,CD3OD)δ:8.26(1H,d,J=8.0 Hz,H-5),7.97(1H,d,J=7.2 Hz,H-3),7.70(1H,m,H-7),7.59(1H,d,J=8.0 Hz,H-8),7.42(1H,m,H-6),6.34(1H,d,J=7.2 Hz,H-2);13C NMR(150 MHz,CD3OD)δ:141.6(C-2),109.8(C-3),180.7(C-4),126.7(C-5),125.3(C-6),133.5(C-7),119.6(C-8),141.6(C-9),126.1(C-10)。以上数据和文献[12]基本一致,故确定化合物3 为2,3-dihydro-4(1H)-quinolone。
化合物4 淡黄色粉末,1H NMR(400 MHz,CD3OD)δ:7.94(1H,d,J=7.2 Hz,H-3),7.71(1H,dd,J=8.2,0.8 Hz,H-5),7.24(1H,t-like,J=8.0 Hz,H-6),7.12(1H,dd,J=7.6,0.8 Hz,H-7),6.36(1H,d,J=7.2 Hz,H-2);13C NMR(150 MHz,CD3OD)δ:132.3(C-2),109.7(C-3),180.8(C-4),115.5(C-5),116.0(C-6),125.3(C-7),148.3(C-8),140.5(C-9),127.8(C-10)。以上数据和文献[12]基本一致,故确定化合物4 为8-hydroxy-2,3-dihydro-4(1H)-quinolone。
化合物5 白色粉末,1H NMR(400 MHz,CD3OD)δ:3.39(1H,d,J=11.0 Hz,Ha-28),3.15(1H,d,J=11.0 Hz,Hb-28),2.63(1H,overlapped,Ha-12),2.43(1H,d,J=18.2 Hz,Hb-12),2.40(1H,overlapped,Ha-1),2.36(1H,overlapped,Ha-2),2.33(1H,overlapped,Ha-23),2.24(1H,overlapped,Hb-23),2.19(1H,overlapped,H-5),2.19(1H,overlapped,Hb-2),2.16(2H,overlapped,H-6),2.08(1H,overlapped,Ha-16),1.94(1H,overlapped,Ha-15),1.85(1H,overlapped,Ha-22),1.82(1H,overlapped,Hb-1),1.77(1H,overlapped,H-17),1.52(1H,overlapped,H-20),1.51(1H,overlapped,Hb-16),1.48(1H,overlapped,Hb-15),1.38(3H,s,H-19),1.38(3H,s,H-29),1.33(1H,overlapped,Hb-22),1.06(3H,s,H-30),1.01(3H,s,H-18),0.91(3H,d,J=6.4 Hz,H-21);13C NMR(150 MHz,CD3OD)δ:38.2(C-1),30.2(C-2),176.3(C-3),87.9(C-4),48.6(C-5),32.6(C-6),74.1(C-7),163.6(C-8),136.4(C-9),42.2(C-10),202.4(C-11),51.5(C-12),46.2(C-13),52.0(C-14),30.2(C-15),27.8(C-16),51.1(C-17),18.3(C-18),25.6(C-19),37.1(C-20),18.3(C-21),32.0(C-22),31.9(C-23),176.3(C-24),71.4(C-28),24.9(C-29),24.8(C-30)。以上数据和文献[13]基本一致,故确定化合物5 为fornicatin A。
化合物6 白色粉末,1H NMR(400 MHz,CD3OD)δ:7.24(5H,m,Ar-H),4.32(1H,m,H-6),3.72(1H,m,H-3),3.25(1H,d,J=4.7 Hz,Ha-11),3.0(1H,dd,J=13.8,4.7 Hz,Hb-11),1.42(1H,m,H-7),0.72(3H,d,J=8.0 Hz,H-9),0.67(3H,d,J=4.0 Hz,H-10);13C NMR(100 MHz,CD3OD)δ:169.3(C-2,C-5),60.8(C-3),57.2(C-6),39.8(C-7),24.7(C-8),12.0(C-9),15.3(C-10),39.7(C-11),137.0(C-12),131.7(C-13,C-17),129.5(C-14,C-16),128.2(C-15)。以上数据和文献[14]基本一致,故确定化合物6 为(3S,6S)-3-[(1'S)-1-methylpropyl]-6-(phenylmethyl)-piperazine-2,5-dione。
1 Liu SY(刘思妤),Wang Y(王艳),He RR(何蓉蓉),et al.The chemical constituents of Ganoderma lucidum.J Shenyang Pharm Univ(沈阳药科大学学报),2008,25:183-187.
2 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People’s Republic of China(中华人民共和国药典).Beijing:China Medical Science Press,2010.Vol I,363.
3 EI-Mekkawy S,Meselhy R,Nakamura N,et al.Anti-HIV-1 and anti-HIV-1-proteasesubs tancesfrom Ganoderma lucidum.Phytochemistry,1998,49:1651-1657.
4 Hu LL(胡丽丽),Ma QY(马青云),Huang SZ(黄圣卓).Chemical constituents in Ganoderma tropicum.Chin J Med Chem(中国药物化学杂志),2013,23:115-119.
5 Cheng CR,Yue QX,Wu ZY,et al.Cytotoxic triterpenoids from Ganoderma lucidum.Phytochemistry,2010,73:1579-1585.
6 Ma L(马林),Wu F(吴丰),Chen RY(陈若芸).Analysis of triterpene constituents from Ganoderma lucidum.Acta Pharm Sin(药学学报),2003,38:50.
7 Yan YM,AI J,Zhou LL,et al.Lingzhiols,unprecedented ro-tary door-shaped meroterpenoids as potent and selective inhibitors of p-smad3 from Ganoderma lucidum.Org Lett,2013,15:5488-5491.
8 Luo Q,Wang XL,Di L,et al.Isolation and identification of renoprotetive substances from the mushroom Ganoderma lucidum.Tetrahedr Lett,2015,71:840-845.
9 Luo Q,Di L,Dai WF,et al.Applanatumin A,a new dimeric meroterpenoid from Ganoderma applanatum that displays potent antifibrotic activity.Org Lett,2015,17:1110-1113.
10 Dou M,Di L,Zhou LL,et al.Cochlearols A and B,polycyclic meroterpenoids from the fungus Ganoderma cochlear that have renoprotective activities.Org Lett,2014,16:6064-6067.
11 Liu JQ,Wang CF,Peng XR,et al.New alkaloids from the fruiting bodies of Ganoderma sinense.Nat Prod Biopr,2011,1:93-96.
12 Lange J,Bissember AC,Banwell MG,et al.Synthesis of 2,3-dihydro-4(1H)-quinolones and the corresponding 4(1H)-quinolones via low-temperature fries rearrangement of N-arylazetidin-2-ones.Aust J Chem,2011,64:454-470.
13 Niu XM,Qiu MH,Li ZR,et al.Two novel 3,4-seco-trinorlanostane triterpenoids isolated from Ganoderma fornicatum.Tetrahedr Lett,2004,45:2989-2993.
14 Sark T,Hofmann T.Structures,sensory activity,and dose/response functions of 2,5-diketopiperazines in roasted cocoa nibs(Theobroma cacao).J Agric Food Chem,2005,53:7222-7231.

