MRS在星形细胞肿瘤术后放疗中的价值:Cho/Cr的变化及意义
于同刚 吴丽琼 戴嘉中 潘 力 盛晓芳 汪 洋施惠东 曹文静 钱慧君 姚旭峰
近年来,随着MRI技术的进步,MRS得到了广泛应用和发展。由于MRS可以无创性的检测肿瘤组织的代谢及生化变化,并具有较高的敏感性,因此是研究脑组织代谢较为理想到方法。目前人们已将其应用于脑肿瘤的放射治疗中,但是主要集中在放射性脑坏死及其与肿瘤复发的鉴别方面[1-3],但是对于急性期、早期迟发反应期MRS上Cho/Cr代谢物改变的研究较少。本课题通过研究星形细胞肿瘤术后、分次放疗后急性期及早期迟发反应期MRS上Cho/Cr代谢物改变随剂量、时间的变化趋势,以评价MRS上Cho/Cr改变在星形细胞肿瘤放疗随访中的价值。
方 法
1. 临床资料
本研究共18例,男11例,女7例,年龄9~67岁(平均46±14岁)。放疗前2~8周均行外科手术治疗,其中胶质母细胞瘤(WHO4级)7例,间变性星形细胞瘤(WHO 3级)4例,弥漫性星形细胞瘤(WHO2 级)6例,毛细胞型星形细胞瘤(WHO1级)1例。所有患者术前均未行放疗、化疗及免疫治疗。
2. 常规MRI及MRS检查
采用GE signa VH/i 3.0T MRI扫描仪,单通道头颅正交线圈进行常规MRI和MRS检查。在放疗前12~36h内进行基线MRI和MRS检查,然后在放疗至总剂量的60%时及放疗结束后1月行MRS来研究分次放疗对脑组织的影响。
所有的常规MRI及MRS检查均采用相同的成像参数。MRS检查采用点分辨波谱(PRESS)序列,TR/TE=1000ms/144ms,FOV 240mm,体素厚度(voxel thickness)10mm,NEX 1,频率编码为18,相位编码为18;在横断面T2WI或FLAIR上确定MRS的感兴趣区(region of interest,ROI),并尽量使ROI在3个平面上均避开皮下脂肪、颅骨和其他对波谱有影响的区域。MRS预扫描时的匀强、发射/接受增益调节、水抑制均由自动预扫描程序完成,使得半高全宽(FWHM)和水抑制均达到规定要求:FWHM控制在13Hz内,水抑制效果要求大于96%。
3. MRS原始数据的处理
波谱扫描完毕后将所获得的原始数据传入工作站,采用设备自带的商业软件GE Functool 2.6.4b软件包进行后处理。在波谱后处理时,体素位置选择在≥60Gy区和<40Gy区进行测量,体素大小为562mm3(7.5mm×7.5mm×10mm)。≥60Gy区一般选择在术后瘤床边缘的高剂量区,并且在平扫T2WI上呈高信号、增强后有强化或无强化(取决于病灶术前的强化方式、手术是否为全切及距离术后的时间)的区域。同时,应测量其实性部分,尽量避开出血、坏死或囊变区。而<40Gy区一般选择在与原发肿瘤相对应的对侧低剂量区域,并且在常规MRI检查中未见明显异常信号的区域。波谱后处理时,由软件自动完成基线校正、信号平均,并计算Cho/Cr的比值。
4. 放射治疗
放射治疗采用6MV直线加速器。先行常规分割放射治疗,采用水平两野对穿照射,每天2Gy/次 ,5次/周,共20次。常规分割放射治疗结束后,采用Peacock系统进行调强适形放射治疗(intensity modulation radiation therapy,IMRT)。IMRT治疗剂量为每天2~2.5Gy/次,8~12次。靶区总处方剂量为60~68Gy。
5. 统计分析
采用SPSS 11.0软件包,不同代谢物相对定量值采用均数±标准差表示。采用配对t检验检查放疗组不同时间点MRS上Cho/Cr的差别。
结 果
星形细胞肿瘤≥60Gy及<40Gy区放疗前后系列MRS上Cho/Cr的变化见表1。从表中可以看出,≥60Gy区的Cho/Cr在治疗前已经明显升高,但在放疗至60%总剂量时已经开始降低,并且呈进行性降低(从治疗前的2.521降到治疗后1个月的1.810)。而<40Gy区则先轻度升高,随后降至原来的水平,总体变化不太明显。
将各病例放疗前及放疗至60%总剂量时的Cho/Cr值进行配对t检验,结果显示,对于≥60Gy区,两个时间点的Cho/Cr变化有统计学差别(t=2.355,P=0.032);而<40Gy区,两个时间点的Cho/NAA变化有显著统计学差别(t=-2.149,P=0.007)(图1,2)。
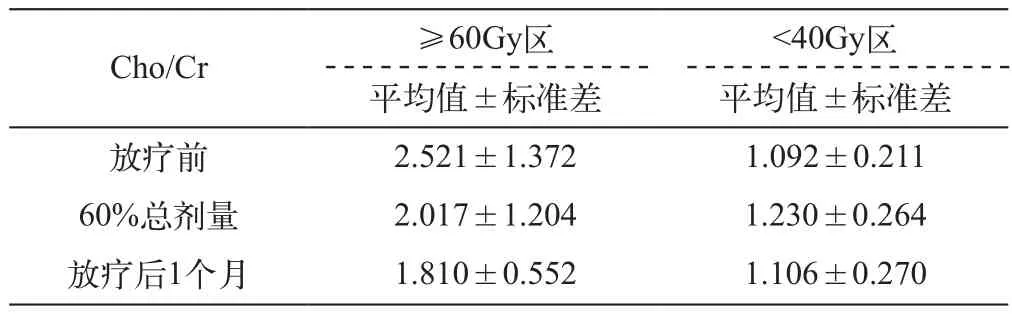
表1 星形细胞肿瘤不同区域放疗前后Cho/Cr值
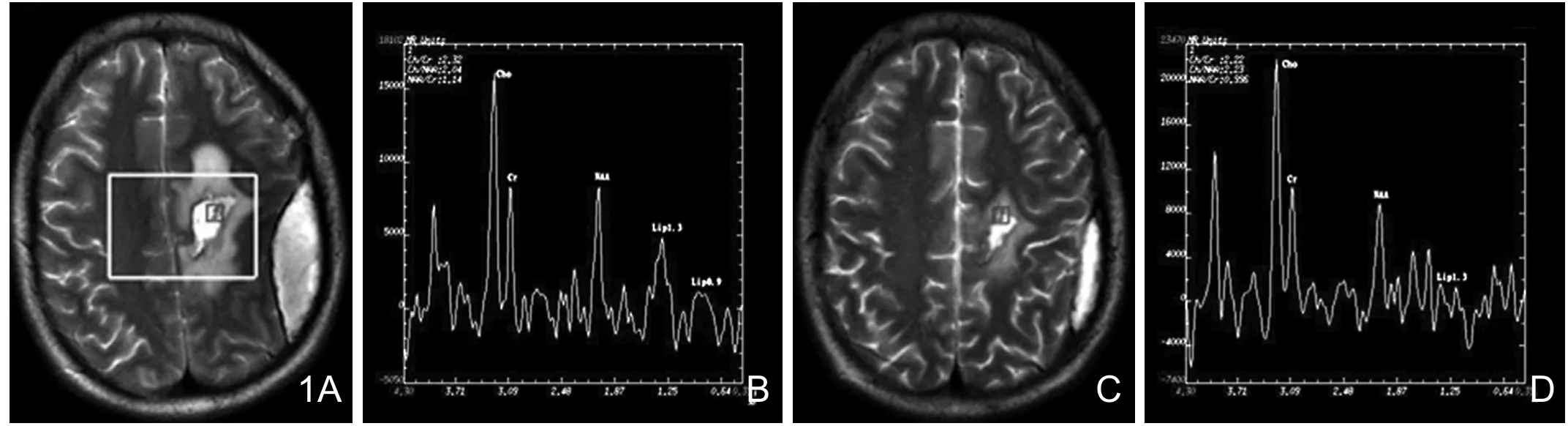
图1 左额胶质母细胞瘤术后,瘤床区(≥60Gy区)的波谱。A、B为术后放疗前肿瘤床区的波谱;C、D为同一区域放疗至60%总剂量时的波谱改变;可见放疗至60%总剂量时,瘤床区的水肿明显减轻,Cho/Cr在治疗前为2.32,放疗至60%总剂量时降至2.22。
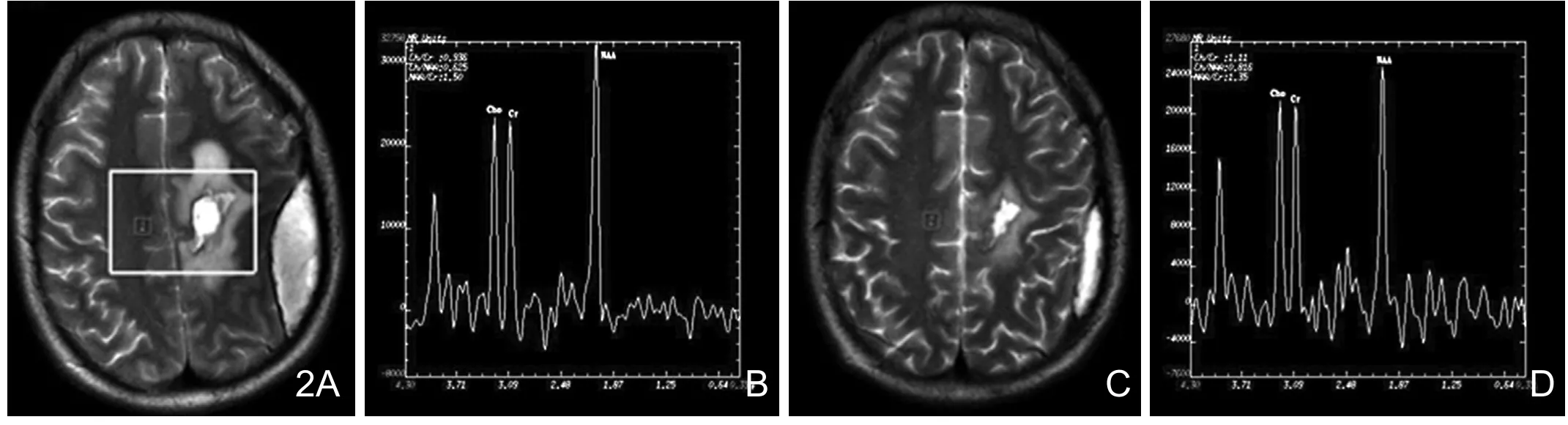
图2 左额胶质母细胞瘤术后,对侧正常区(<40Gy区)的波谱。A、B为术后放疗前的波谱;C、D为同一区域放疗至60%总剂量时的波谱;可见放疗至60%总剂量时对侧正常区的Cho/Cr有所升高(从0.936升至1.11)。
讨 论
放射治疗作为星形细胞肿瘤术后的辅助治疗手段,有时会引起放射性脑损伤。放射性脑损伤分为三期:急性期、早期迟发反应期和晚期迟发反应期。放射性脑损伤的发生率由总照射剂量、照射方式和总治疗时间决定。尽管采用全脑对穿照射,也不足以避免放射性脑损伤的发生。在放射性脑损伤中,放射性坏死发生在晚期迟发反应期,也是最严重的、有时会致死的并发症。由于MRS可以无创性的检测肿瘤组织的代谢及生化变化,并具有较高的敏感性,多数学者针对该期的MRS改变进行了研究[3-4]。但是,对于急性期、早期迟发反应期MRS上Cho的改变的研究较少。
本研究发现,在放疗后早期,部分患者可见水肿加重。这主要是由于放疗对脑组织的作用在早期主要作用于血管(发生在治疗后数小时和数天内),包括毛细血管和小血管内皮细胞的损害、循环系统受损、血管通透性增加以及BBB的破坏所致。
在放疗后1个月左右,Cho/Cr即可出现改变,而此时常规MRI上一般无改变或仅有轻度水肿。部分患者在放疗后早期可见水肿加重。在≥60Gy的高剂量区,Cho/Cr在放疗至60%总剂量时已经开始降低,并且呈进行性降低(从治疗前的2.521降到治疗后1个月的1.810),但由于Cho/Cr在放疗前已经明显升高,因此其值仍高于正常值。在高剂量区出现Cho/Cr的进行性降低,被认为是放疗后肿瘤细胞进行性坏死的标志,说明肿瘤细胞对放疗有反应并诱导细胞数量降低。而<40Gy区的Cho/Cr总体变化不太明显,先是轻度升高,随后降至放疗前的水平。Kaminaga等[5]认为,Cho升高是由于髓鞘、细胞膜崩解或更新加快所致。这是由于髓鞘和细胞膜中含有丰富的磷脂,而Cho浓度随着磷脂生成和降解的变化而变化。Belka等[6]认为放射性脑损伤是由少支胶质细胞的破坏引起髓鞘崩解所致。脱髓鞘是放疗后脑组织早期迟发反应期的特征性改变。由放疗引起的细胞膜和髓鞘崩解会使水溶性磷酸胆碱增加,导致早期迟发反应期Cho的升高。
通过本研究可以看出,Cho/Cr在分次放疗后早期即出现改变,而且有一定的特点,并与晚期迟发反应期(如放射性坏死)明显不同,因此可以采用MRS来检测放疗后早期的代谢改变,解释放疗后发生的放射生物学变化。
[1] Elias AE, Carlos RC, Smith EA, et al. MR spectroscopy using normalized and non-normalized metabolite ratios for differentiating recurrent brain tumor from radiation injury. Acad Radiol, 2011, 18:1101-1108.
[2] Isobe T, Akutsu H, Yamamoto T, et al. Usefulness of quantitative H-MR spectroscopy for the differentiation between radiation necrosis and recurrence of anaplastic oligodendroglioma. No Shinkei Geka, 2011, 39: 485-490.
[3] Huang J, Wang AM, Shetty A, et al. Differentiation between intraaxial metastatic tumor progression and radiation injury following fractionated radiation therapy or stereotactic radiosurgery using MR spectroscopy, perfusion MR imaging or volume progression modeling. Magn Reson Imaging, 2011, 29: 993-1001.
[4] 张 鑫, 张 冰, 闫 婧, 等. 3.0T磁共振氢质子波谱对脑胶质瘤放射性
损伤与复发鉴别诊断分析. 实用放射学杂志, 2012, 28: 1852-1856.
[5] Kaminaga T, Shirai K. Radiation-induced brain metabolic changes in the acute and early delayed phase detected with quantitative proton magnetic resonance spectroscopy. J Comput Assist Tomogr,2005, 29: 293-297.
[6] Belka C,Budach W, Kortmann RD, et al. Radiation induced CNS toxicity-molecular and cellular mechanisms. Br J Cancer, 2001, 85:1233-1239.

