一种新型抗菌活性物质的初步研究
易凌霄,陈智勇,董 伟
(1.湖南农业大学国际学院,湖南 长沙410128;2.湖南农业大学生物科学技术学院,湖南 长沙410128;3.湖南农业大学动物医学院,湖南 长沙410128)
一种新型抗菌活性物质的初步研究
易凌霄1,陈智勇2,董 伟3
(1.湖南农业大学国际学院,湖南 长沙410128;2.湖南农业大学生物科学技术学院,湖南 长沙410128;3.湖南农业大学动物医学院,湖南 长沙410128)
应用高速离心和高效液相色谱法分离纯化技术,从大肠杆菌细胞裂解液中获得了一种新型的天然抗菌活性物质。体外抑菌试验结果显示:该活性物质对金色葡萄球菌、大肠杆菌、巴氏杆菌、链球菌、青枯病菌的最小抑菌浓度(MI C) 分别为2.5μg/m l、5μg/m l、0.625μg/m l、0.625μg/ml、1.25μg/ml,最低杀菌浓度(M B C)分别为5μg/ml、5μg/ml、1.25μg/ml、2.5μg/ml、2.5μg/ml;化学法和质谱法进行成分鉴定的结果证明该抗菌活性物质为生物碱;对模式植物拟南芥的安全性评价结果显示该抗菌活性物质对植物的生长发育无抑制作用和不良影响。上述实验结果表明:该抗菌活性物质是一种广谱、高效、安全的新型抗菌天然产物,具有可替代抗生素类药物的开发利用前景。
抗菌活性物质;生物碱;大肠杆菌;青枯病;拟南芥
细菌病害是农业生产的主要灾害之一,常给动物养殖和植物栽培带来极大的损失。目前生产上对细菌性病害的防治主要依靠抗生素类药物。由于抗生素类药物的大量长期使用,导致了耐药性细菌甚至超级细菌的出现,给动植物细菌病的防治带来了严重挑战[1]。因此,开发新的抗菌药物,突破抗生素耐药性难题,已成为当前世界关注的焦点和研究的热点。
从动植物和微生物中提取天然抗菌活性物质是寻找新型抗菌药物的重要途径,因为天然抗菌活性物质具有高效、低毒、无污染和来源广等特点,可有效抑制细菌生长,同时也不会对环境造成污染,或导致产生抗药性,而且生产方便、研发周期短[2]。近年来,已有不少学者从多种生物体内分离提取到了天然的抗菌活性物质[3-8],但还未见从大肠杆菌中分离提取天然抗菌活性物质的研究报道。大肠杆菌是常用的实验细菌,来源广泛,易于培养,而且遗传背景清楚,如能从大肠杆菌细胞中分离提取到天然的抗菌活性物质,将有重要的理论研究意义。
另外,在已有的关于天然抗菌活性物质的报道中,还没有涉及到对植物青枯病菌防治的研究。实际上,在作物栽培生产中,青枯病的危害是相当严重的,由Ralstonia solanacearum(Sm ith)Yabuuchi引起的植物细菌性青枯病在热带和亚热带地区普遍发生,是世界上危害最大、分布最广、造成损失最严重的植物土传病害之一,而目前对青枯病的防治方法仍然主要是使用抗生素[9-12]。因此,研发出抗植物青枯病的天然的抗菌活性物质,在农业生产上有着极为重要的应用价值。
试验选择大肠杆菌为天然抗菌活性物质的供体材料,用碱裂解法裂解大肠杆菌细胞,通过高速离心和高效液相色谱分离纯化细胞内容物,进行体外抑菌试验,筛选抗菌天然活性物质,并用化学法和质谱法对其成分进行鉴定,对抗菌活性物质进行安全性评价,旨在获得一种在农业生产上有应用价值,特别是对植物青枯病有良好防治效果的新型天然抗菌活性物质,以替代目前仍在大量使用的抗生素类药物。
1 材料与方法
1.1 实验材料
1.1.1 菌种 大肠杆菌 (E.coli)C44103;链 球菌(streptococcus)O1026;巴氏杆菌(pasteurellamultocid) C44-1;金葡菌(staphylococcus aureus)C26112,购自中国兽药监察所,并由实验室保存。青枯病菌种由王国梁教授惠赠。
1.1.2 培养基与试剂 LB培养基、1/2MS培养基、NA培养基、溶液Ⅰ、溶液Ⅱ、乙腈、浓硫酸、茚三酮、碘-碘化钾、苦味酸、磷钼酸试剂﹑硅钨酸试剂、碘化汞钾试剂、碳酸钠、乙醚、硝酸银的氨溶液、苏丹Ⅳ溶液。配置以上培养基和溶液的试剂均为国产分析纯,以上培养基和溶液均由实验室配置并保存。Wst-1染液(冷冻避光保存)。
1.1.3 植物种子 模式植物拟南芥野生型种子由夏石头教授惠赠。
1.2 实验方法
1.2.1 抗菌活性物质的分离与筛选 (1)大肠杆菌的培养:在无菌操作台上取大肠杆菌实验菌株单菌落接种至LB液体培养基中,置37℃恒温培养箱中震动培养24 h。(2)大肠杆菌细胞裂解:参考江欢欢的方法[13]进行,并作一定调整。(3)大肠杆菌细胞裂解物的分级离心:取大肠杆菌细胞裂解液,用1000 r/m in、2000 r/m in、3 000 r/m in、4 000 r/m in、4 000 r/m in、5 000 r/m in、6 000 r/m in、7 000 r/m in、8 000 r/m in、9 000 r/m in、10 000 r/m in的10个梯度,分别离心15m in,同时分别收集各离心梯度的沉淀。(4)抗菌活性成分的筛选:采用MTT方法测定各级离心沉淀的抗菌活性。将各级离心沉淀分别置于50℃下烘干,将大肠杆菌标准菌株培养后进行活菌计数,并稀释至106个/m L;取96孔细胞培养板,每孔加入100μL的稀释菌液,在加了菌液的孔中再分别加入 15μL各级沉淀水溶液(1mg/m L),各样品做3个平行孔;放入37℃恒温培养箱中培养1 d后取出细胞培养板,在每孔中加入10 μLWst染液,后再放入培养箱中培养1 h;在酶标仪490 nm下检测OD值,并计算3个平行孔的平均OD值,OD值低的孔中细菌生长受到抑制,由此筛选出有抗菌活性的沉淀。(5)高效液相分离:色谱柱为unitary C18,5 um,4.6mm×250mm;流动相为乙腈;洗脱梯度为0~12m in、乙腈10%~95%;12~26m in、95%乙腈;26~30m in、乙腈95%~100%。
进样量为30μL;流速为1m L/m in;检测波长为254 nm。每2m in接一管液体,共接15管,每管2m L,依此反复9次。
1.2.2 抗菌活性物质的成分鉴定 按下列方法鉴定和鉴别。
(1)糖类鉴别采用Molish试验,参考李孝栋和贾林的方法[14-15]。
(2)蛋白质鉴定采用茚三酮试验,参考许文彦等的方法[16]。
(3)酮、醛的鉴别,参考了赵莲的方法[17]。
(4)脂类的鉴定,参考了王秀丽等的方法[18]。
(5)生物碱类成分的鉴别:①取上备酸水浸液四份(每份1m L左右即可),分别滴加碘-碘化钾﹑苦味酸试剂﹑磷钼酸试剂﹑硅钨酸试剂。若四者均有或大多有沉淀反应,表明该样品可能含有生物碱,再进行下项试验。②取上备其余酸水浸液,加Na2CO3溶液呈碱性,置分液漏斗中,加入乙醚约10m L振摇,静置后分出醚层,再用乙醚3m L,如前萃取,合并醚液。将乙醚液置分液漏斗中,加酸水液10m L振摇,静置分层,分出酸水液,再以酸水液5m L如前提取,合并酸水液,如此酸提液4份,分别作以下沉淀反应:a.碘化汞钾试剂(Mayer试剂):酸水提液滴加碘化汞钾试剂,产生白色沉淀。b.硅钨酸试剂:酸水提取液滴加硅钨酸试剂产生淡黄色或灰白色沉淀。此酸水提液与以上3种试剂产生沉淀反应,即本样品含有生物碱。
(6)能谱检测:用高效液相分离前的粗提大肠杆菌抗菌活性物质进行能谱分析。
(7)质谱检测:用高效液相分离后的大肠杆菌抗菌活性物质进行质谱分析。
1.2.3 抗菌活性物质体外抗菌活性检测 (1)抗菌活性物质最低抑菌浓度(M IC)的测定:分别取病原菌大肠杆菌、巴氏杆菌、金色葡萄球菌、链球菌及菌青枯病菌单菌落进行液体培养,并将细菌培养液稀释至106个/m l浓度。然后生理盐水制成依此稀释10倍的1~10号管混合液;从各管中分别取稀释的菌液0.1m L均匀涂布在固体培养基上,恒温培养24 h后,对菌落进行计数。取5支灭菌试管,分别加入1m L液体培养基,然后移取1m L经MTT筛选出的具有抗菌活性的组分液体(20μg/m L)加入1号试管,混匀,从1号试管中移取1m L液体至2号管中,混匀,依次稀释到5号管,从5号管中取出1m L液体弃去。并分别于1,2,3,4号管中加入100μL的菌液(106个/m l浓度)。另取一试管,加入1m L LB液体培养基,100μL菌液作为对照。将稀释好的溶液置于35℃的恒温培养箱中培养24 h,观察各试管的细菌生长数量,确定最低抑菌浓度。(2)最低杀菌浓度(MBC)的测定:取上述药物最低抑菌浓度以上未见细菌生长的各孔培养物,分别吸取100μL,移种至不含药的平皿琼脂培养基上,轻轻推开药液,置37℃培养过夜,观察有无菌生长,计数少于5个菌落者即为该药的最低杀菌浓度。
1.2.4 抗菌活性物质对拟南芥组织培养的影响 在无菌操作台上将灭菌后的拟南芥野生型种子接入1/2 MS培养基中,25℃光照培养4周后成苗。配置1/2 MS培养基,设置三组,A组为空白对照,B组加入低浓度2%的抗菌活性物质,C组加入高浓度5%的抗菌活性物质,每组设置8个重复。将健壮的拟南芥植株接入上述3组培养基,观察其生长情况。
2 结果与分析
2.1 抗菌活性物质的离心分离与MTT检测结果
大肠杆菌碱裂解液分别经10个不同梯度的离心后,得到10种不同分子量的沉淀物,将这些不同组分的沉淀物分别用MTT法进行抗菌活性测定,结果显示:在6 000 r/m in梯度离心下所得沉淀物无抗菌活性,在7 000 r/m in梯度离心下所得沉淀物,其检测孔中的细菌浓度低,透光性好,490 nm下的OD值最低,说明该组分的物质能显著抑制实验细菌的生长,是一种抗菌活性物质。检测结果见图1。
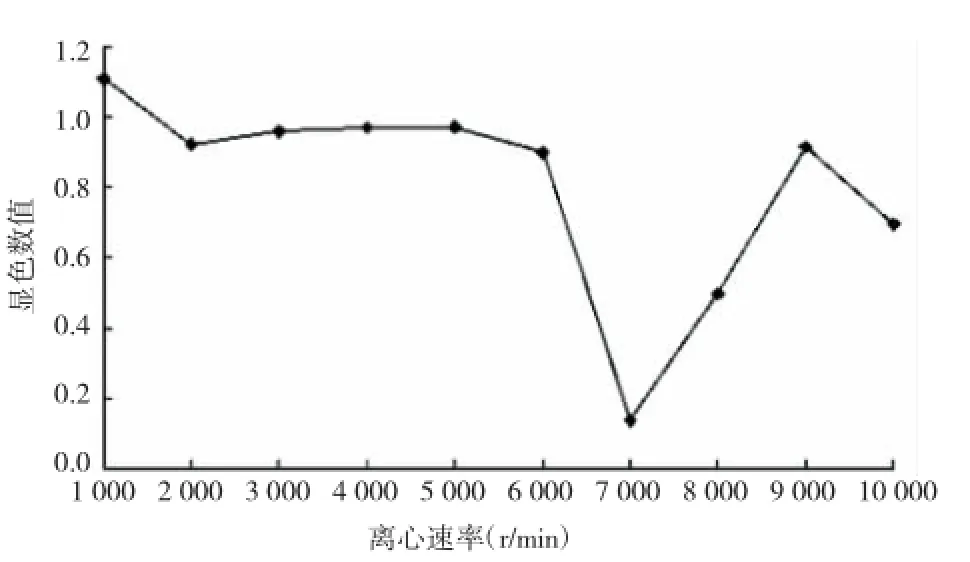
图1 碱裂解法不同离心力粗提物MTT结果
大肠杆菌碱裂解液经7 000 r/m in离心所获得得沉淀物(粗提取物)于50℃下烘干后,得到棕黄色的粉末颗粒物(见图2)。

图2 大肠杆菌抗菌活性物质粗品
2.2 抗菌活性物质高效液相分离与MTT检测结果
对在7 000 r/m in梯度离心下所得沉淀的水溶液,进行高效液相分离,并对不同洗脱时段的洗脱液进行MTT抗菌活性检测。结果显示:在高效液相色谱分离出的洗脱液中,第15~16m in的吸光度平均值最小,活细菌数量最少,说明其抗菌活性最强(见图3)。
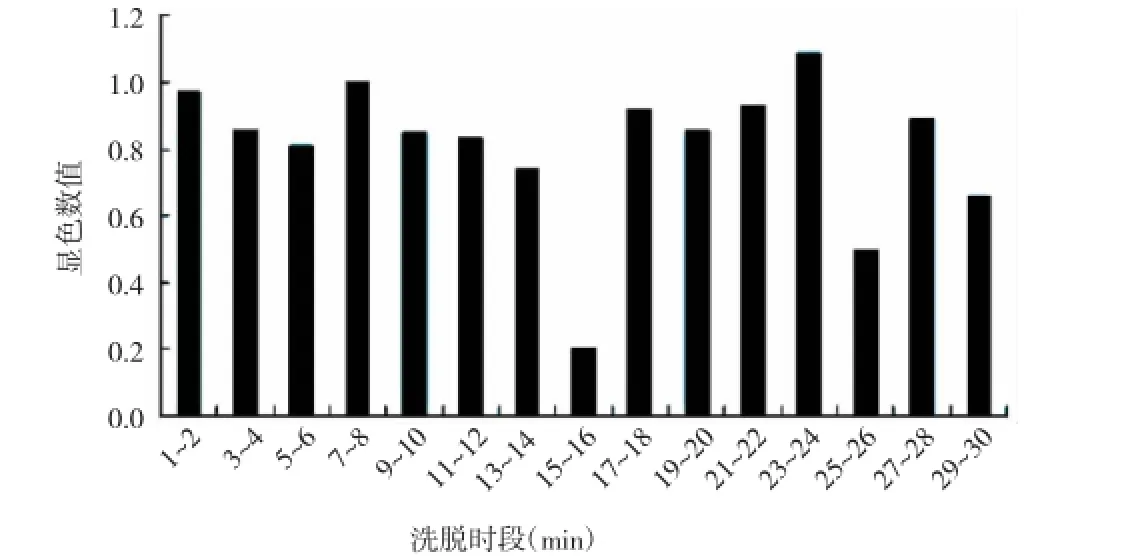
图3 高效液相分离的MTT的活性检测结果
2.3 抗菌活性物质成分鉴定结果
将在7 000 r/m in梯度离心下所得的抗菌活性沉淀物分别进行糖类、蛋白质、酮类、脂类和生物碱鉴定。Molish实验显示没有紫红色环出现,证明该抗菌活性物质不含糖类成分;茚三酮显色反应结果未呈现出蓝紫色,说明该抗菌活性物质中不含有蛋白质成分;银镜实验证明该抗菌活性物质中不含有酮、醛类成分;生物碱鉴定结果显示,在鉴别1的四种生物碱鉴定试剂反应中,有3种反应出现了沉淀物,在鉴别2的4种生物碱鉴定试剂反应中,有两种反应出现了沉淀物,结果表明该抗菌活性物质中含生物碱(图4)。

图4 抗菌活性物质鉴定结果注:左起一管是糖类鉴定结果,二管是蛋白质鉴定结果,三至六是生物碱鉴定结果,七是酮类鉴定结果。
2.4 抗菌活性物质抑菌实验结果
对在高效液相色谱第15~16m in洗脱分离出的抗性活性物质进行一系列抑菌实验,与对照相比较,发现其对大肠杆菌、链球菌、巴氏杆菌、青枯病菌均有明显的抑制作用。该抗菌活性物质对金色葡萄球菌、大肠杆菌、巴氏杆菌、链球菌、青枯病菌的最小抑菌浓度(M IC)分别为2.5μg/m L、5μg/m L、0.625μg/m L、0.625μg/m L、1.25μg/m L,最低杀菌浓度(MBC)分别为5μg/m L、5μg/m L、1.25μg/m L、2.5μg/m L、2.5μg/m L (图5-图8)。
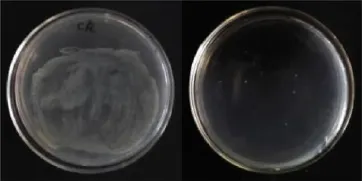
图5 大肠杆菌在未加抗性物质(左)和加抗性物质(右)培育基中的生长状况
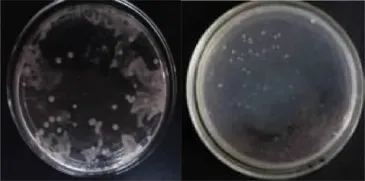
图6 巴氏杆菌在未加抗性物质(左)和加抗性物质(右)培育基中的生长状况
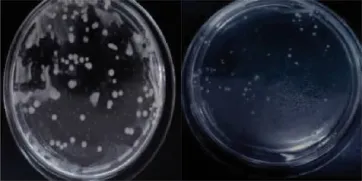
图7 链球菌在未加抗性物质(左)和加抗性物质(右)培育基中的生长状况
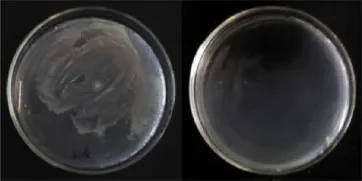
图8 青枯病菌在未加抗性物质(左)和加抗性物质(右)培育基中的生长状况
2.5 抗菌活性物质对植物生长的影响
在拟南芥的培养基中加入不同浓度的该抗菌活性物质并设计空白对照,在接种后的一周和两周后分别观察拟南芥的生长情况,可以看出该抗菌活性物质对拟南芥对的生长没有影响,见图9。

图9 抗菌活性物质对植物生长的影响A图:左CK,中添加2%抗性物质,右添加5%抗性物质(接种7 d);B图:左CK,中添加2%抗性物质,右添加5%抗性物质(接种14 d)
3 讨论
提取天然的抗菌活性物质来防治细菌病已经成为动植物抗菌制剂开发的新趋势。从大肠杆菌中提取出抗菌活性物质是找寻抗菌药物的一种新思路。试验用MTT法分别检测了大肠杆菌的培养液、全菌、大肠杆菌超声波裂解物和大肠杆菌盐裂解物,均未检测到抗菌活性,证明只能通过碱裂解才能释放出具有抗菌活性的大肠杆菌的结构成分,该成分应该是大肠杆菌中共有的结构成分,因试验从标准菌株和分离菌株中均提取到该成分,活性并无差异。该活性物质的抗菌活性高,达到常规抗生素的抑杀菌效度。抗菌谱广,对动物源性多种革兰氏阴性菌和阳性菌具有显著抗菌效果,尤其对猪源巴氏杆菌抑菌效果更高。对植物源病原菌青枯病菌的抑菌效果也较高。并且该物质耐高温,结构稳定,对动植物毒副作用小,因此具有作为一种新抗菌药物的开发应用的潜质。
该抗菌活性物质经初步鉴定为一种生物碱,这也与只能经碱裂解法提取该活性物质的结果相吻合。但到底是何种物质,本研究通过能谱检测结果显示,该活性物质中含量高的元素依次为C、O、Na和N,质谱鉴定仍为小分子混合物。目前,笔者正在做进一步分离纯化和结构分析。另外,其抑菌的作用机制还有待进一步研究。
[1]马苏,高艳美.动物源细菌耐药性对动物细菌传染性疾病防治的影响[J].中国兽药杂志,2012,(2):50-52.
[2]操庆国,郭钦,黄敏,等.天然抗菌物质研究进展[J].保鲜与加工,2006,(3):10-12.
[3]Yioshiaka Miyake,Masanori Hiramitsu. Isolation and extraction of antimicrobial substances against oral bacteria from lemon peel [J].Journal of food science technology,2011,48(05):635-639.
[4]Takayuki Nara, Tadashi Yasui,Osamu Fujimori, Wilfried Meyer,Azuma Tsukise . Sialic acids and antimicrobial substances in the apocrine glands of porcine perianal skin [J]. Arch Dermatol Res,2012,(304):609-617.
[5]Anirban Jana,Suparna Mandal Biswas,Lactam nonanic acid,a new substance from Cleome viscosa with allelopathic and antimicrobialproperties[J]. Biosci.,2011,36(1):27-35.
[6]Santi M Mandal,Shalley Sharma,Anil Kumar Pinnaka,et al. Isolation and characterization of diverse antimicrobial lipopeptides produced by Citrobacter and Enterobacter[J]. BMC Microbiology,2013,(13):152.
[7]Natalia Damiani,Natalia J. Fernández,Martín P. Porrini,et al.Laurel leaf extracts for honeybee pest and disease management:antimicrobial, microsporicidal, and acaricidal activity [J]. Parasitol Res,2013,(11):213-219.
[8]Masroor Qadri,Roopali Rajput,Malik Z. Abdin,et al. Diversity,Molecular Phylogeny,and Bioactive Potential of Fungal Endophytes Associated with the Himalayan Blue Pine Microbial Ecology,2014,(02):677- 887.
[9]王小佳.蔬菜育种学 (各论)[M].北京:中国农业出版社,2000:121-123.
[10]番华彩,唐嘉义,秦小萍.烟草青枯病防治对策.云南大学学报[J]. 2008,30(3):31-35.
[11]丁传雨,乔焕英,沈其荣,等.生物有机肥对茄子青枯病的防治及其机理探讨[J].中国农业科学,2012,45(2):239-245.
[12]曹明慧,冉炜,杨兴明,等.烟草黑胫病拮抗菌的筛选及其生物效应[J].土壤学报,2011,48(1):151-159.
[13]江欢欢,程凯,杨兴明,等.辣椒青枯病拮抗菌的筛选及其生物防治效应[J].土壤学报,2010,47(6):1225-1231.
[14]李孝栋,陈景山,陈峰.黄茂多糖含量侧定的方法学研究[J].世界科学技术一中医药现代化,2006,2(8):35-38.
[15]贾林,沃兴德,陆金健.桔梗多糖的提取与纯化[J].生物学杂志,2011,(4):21-23.
[16]许文彦,唐军,嵇长久.植物环蛋白的薄层层析显色反应[J].科学通报,2008,(5):533-536.
[17]赵莲,汪志勇.甲酸银镜反应条件试验[J].贵阳医学院学报,2005,6(30):285-286.
[18]王秀丽,姜鹏,董春光.生物组织中脂肪鉴定方法的探索与比较[J].生物学通报,2012,11(47):48-50.
(责任编辑:吴 婷)
Prelim inary Test on a New Type of Antibacterial Substance
YILing-xiao1,CHEN Zhi-yong2,DONGWei3
(1.International College,Hunan Agricultural University,Changsha 410128,PRC;2.Biological Science and Technology College,Hunan Agricultural University,Changsha 410128,PRC;3.Veterinary Medicine College,Hunan Agricultural University,Changsha 410128,PRC)
Application of high-speed centrifugation and high-performance liquid chromatography to separation and purification obtained a new type of natural antibacterial substance from Escherichia coli cell.Against Staphylococcus aureus,Escherichia coli,Pasteurella multocida,Streptococcus,Pseudomonas,solanacearum them inimal inhibitory concentration(MIC)was2.5μg/m l,5μg/m l,0.625μg/m l, 0.625 g/m l and 1.25 g/m l,theminimum bactericidal concentration(MBC)was 5 g/m l,5 g/m l,1.25 g/m l,2.5 g/m l,2.5 g/m l,respectively composition identification of chemicalmethod andmassspectrometry shows that the antibacterialactive substance alkaloids;and the safety evaluation on themodelplantArabidopsisshows that theantibacterialactive substance had no inhibitory and adverse effects on the grow th and developmentof plants.The experimental results show that the antibacterialactive substance is a broad-spectrum,high efficiency,safe antibacterialnaturalproduct,with theprospectof developmentand utilization ofalternativeantibiotics.
antibacterial substance; alkaloid; Escherichia coli; blight;Arabidopsis thaliana
S182
A
1006-060X(2015)01-0099-05
10.16498/j.cnki.hnnykx.2015.01.032
2015-01-16
广东省科技厅资助项目(2012B020401012)
易凌霄(1994-),男,湖南长沙市人,在读本科,主要学科专业为生物科学。
董 伟

