节杆菌与施氏假单胞菌对甲基对硫磷的共降解研究
史延华,任 磊,贾 阳,闫艳春
(中国农业科学院研究生院,北京100081)
节杆菌与施氏假单胞菌对甲基对硫磷的共降解研究
史延华,任 磊,贾 阳,闫艳春
(中国农业科学院研究生院,北京100081)
为实现对有机磷农药甲基对硫磷的彻底降解,研究利用有机磷农药降解菌施氏假单胞菌Y C-Y H1与对硝基苯酚降解菌C N2对甲基对硫磷进行共降解试验,同时克隆了参与降解过程的相关基因,并对2株菌株在对甲基对硫磷污染土壤的原位修复中的效果进行研究。结果表明,与Y C-Y H1单独降解相比,Y C-Y H1和C N2共降解在处理前32 h无较大差异;但之后,甲基对硫磷和对硝基苯酚的降解速度明显加快,处理48 h后甲基对硫磷即被完全降解,比单独用Y C-H1降解时提前了16 h,处理64 h时对硝基苯酚就被完全降解。而土壤修复的研究结果表明,菌株Y C-Y H1与C N2能够高效降解甲基对硫磷,72 h对土壤中100Mg/k g甲基对硫磷的降解率接近100%,尤以未灭菌土壤中降解效果更好。
甲基对硫磷;对硝基苯酚;施氏假单胞菌;节杆菌;共降解
生物降解作为消除环境有机污染物的方式之一,被认为是重要的环境物质平衡策略。由于农药在农业生产及日常生活中的重要作用,其使用频率和使用量越来越大[1],随之引起的食品安全和环境污染等问题也越来越受人们关注。大部分农药是可以降解的,且已有较多相关的研究报道,但仍然有许多盲点值得关注[2]:(1)农药在低浓度下较难被降解,如浓度达到毫克级以下时,不论生物降解还是理化降解成效都不显著;(2)农药的生物降解在极端条件下较难起作用,例如地下水、湖泊深层淤泥和海水等环境;(3)农药转化的代谢中间产物也具有相当的毒副作用,应予以关注。例如,3,5,6-三氯-2吡啶酚作为毒死蜱的主要降解产物,虽然毒性相对于毒死蜱大大降低,但由于其半衰期较长,且具有较强的抑菌活性以及潜在的致癌风险,对生态环境及人体健康的威胁不容忽视[3]。
甲基对硫磷是一种高效、高毒的有机磷杀虫剂,被广泛应用于农业生产中。但其残留期长,具有较高神经毒性[4-6]。因此,甲基对硫磷的生物降解一直是人们研究的热点。目前,已证实可降解甲基对硫磷的菌株分别属于芽孢杆菌属、假单胞菌属、节杆菌属、克雷伯氏菌、木霉属等[7-10]。
有研究表明,微生物的水解酶通常作用于甲基对硫磷的P-O酯键,将甲基对硫磷水解为二甲基硫代硫酸酯和对硝基苯酚。虽然对硝基苯酚的毒性与甲基对硫磷相比下降了几十倍[11],但是其半衰期仍然较长,且具有良好的水溶性,故对硝基苯酚能够长时间残存于环境中,并可随地表水迁移至地下水系统,给生态环境和人体健康带来较大威胁[12]。因此,研究对硝基苯酚的生物降解途径对彻底解决甲基对硫磷的污染问题有重要意义。
研究以有机磷农药降解菌施氏假单胞菌YCYH1和对硝基苯酚降解菌节杆菌CN2为材料,通过基因克隆初步探讨2株降解菌对甲基对硫磷的降解途径,并通过土壤降解试验研究这2株菌株对污染环境原位修复的应用潜能,以期为生物修复甲基对硫磷污染土壤提供理论依据与技术参考。
1 材料与方法
1.1 菌株与培养基
1.1.1 供试菌株 供试菌株为施氏假单胞菌YC-YH1(Pseudomonas stutzeri)和节杆菌属细菌CN2(Arthrobacter sp.),由中国农业科学院研究生院生物学教研室提供;它们的16S rRNA基因序列均已递交GenBank,登录号分别为KJ786450和EU266494。
1.1.2 供试药品 研究所用甲基对硫磷(纯度97.2%)与对硝基苯酚(纯度99.1%)均为分析纯级(国药集团)。其中,甲基对硫磷用无水乙醇溶解配制成浓度为2×104mg/L的母液;对硝基苯酚用纯水配制成浓度为2×104mg/L的母液;备用。高效液相色谱使用的乙腈和甲醇均为色谱纯级(美国Fisher公司)。
1.1.3 培养基 普通培养基(LB):胰蛋白胨10 g,酵母粉5 g,NaCl10 g,去离子水1 L,pH值7.2±0.2。无机盐离子培养基(MSM):NH4NO31.0 g,NaCl 0.5 g,(NH4)2SO40.5g,KH2PO40.5 g,K2HPO41.5 g,去离子水1 L,pH值7.2±0.2。上述培养基中加入1.5%的琼脂粉即得到对应的固体培养基,所有培养基均在121℃灭菌30Min备用。
1.1.4 供试土壤与主要试验仪器 供试土壤为中国农业科学院西门花园内土壤,无有机磷农药使用记录。高效液相色谱仪为安捷伦1 200(Agilent,USA),色谱柱为Zorbax Eclipse PlusC18(4.6mm×150mm× 5μm)。
1.2 实验方法
1.2.1 菌株对底物的降解效果 施氏假单胞菌YC-YH1降解甲基对硫磷的效果以及节杆菌CN2降解对硝基苯酚的效果通过水解圈试验进行展示。具体方法如下:(1)分别制备含100mg/L甲基对硫磷的LB固体平板和100mg/L对硝基苯酚的LB固体平板,备用;(2)向LB液体培养基中分别接入YC-YH1与CN2,培养至对数期(OD600=0.6~0.8),备用;(3)用已灭菌的滤纸片(r=0.8 cm)分别蘸取菌液,放入相应的LB固体平板中央(YC-YH1放入含甲基对硫磷的平板,CN2放入含对硝基苯酚的平板);(4)在30℃下避光培养,间隔一定时间进行观察并拍照。
1.2.2 降解相关基因的克隆 根据已有文献报道[13-16],分别选取甲基对硫磷水解酶基因mpd、有机磷水解酶基因ophC2和opdA以及对硝基苯酚降解相关基因npdA1和npdA2,作为目标序列进行引物设计,引物序列见表1。通过PCR反应对目标基因进行检测,PCR反应条件:95℃预热5Min;95℃18 s,60℃18 s,72℃,mpd、ophC2和npdA1为1Min,opdA与npdA2为2Min,循环34次;72℃10min;10℃30Min。对PCR产物进行琼脂糖凝胶电泳检测,并将阳性结果测序(上海生工生物工程股份有限公司),对测序结果进行BLAST比对分析并将测序结果递交GenBank。

表1 本研究所用引物及引物序列
1.2.3 YC-YH1与CN2对甲基对硫磷的共降解 向LB液体培养基中分别接入YC-YH1与CN2,培养至对数期。取一定体积的培养液,6 000 rpm离心3Min收集菌体,并用新鲜MSM培养基清洗,再次离心收集菌体,重悬于等体积的新鲜MSM培养基中备用。首先,分别配制含100mg/L甲基对硫磷和100mg/L对硝基苯酚的MSM培养基,并按照10%(V︰V)的接种量接种YC-YH1和CN2菌种,其中YC-YH1接入含甲基对硫磷的MSM培养基,CN2接入含对硝基苯酚的MSM培养基;以含相同浓度底物但不接菌的MSM培养基作为对照组;每个处理3次重复。于30℃下振荡培养,转速180 rpm/Min,每8 h取样1次,分别测定甲基对硫磷与对硝基苯酚的浓度。其次,向含100mg/L甲基对硫磷的MSM培养基中,同时接入YC-YH1与CN2各10%。以含相同浓度甲基对硫磷但不接菌的MSM培养基作为对照组。每个处理3次重复。于30℃下振荡培养,转速180 rpm/Min,每8 h取样一次,分别测定甲基对硫磷与对硝基苯酚的浓度。1.2.4 模拟原位土壤修复 供试土壤过20目筛,部分进行灭菌处理(121℃,1 h)。取已灭菌的250ML三角瓶,分别装入100 g灭菌与未灭菌的土壤,两种土壤中均加入甲基对硫磷至终浓度为100mg/kg。取培养至对数期的YC-YH1和CN2菌液,离心收集菌体沉淀,并用新鲜无菌的MSM清洗、重悬,将菌悬液分别加入灭菌土壤和未灭菌土壤中,YC-YH1和CN2至各自浓度约104~105 cfu/g,以不接菌且含相同浓度甲基对硫磷的未灭菌土壤作为对照组。在温度30℃,相对湿度10%左右的环境下进行培养,每12 h取样一次,分别测定甲基对硫磷和对硝基苯酚浓度。每个处理3次重复。
1.2.5 甲基对硫磷和对硝基苯酚提取 每个处理组分别取10 g土壤,加入20ML丙酮,在摇床中剧烈震荡1 h,4℃静置过夜,取2ML过无水Na2SO4柱收集丙酮溶液,以氮气吹扫使丙酮完全挥发,加入正己烷使溶质复溶并经0.22μm的有机相滤膜进行过滤,此样品用于甲基对硫磷浓度检测。另取10 g土壤,加入20ML灭菌纯水,在摇床中剧烈震荡1 h,4℃静置过夜,以0.22μm的滤膜进行过滤,此样品用于对硝基苯酚浓度检测。获得样品均使用高效液相色谱进行检测。
1.2.6 甲基对硫磷和对硝基苯酚测定 制备的样品经0.22μm的滤膜过滤后,分别在254 nm(甲基对硫磷)和320 nm(对硝基苯酚)波长处进行浓度测定。甲基对硫磷检测的流动相为甲醇︰乙腈=80︰20,对硝基苯酚检测的流动相为甲醇︰乙腈︰水=48︰42︰10,流速均为1ML/Min,柱温30℃,进样量2μL。同时采用甲基对硫磷和对硝基苯酚的标准品绘制样品浓度与峰面积的标准曲线(R2=0.993 1,R2=0.987 2)。试验数据均通过SPSS 15.0软件进行整理分析。
2 结果与分析
2.1 菌株对底物的降解效果
水解圈试验能够直观地反映出微生物对底物的降解能力,不过这一试验通常局限于有颜色变化或浑浊度变化的底物。从图1中可以看出,接入YC-YH1后,经过5 d的培养,菌株将底物甲基对硫磷水解成对硝基苯酚,使得菌株周围出现黄色的水解圈(图1A);接入CN2,经过5 d的培养,菌株将培养基中的对硝基苯酚降解,使得原本黄色的培养基变为无色,出现一个透明的水解圈(图1B)。

图1 菌株对底物的降解效果(A:Y C-Y H1降解甲基对硫磷形成的水解圈,B:C N2降解对硝基苯酚形成的水解圈)
2.2 降解相关基因的克隆
以YC-YH1基因组为模板对mpd、ophC2和opdA进行PCR扩增,以CN基因组为模板对npdA1与npdA 2进行PCR扩增,结果如图2所示。由图2可知,mpd、ophC2、npdA1与npdA2结果为阳性,对获得的PCR阳性结果产物进行回收、克隆并测序,测序结果进行BLAST比对分析。其中mpd与ophC2基因序列已递交GenBank并公布,序列分别为KP207597和KP207598,npdA1与npdA2基因序列递交GenBank但未公布。根据获得的参与降解的相关基因[17-18],可以推断,YC-YH1首先通过mpd与ophC2编码的有机磷水解酶基因将甲基对硫磷水解为对硝基苯酚与二甲基硫代硫酸酯,CN2进一步通过npdA1、npdA2等编码的对硝基苯酚降解酶将对硝基苯酚降解,并进入三羧酸循环被微生物所利用。
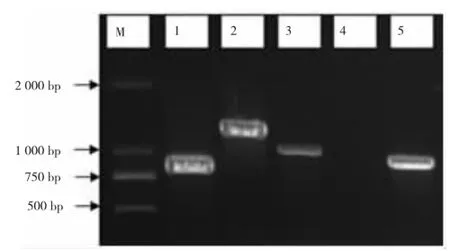
图2 降解相关基因的克隆(M∶D N AMa k e r,1:n p d A1,2:n p d A2,3:o ph C2,4:o p d A,5:Mp d)
2.3 YC-YH1与CN2对甲基对硫磷的共降解
菌株YC-YH1与CN2对甲基对硫磷的共降解效果如图3所示。从图3A中可以看出,YC-YH1菌株单独对甲基对硫磷降解时,甲基对硫磷在72 h内被彻底降解;甲基对硫磷降解的同时伴随着对硝基苯酚的生成,其浓度在16 h后迅速升高,至48 h后达到最高并稳定在42mg/L左右。从图3B中可以看出,CN2菌株降解对硝基苯酚时,处理64 h后对硝基苯酚就被彻底降解了。从图3C中可以看出,用YC-YH1和CN2两种菌株对甲基对硫磷进行共降解时,前期甲基对硫磷降解速率与单独加入YC-YH1时基本一致;同时,随着甲基对硫磷的降解,对硝基苯酚生成且浓度逐渐提高,在32 h时达到最大(23.2mg/L),但随即开始被降解,浓度逐渐下降,在64 h后未检测到对硝基苯酚。
与YC-YH1单独降解相比,YC-YH1和CN2共降解在处理的前32 h无较大差异;但之后,甲基对硫磷和对硝基苯酚的降解速度明显加快,处理48 h后甲基对硫磷即被完全降解,比单独用YC-H1降解时提前了16 h;而由于CN2菌株的加入,共降解条件下对硝基苯酚的浓度显著低于同时期YC-YH1单独降解时对硝基苯酚的浓度,在处理64 h时,对硝基苯酚就被完全降解。
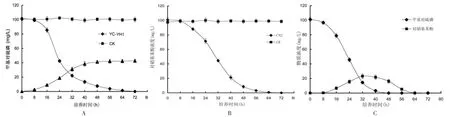
图3 不同处理对甲基对硫磷或对硝基苯酚的降解曲线(A:Y C-Y H 1对甲基对硫磷的降解曲线以及对硝基苯酚的生成曲线;B:C N2对对硝基苯酚的降解曲线;C:Y C-Y H1与C N2对甲基对硫磷的共降解曲线)
综上所述,YC-YH1与CN2两种菌株在共培养条件下,可将甲基对硫磷水解为对硝基苯酚并进一步将对硝基苯酚彻底降解以实现对甲基对硫磷的彻底降解;同时,当体系中对硝基苯酚的浓度较低时,YC-YH1菌株降解甲基对硫磷并未受到明显影响,而当体系中对硝基苯酚的浓度逐渐升高时,在一定程度上会抑制YC-YH1菌株对甲基对硫磷的降解作用。因此,YC-YH1与CN2共降解不仅实现了对甲基对硫磷的彻底降解,同时还在一定程度上减小了产物反馈对降解过程的抑制作用。
2.4 YC-YH1与CN2在不同土壤中对甲基对硫磷的降解效果
从图4中可以看出,不同土壤中甲基对硫磷降解速率有一定差异。在灭菌土壤中,甲基对硫磷降解速率相对缓慢,且当甲基对硫磷浓度低于10mg/kg时,残余的甲基对硫磷很难被彻底降解,始终存在残留;同时,降解形成的对硝基苯酚在32 h时出现一个最高峰值(23.2mg/kg),随后浓度逐渐下降,在72 h以后基本稳定在2mg/kg。而在未灭菌土壤中,甲基对硫磷降解速率明显比在灭菌土壤中的降解速率快,且处理72 h后,甲基对硫磷即被完全降解,而对硝基苯酚产生的趋势与灭菌土中基本一致,但峰值仅为灭菌土壤中的一半(9.6mg/kg),且在72 h后被彻底降解。在对照组中,甲基对硫磷的浓度下降缓慢,且并未检测出对硝基苯酚。上述结果表明,在未灭菌的土壤中,土壤中其他微生物可能对甲基对硫磷和对硝基苯酚有一定的协同降解作用。

图4 不同土壤中YC-YH1与CN2对甲基对硫磷的共降解曲线(A:甲基对硫磷降解曲线,B:对硝基苯酚降解曲线)
3 结论
通常情况下,单一微生物处理很难实现污染物的彻底降解,因此在获得污染物降解菌构建共降解菌群的同时,稳定降解菌群与土著微生物间的群落结构也非常重要[19-20]。研究通过施氏假单胞菌YC-YH1与节杆菌CN2的共同作用,实现了对甲基对硫磷的彻底降解,同时克隆了mpd、ophC2、npdA 1和npdA 2等参与降解过程的基因,并通过分析推断了它们在甲基对硫磷降解过程中的作用,最后通过土壤修复试验初步评估了施氏假单胞菌YC-YH1与节杆菌CN2在甲基对硫磷污染土壤原位修复中的应用潜能。结果表明,在未灭菌土壤中,处理72 h后甲基对硫磷和对硝基苯酚均被完全降解。
[1] SinghBK. Organophosphorus-degradingbacteria∶ ecologyand industrial applications[J]. Nature Reviews Microbiology,2008,7(2):156-164.
[2] Fenner K,Canonica S,Wackett L P,et al. Evaluating pesticide degradation in the environment:blind spots and emerging opportunities[J]. Science,2013,341(6147):752-758.
[3] Silambarasan S,Abraham J. Efficacy of Ganoderma sp. JAS4 in bioremediation of chlorpyrifos and its hydrolyzing metabolite TCP from agricultural soil[J]. Journal of Basic Microbiology,2014,54(1):44-55.
[4] Nielsen M B,Ingvorsen K. Biodegradation of para-nitrophenol by Citricoccus nitrophenolicus strain PNP1 (T)at high pH [J].Biodegradation,2013,24(1):79-87.
[5] Liu F Y,Hong M Z,Liu D M,et al. Biodegradation of methyl parathion byAcinetobacter radioresistens USTB-04 [J]. Journal of Environmental Sciences,2007,19(10):1257-1260.
[6] Shen Y J,Lu P,Mei H,et al. Isolation of a methyl parathion-degrading strain Stenotrophomonas sp. SMSP-1 and cloning of the ophC2 gene[J].Biodegradation,2010,21(5):785-792.
[7]耿芳芳,王 慧,秦 伟,等.基于构建微生物传感器的甲基对硫磷降解菌的分离鉴定及其降解特性研究 [J].农业资源与环境学报,2014,31(6):521-526.
[8] Shi Y H,Ren L,Jia Y,et al. Genome sequence of organophosphorus pesticide-degrading bacterium pseudomonas stutzeri strain YC-YH1[J].Genome Announc,2015,3(2):192-207.
[9]解秀平,闫艳春,刘萍萍,等.降解甲基对硫磷的节杆菌(Arthrobacter sp.)L4菌株的分离和降解特性研究[J].环境科学学报,2006,(10):1637-1642.
[10] Pino N J,Dominguez M C,Penuela G A. Isolation of a selected microbial consortium capable of degrading methyl parathion and p-nitrophenol from a contaminated soil site[J]. Journal of environmental science andhealth(B),2011,46(2):173-180.
[11]张 霞,张书泰,谢顺昌,等.一株甲基对硫磷降解菌-布朗克假丝酵母J MU P MD-1的分离与鉴定[J].激光生物学报,2014,(2):183-188.
[12] Zhang S,Sun W,Xu L,et al. Identification of the para-nitrophenol catabolic pathway,and characterization of three enzymes involved in the hydroquinone pathway,in Peudomonas sp. 1-7 [J]. BMC Microbiology,2012,12:27.
[13] Yang C,Liu N,Guo X,et al. Cloning of mpd gene from a chlorpyrifosdegrading bacterium and use of this strain in bioremediation of contaminated soil [J]. FEMS microbiology letters,2006,265(1):118-125.
[14] Siddavattam D,Khajamohiddin S,Manavathi B,et al. Transposon-like organization of the plasmid-borne organophosphate degradation(opd)gene cluster found in Flavobacterium sp.[J]. Applied and environmental microbiology,2003,69(5):2533-2539.
[15] Fanyunliu W D S L. Isolation,purification and characterization of a new organphosphorus hydrolase OPHC2 [J]. Chinese Science Bulletin,2004,49(3):268-272.
[16] Perry L L,Zylstra G J. Cloning of a gene cluster involved in the catabolism of p-nitrophenol by Arthrobacter sp. strain JS443 and characterization of the p-nitrophenol monooxygenase [J]. Journal of Bacteriology,2007,189(21):7563-7572.
[17] Shen Y J,Lu P,Mei H,et al. Isolation of a methyl parathion-degrading strain Stenotrophomonas sp. SMSP-1 and cloning of the ophc2 gene[J].Biodegradation,2010,21(5):785-792.
[19] Kent A D,Triplett E W. Microbial communities and their interactions in soil and rhizosphere ecosystems[J]. Annual Review of Microbiology,2002,56:211-236.
[20]杨 丽,赵宇华,张炳欣,等.一株毒死蜱降解细菌的分离鉴定及其在土壤修复中的应用[J].微生物学报,2005,(6):89-93.
(责任编辑:成 平)
Co-degradation of Methyl Parathion by PseudoMonas stutzeri and Arthrobacter sp.
SHIYan-hua,LEIRen,YANG Jia,YAN Yan-chun
(Graduate School of Chinese Academy of Agricultural Sciences,Beijing 100081,PRC)
To completely degrademethylparathion,Pseudomonasstutzeri YC-YH1 and Arthrobacter sp.CN2were utilized to co-degrade methyl parathion.Cloning of degrading related geneswas conducted to investigate the degrading mechanism.The results showed that compared to the degradation of YC-YH1 alone,therewere no differences in the first32 h w ith the co-degradation of YC-YH1 and CN2. But later,the degradation velocity of parathion-methyl and p-nitrophenol speeded up obviously,only 48 h later,parathion-methylwas degraded completely,and 64 h later,p-nitrophenol was degraded too.In in situ bioremediation assay,strain YC-YH1 and CN2 could efficiently degrademethyl parathion and the degradation rate of 100 mg/kg methyl parathion in soil was almost 100%in 72 hours, especially in non-sterilized soil.
methyl Parathion,p-nitropehnol,Pseudomonasstutzeri,Arthrobacter sp.co-degradation
10.16498/j.cnki.hnnykx.2015.04.031
X172
A
1006-060X(2015)04-0097-05
2015-05-09
国家自然科学基金资助项目(31170119);中国农业科学院基本科研业务基金资助项目 (0042014006,0042012003,0042011006)
史延华(1983-),男,山东临朐县人,博士研究生,主要从事环境微生物学研究。
闫艳春

