八仙花叶片诱导再生技术
赵盈盈,彭尽晖,陈小超,黄 宇
(湖南农业大学园艺园林学院,湖南 长沙 410128)
八仙花叶片诱导再生技术
赵盈盈,彭尽晖,陈小超,黄 宇
(湖南农业大学园艺园林学院,湖南 长沙 410128)
以八仙花(Hydrangea macrophylla 'Adria)' 红色品种无菌苗为试验材料,使用其叶片为外植体进行再生研究,建立了八仙花叶片高效离体再生体系。结果显示:适宜的叶片诱导愈伤培养基为MS+6-BA 2.5Mg/L+IAA 0.2Mg/L,出愈率达100%;适宜的芽直接诱导分化培养基为MS+6-BA 3.0Mg/L+N AA 0.3Mg/L,分化率可达80%;暗培养15 d是叶片诱导芽再生最适合的时间。最适宜的叶片切割大小是垂直于主脉切两刀,但是不能断开,此时芽诱导率最佳。切取3 c m高的无菌苗接种在生根培养基上,最适宜的生根培养基为1/2MS+蛭石和珍珠岩各一半混合,不添加激素,生根率达100%,且根生长健壮。
八仙花;叶片再生;暗培养
八仙花(Hydrangeamacrophylla)为虎儿草科木本观赏植物,原产于中国和日本。因其花大色艳,寓意美好,深受人们的喜爱[1]。现代花卉市场上,八仙花的生产量远不及其需求量。关于八仙花组织培养的报道较多,任叔辉等[2-7]以八仙花带腋芽的茎段、茎尖、叶柄和叶片为外植体,分别获得了八仙花的再生体系。2011年冯润东等[8]报道了八仙花组织培养技术,之后刘峰[9]以八仙花叶片为外植体,诱导出了不定芽,王忠武[10]报道了关于八仙花茎尖离体培养,但近年来几乎没有关于八仙花组织培养技术的报道。八仙花多为不育花,难以通过传统的杂交育种获得优良性状,而分子技术的兴起克服了这一障碍。分子技术育种可以定向修改某一特定形状而不改变其原有的性状,但是遗传转化需要良好的受体,而植物叶片是分子转化中最佳受体。因此,研究植物叶片再生可以为今后分子遗传转化提供良好的受体[1]。关于植物叶片直接再生的研究较多,最近报道的有关于无患子优树[11]、‘惠’苹果自交实生苗[12]、欧洲甜樱桃砧木‘SL64’离体[13]、结球甘蓝离体[14]、玫瑰[15]、‘北林雄株1号’和‘北林雄株2号’[16]及番茄[17]等植物叶片再生的研究。本试验主要研究八仙花叶片直接再生体系的建立,为今后八仙花分子遗传转化试验提供科学参考。
1 材料与方法
1.1 试验材料
供试材料为八仙花红色品种(H.macrophylla 'Adria)',见图1所示,由湖南农业大学观赏园艺研究所提供。

图1 试验八仙花品种
1.2 试验方法
1.2.1培养条件 光照时间约14 h,光照强度约1 500~2 000 lx,培养温度25℃左右。
1.2.2 八仙花叶片愈伤组织诱导培养 挑选长势一致、生长健壮的八仙花组培苗,选取顶端叶面充分展开的幼嫩叶片,垂直叶片主脉方向剪切3~5个伤口将其叶背朝下与诱导培养基充分接触培养。接种于以MS为基本培养基,添加不同配比激素的培养基上。每个处理接种10瓶且每瓶接种5个叶片,设3个重复接种后70 d观察愈伤组织的分化情况,统计其出愈率。
1.2.3 八仙花叶片不定芽直接诱导培养 以MS为基本培养基,添加不同配比激素的培养基上。接种后70 d检查出芽率。
1.2.4 叶片切割大小对芽直接再生的诱导 将生长健壮的叶片切割成面积大小不同的正方形,转接到6-BA 3.0mg/L+NAA 0.3mg/L的培养基上,先放到暗条件下培养15 d后,转到其他条件相同的光下培养。70 d后观察芽的增殖情况。
1.2.5 暗培养对芽直接再生的诱导 设置暗培养0 10、15、20、25 d 5种处理,黑暗培养完成后将其转到光下继续培养;以0 d暗培养为对照。接种70 d统计其出芽率。
1.2.6 再生植株的生根培养 将生长至3 cm以上的不定芽转入生根培养基进行生根诱导,每组处理接种2瓶,每瓶接种5个不定芽,设3次重复。培养基均为1/2MS培养基,不添加任何激素。25 d后观察其生根情况,统计其平均根长,平均生根数和生根率。
1.2.7 计算公式 出愈率(%)=(产生愈伤叶片数/接种总叶片数)×100
出芽率(%)=(分化芽的叶块数/接种的叶块数)× 100
再生芽平均数(个)=叶片再生芽的总数/再生芽的叶片数
生根率(%)=(生根试管苗数/接种试管苗数)×100
2 结果与分析
2.1 八仙花叶片愈伤组织诱导培养基筛选
由表1可知,处理1的出愈率在6组培养基中最低,仅为54%。随着6-BA的浓度增加到2.5mg/L,出愈率提高到100%。处理5产生愈伤叶片个数最多,平均为50个,即所有的叶片均能在此培养基上产生愈伤。从表1中还可以看出,随着6-BA浓度的增加,出愈率也随着增加,说明在一定情况下高浓度的细胞分裂素有利于细胞的分化,但是当浓度增加到3.0mg/L时,出愈率减弱,说明较高的细胞分裂素能够抑制叶片愈伤组织的产生。由此可知,2.5mg/L的6-BA有利于八仙花叶片产生愈伤组织。因此,处理5(MS+ 6-BA 2.5mg/L+NAA 0.2mg/L)是最适合八仙花叶片愈伤组织诱导的培养基。

表1 不同培养基对八仙花叶片出愈率的影响
2.2 叶片切割大小对芽诱导的影响
由表2可知,将叶片切割成大小不同的正方形接种于培养基上,叶片切割较小时,出芽率芽和平均数都较低,不利于芽的再生。但是将整个叶片垂直于主脉切两刀,出芽率可达90%,芽平均数也达到了7.2个。由此可知:八仙花叶片再生最佳切割方式是,不应将主脉切断,而是伤其主脉后直接将整个叶片放在培养基上培养。

大小(c m)3 × 3 5 × 5整片叶片接种叶片(片)1 0 1 0 1 0分化叶块(块)1 6 9芽分化(个)1 3 1 6 6出芽率(%)1 0 6 0 9 0芽平均数(个)1 . 0 5 . 0 7 . 2
2.3 八仙花叶片不定芽直接诱导培养基的筛选
将生长健壮的叶片放入芽诱导培养基上,不同浓度激素的培养基对叶片直接诱导芽的产生影响很大。表3表明:10组处理中,处理8分化的叶片数最多,为43个,芽诱导率最高达86%,不定芽分化总数可达172个,单个叶片平均分化芽数也最多,高达4.0个,与其他培养基的分化率差异也较为显著。与处理8相比,处理7虽然只有28个叶片有芽的分化,但是其平均再生芽个数也达到了4.0个,且芽生长粗壮,颜色浓绿,伤口处还有颜色浓绿、生长紧密的愈伤组织出现。处理9虽然出芽率可达78%,但是其平均再生芽个数较少,其芽较为健壮。由以上数据可知,要让叶片直接分化出芽,且芽健壮易于在继代培养基上增殖生长,最适的培养基为处理8即6-BA 3.0mg/L+NAA 0.3 mg/L。
2.4 暗培养对芽直接再生的诱导
暗培养一段时间有利于芽的分化[6]。由表4可知:八仙花在暗处理15 d后芽的分化率最高,芽分化平均数可达7.2个。八仙花叶片增殖过程如图2所示,重芽分化量多,且芽生长健壮。但是过长时间的暗培养处理,不利于芽的分化。研究还发现,在黑暗条件下,八仙花叶片很难分化愈伤组织,但是将叶片进行一段时间的暗处理,然后将其在光照下培养,在较短的时间内就有大量的愈伤分化。

表3 不同激素对八仙花不定芽诱导率与再生芽数的影响
2.5 再生植株的生根诱导培养
从表5可知:在不同基质上,八仙花幼苗均能长出根来,且生根率在80%以上,其中处理1、2、4、5的生根率可达到100%。其中处理4、5、7的平均生根数达到14条及以上,且处理5的生根数达到了25以上,根系生长粗壮浓密,且有侧根的分化,芽生长健壮。由此可知,粗蛭石+珍珠岩作为八仙花生根诱导的基质更加有利于根的分化和生长,而直径较小的细蛭石和凝固的琼脂会产生大量气生根。所以,粗蛭石+珍珠岩是八仙花根诱导分化的最佳基质。如图3所示,6种基质各有优缺点。琼脂能更好地固定不定芽,但是其透气性相对较差,容易被细菌污染导致植株死亡;细蛭石和珍珠岩,可以相对好的保水和固定无菌苗,但其透气性也相对较弱,易导致植株与其接触部分溃烂,使植株后期生长较弱;粗蛭石虽然透气性较好,但是保水能力相对较弱,不易固定植株;植株入土种植后生长更加健壮,且根系发达。但是从后期生长来看,粗蛭石+珠岩的苗子能更好地适应环境。

表4 暗处理对八仙花叶片分化的影响
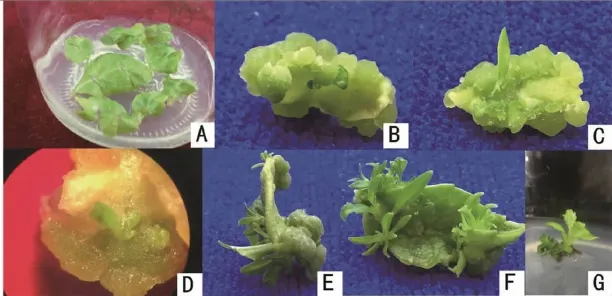
图2叶片增殖过程(A,接种5 d的叶片;B,开始出现芽点;C,出现一个子叶;D,出现两片子叶;E、F,大量芽产生;G,转入继代培养的芽)
3 讨论与结论
植物激素对八仙花叶片的出愈率和芽诱导率都有较大的影响。在八仙花叶片愈伤组织诱导的过程中,随着细胞分裂素即6-BA浓度的增加,出愈率呈现先升高后降低的变化,因而选择适当的细胞分裂素浓度对八仙花叶片直接再生诱导有着极为关键的意义。选择较高的细胞分裂素和较低的生长素,有利于愈伤组织的分化。细胞分裂素与生长素NAA的比值在3.0∶0.3时,有利于芽的直接再生。

表5 不同基质对八仙花不定芽生根的影响

图3 植株生根培养
适当的暗培养可促进芽的分化,但应注意的是暗培养时间过长,不但不能促进芽的分化,愈伤组织也很难形成。刘峰[9]在研究八仙花叶片分化时,也发现了一定的暗培养可以诱导芽的分化。师校欣等[18]认为,暗培养可以促进试管苗的生长与生根,这与内源激素的变化有关,通常认为生长素可促进生根,生长素IAA易在光照条件下分解。但也有报道认为,暗处理可使黑桃试管苗生根率提高,而在光照条件下IAA含量始终大于暗培养条件[19]。暗培养促进芽分化与暗培养促进根的生长有什么不同的地方还无从得之,也没有相关的文献报道,光照条件为何会导致芽分化率降低且分化速度缓慢,还需要进一步的研究证明。
本试验采用在1/2MS培养基的营养液中,加入不同基质诱导八仙花幼苗生根。添加的几种基质,市场上容易买到,价格便宜,能重复利用,且生根率高,不易有气生根的产生。气生根的产生,可能是因为琼脂和细蛭石之间空隙较小,氧气缺乏。使用粗的蛭石几乎无气生根产生。
最近的研究主要集中于获得八仙花的脱毒苗,而八仙花外植体消毒,品种差异大,不定芽分化率低等问题仍然是急需解决的问题[1]。而之前的文章主要介绍了快速繁殖获得无菌苗运用在生产上,少有文章提及分子技术遗传育种。本试验中采用叶片为外植体,建立八仙花高效再生体系,可为八仙花今后的分子育种提供基础。
[1]彭 亮,彭尽晖,赵盈盈,等.八仙花组织培养研究进展[J].安徽农业科学,2014,10:2863-2864,2892.
[2]任叔辉.八仙花的组织培养与快繁技术[J].防护林科技,2006,(1):10-11.
[3]雷亚灵,李周岐.八仙花茎段组织培养技术研究[J].西北林学院学报,2008,(4):101-103,108.
[4]龚 伟,王米力,石大兴.八仙花离体培养和植株再生[J].植物生理学通讯,2003,(6):624.
[5] 殷丽青,胡永红,汤桂钧,等. 优良八仙花品种(Hydrangeaserrata‘Preziosa’) 的离体培养与快速繁殖[J]. 上海农业学报,2010,(1):38-41.
[6] 范小峰,杨建霞,杨颖丽.八仙花愈伤组织诱导与快速繁殖[J].经济林研究,2009,(1):41-44.
[7]刘锦霞,杨兰廷,沈思远,等.多效唑对八仙花组培苗营养生长及成花的影响[J].北方园艺,2007,(6):205-207.
[8]冯润东,孙宏刚.八仙花组织培养繁殖技术[J].北华大学学报(自然科学版),2011,12(3):350-352.
[9]刘 峰.八仙花和艳果金丝桃再生与遗传转化体系研究 [D].武汉:华中农业大学,2011.
[10]王忠武,建德锋.八仙花茎尖离体培养技术研究[J].北方园艺,2012,(9):129-130.
[11]邢建宏,彭漳清,刘希华,等.无患子优树叶片体细胞胚胎发生及植株再生的研究[J].三明学院学报,2014,31(6):93-100.
[12]郝红梅,田 义,张利义,等.‘惠’苹果自交实生苗叶片高效再生研究[J].中国农学通报,2015,31(1):83-87.
[13]李洪雯,刘建军,陈克玲,等.欧洲甜樱桃砧木‘S L64’离体叶片再生体系研究[J].果树学报,2014,31(S1):74-77,218.
[14]黄小云,陶 鹏,王五宏,等.结球甘蓝离体叶片不定芽的再生研究[J].浙江农业科学,2014,(1):34-38.
[15]邢 文,包 颖,丁 萌,等.玫瑰叶片直接再生及其影响因素[J].华中农业大学学报,2014,33(1):29-34.
[16]王沛琦,张平冬,李 媛,等.‘北林雄株1号’和‘北林雄株2号’叶片再生体系的建立[J].中国农学通报,2014,30(7):11-16.
[17]张玉英,韦正乙,王云鹏,等.番茄叶片高频再生体系的建立[J].吉林农业科学,2014,(2):78-82,86.
[18]师校欣,杜国强,高 仪,等.黑暗培养对苹果组培快繁及叶片再生的影响[J].河北农业大学学报,2004,6(4):18-21.
[19]田国栋,张荷芃,康卓慧,等.桃叶片再生不定芽的研究[J].西北农林科技大学学报(自然科学版),2011,11(2):125-132.
(责任编辑:卢红玲)
Leaf Regeneration Technology of Hydrangea Macrophylla
ZHAO Ying-ying,PENG Jin-hui,CHEN Xiao-chao,HUANG Yu
(College of Horticulture and Landscape,Hunan Agricultural University,Changsha 410128,PRC)
An efficaciousmethod for plants regenerate froMleaf exp lants of Hydrangeamacrophylla was established.The optimal callus inducingmediuMfor Hydrangeamacrophylla leaveswasMS+6-BA 2.5mg/L+IAA 0.2mg/L,and the callus induction rateswas 100%. The resultsshowed thatbud differentiation thegreatmediuMwasMS+6-BA 3.0mg/L+NAA 0.3mg/L,and thebud differentiations rate was80%.The proper timewhich could promote bud’sdifferentiation of the leafwas darkness treatment for15 days.Perpendicular to the main vein cut two kniveswas bestway to the bud differentiations.Buds over 3 cMheightcould forMadventitious roots in 1/2MS+50% vermiculite+50%perlitewithouthormone,and the rateof rootingwasup to 100%.
Hydrangeamacrophylla;leaf regeneration;dark treatment
S685.99
A
1006-060X(2015)04-0081-04
10.16498/j.cnki.hnnykx.2015.04.026
2014-10-30
国家自然基金青年项目(N o.31201656);湖南省大学生科技创新项目(C X1112)
赵盈盈(1989-),女,贵州绥阳县人,硕士研究生,研究方向为观赏园艺分子技术。
彭尽晖

