运动对小鼠心肌miRNA-1及热休克蛋白的影响
马志勇,赵永才
(唐山师范学院 体育系,河北 唐山 063000)
运动对小鼠心肌miRNA-1及热休克蛋白的影响
马志勇,赵永才
(唐山师范学院 体育系,河北 唐山 063000)
探究长期游泳训练对心脏的影响。小鼠进行8周的游泳训练,训练结束后进行心脏超声结构的检查,并且应用RT-PCR和免疫印迹法对miRNA-1和热休克蛋白60、70进行检测。结果发现训练后小鼠心脏结构出现肥大变化,而且miRNA-1明显表达下降,而热休克蛋白60变化不显著,但热休克蛋白70明显提高,说明心脏肥大适应同时分子的变化有保护心脏的效应。
运动;游泳;热休克蛋白70;微小RNA;心脏
运动心脏的形成机制是目前体育学科研究热点,认为心脏随着外界环境的变化能产生适应性改变,有些变化属于生理性,如运动性肥大,可以在刺激消失后逐渐恢复,有些属于不可逆病理性变化,如心梗等病症发生。心脏的适应变化不仅与血流负荷等宏观因素有关系,而且与心肌内的分子调节有密切关系,因此研究心脏适应变化分子机制是当前研究重点。近年来发现microRNA(miRNA,miR)具有多种心脏特异表达类型,可调节动物心脏生长和发育,影响疾病及环境适应相关基因表达,对心脏重塑适应中的信号通路具有调节作用。miRNA是一类长约20 nt非编码RNA,转录后水平调节各类基因表达,具有保守性、基因簇集排列和组织特异表达一些特点[1],是最大的基因家族之一,大约占整个基因组的1%[2]。miRNA通过与目标蛋白mRNA的 3'非翻译区互补配对,对mRNA进行抑制,降低蛋白表达[3],近年对miRNA的研究已成为热点。前人发现miRNA-1在心肌内能以热休克蛋白60(Hsp60)和Hsp70为直接目标,抑制其表达,对心肌凋亡和重塑适应产生影响[4],本文考察游泳训练对miRNA-1、Hsp60和Hsp70的影响,观察心脏结构的适应,考察心脏运动适应和探索运动心脏形成的分子机制。
1 材料与方法
1.1 实验动物与分组训练
7周雄性C57BL/6小鼠16只,由河北联合大学动物实验中心提供。自由饮食、饮水,分笼饲养。随机分为2组,每组8只,为安静对照组(control group,C组)、8周耐力训练组(training group,T组),运动前各组间小鼠体重无显著性差异。T组进行无负重游泳训练,先适应性游泳训练3天。开始8周训练,每周训练5天,前5周,每天晚间运动1次,后3周每天运动两次,间隔6 h;第一周每次运动30 min,从第二周起每周增加10 min直至90 min,最后两周均维持在90 min。
1.2 组织取样及称重
T组在最后一次训练结束24 h后两组同时取材,先称体重(BW),小鼠迅速引颈处死,取完整心脏并进行修剪,将心脏沿冠状面切开,滤纸吸干心脏表面的液体后称重心脏(HW),迅速放入液氮速冻,于-80℃低温冰箱保存待用。
训练最后一周,全部小鼠腹腔注射饱和三溴乙醇麻醉后,仰卧位固定于操作台上,小动物超声仪(Vevo770型)采集小鼠心脏的二维、M型超声心动图像,测量并评价心脏结构和功能的适应情况。本研究测定指标:舒张期心室隔膜厚度(IVSTD)、收缩期心室隔膜厚度(IVSTS)、舒张期心室后壁厚度(PWTD)、收缩期心室后壁厚度(PWTS)、左心室舒张末期内径(LVEDD)。
1.4 Real-time PCR技术检测miRNA-1
1.4.1 扩增引物
采用Real-time PCR技术测定心肌miRNA-1,miR NA引物由北京博奥生物有限公司合成,管家基因以U 6作为内参,引物序列(5'→3'方向),miRNA sense引物:GTGCAGGGTCCGAGGT;miRNA-1 anti-sense引物:ACGCCTGGAATGTAAAGAAGTATG;U6-F:CTCGCTTCGGCAGCACA;U6-R:AACGCTTCACGA ATTTGCGT。
1.4.2 总RNA提取及逆转录
严格按照RNA提取试剂盒要求提取总RNA,取100 ng RNA利用miRNA逆转录引物进行cDNA的合成。20µL反应体系中包括Nuclease-Free Water 11.3 μL,miRNA-Stem-Loop反转录引物1 μL,5×First-Strand Buffer 4 µL,0.1 M DTT 2 µL,dNTP混合液0.5 µL(TaKaRa公司),M-MLV逆转录酶1 µL(Invitrogen公司),RNA酶抑制剂0.2 µL(Promega公司),反应条件:16 ℃,10 min;37 ℃,30 min;65 ℃,5 min。
1.4.3 Real-time PCR反应
反应体系包括以下试剂:Power SYBR Green PCR Master Mix 10µL(内含DNA聚合酶、Buffer、dNTP、SYBR Green),miRNA cDNA 1µL,miRNA通用上游引物(10µM)0.5 µL,miRNA特异性下游引物(10µM)0.5 µL,Nuclease-Free Water 8 µL,总反应体积20µL,进行40个反应循环,反应条件:95 ℃变性,10 min;95 ℃,15 s;60 ℃,1 min。采用ΔΔCT法计算样品miRNA-1相对含量。
此文由我刊特约撰稿人肖进新博士编译。原文作者Divya B.Tripathy, Anuradha Mishra, James Clark, Thomas Farmer来源于Comptes Rendus Chimie中的Synthesis, chemistry, physicochemical properties and industrial applications of amino acid surfactants: A review一文,谨向原文作者致以崇高的敬意。
1.5 Western blotting检测蛋白
冷冻肌组织提取蛋白,样品与裂解液混合,冰上培养20 min,12,000 g离心20分钟提取蛋白。蛋白样品上样,浓缩胶浓度为5%,分离胶浓度为8%,120 V电泳50 min。电泳结束后目的蛋白转印至PVDF膜(Millipore),然后将PVDF膜浸入5%脱脂奶粉中封闭2 h。4℃孵育一抗过夜,Hsp60、Hsp70抗体1∶1 000稀释(博士德生物有限公司),GAPDH抗体1∶10 000稀释(康成生物),洗膜后过氧化物酶标记二抗37 ℃环境孵育1 h。ECL试剂(碧云天生物公司)作用于PVDF膜上,然后于暗室中显影和定影,凝胶成像系统半定量分析确定蛋白表达相对含量。
1.6 统计学方法
数据输入SPSS16.0统计软件,采用独立样本T检验统计方法分析数据,数据以平均数±标准差表示,P<0.05及P<0.01表示有显著性和非常显著性差异。
2 结果
2.1 运动训练影响下小鼠超声心动检测结果
两个组别体重无显著差异(P>0.05),T组训练后只体重有下降的趋势;T组心脏整体重量(HW)和心脏/体重比值(HW/BW)两个指标要显著性高于C组(P<0.05);发现舒张期心室后壁厚度(PWTD)、左心室舒张末期内径(LVEDD)、舒张期心室隔膜厚度(IVSTD)、收缩期心室隔膜厚度(IVSTS)四个指标,T组训练后也明显大于C组(P<0.01),但是收缩期心室后壁厚度(PWTS)无显著差异,总结果表明8周训练使小鼠心肌呈现肥大适应,参考表1。
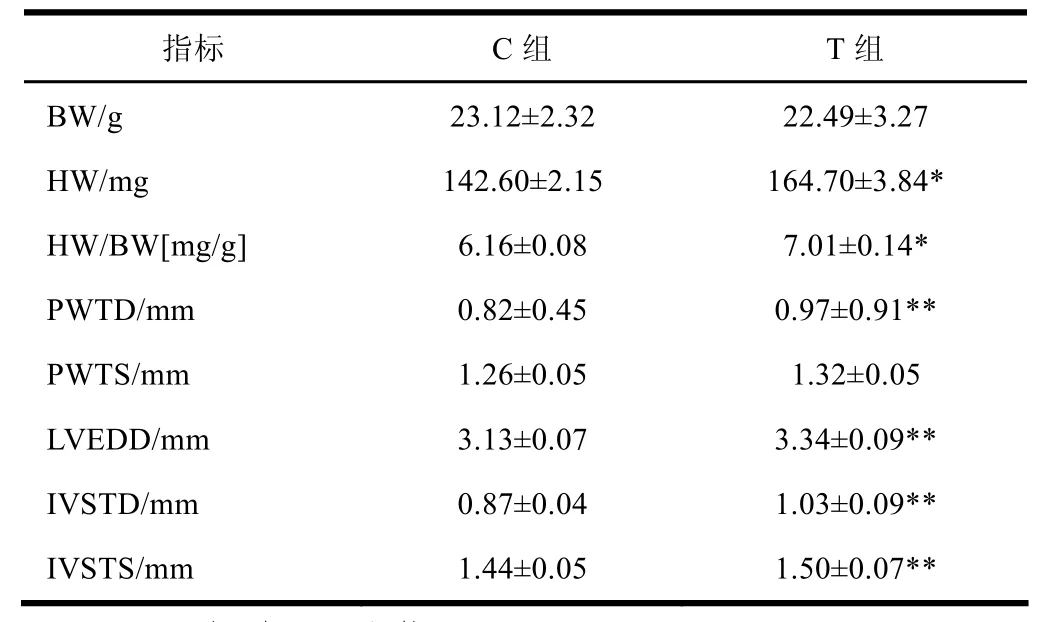
表1 训练后小鼠超声心动仪测试结果一览表(n=8)
2.2 运动训练影响下miRNA-1及蛋白表达结果
耐力训练对心肌miRNA-1表达影响显著;与C组比较,miRNA-1经过8周训练后显著性下降(p<0.05);HSP60、HSP70表达变化不同,相比C组,HSP60无明显提高(p>0.05),但HSP70表达却明显高于C组,且具有非常显著性差异(p<0.01),参考表2及图1。

表2 运动影响下心肌miRNA-1表达情况(n=8)

图1 运动训练后心肌HSP60、70表达对比
3 讨论
3.1 运动训练后小鼠心脏结构变化
本研究首先观察游泳负荷对心脏结构的影响,心脏结构对运动最经典适应就是肥大,关于运动训练制作心脏生理肥大模型研究较多,国外常用游泳训练诱导动物心脏肥大。大鼠常见肥大方案如下:一种是连续运动训练10周,5次/周,运动60 min/次;另一种方案是前8周和第1种方案相同,但第9周开始每天2次60 min运动,间隔6 h,第10周每天3次60 min运动,间隔4 h。两种运动方案均能诱导大鼠心肌肥大,但第二种方案负荷较大,对心肌肥大的效果更加显著[5]。小鼠游泳训练也能诱导心肌肥大,常用如下模型:小鼠每天两次运动,间歇4 h,第一天每次运动10 min,随后每天增加10 min,直至90 min,然后在次基础上再训练28天,共计37天运动训练,不同研究在此模型上不断改进,最短甚至21天就能成功制造小鼠左心室肥大适应[6]。
本文首先考察长期耐力训练影响下心脏结构的变化,参考前人研究模型[7],延长小鼠训练时间,共进行8周训练,而且后面几周增加训练负荷。在取材前进行超声心动图检测,发现长期耐力运动对小鼠心脏结构影响显著。T组小鼠心脏整体重量和心脏/体重比值两个指标明显高于C组,除了收缩期心室后壁厚度无显著增加外,舒张期心室后壁厚度、左心室舒张末期内径、舒张期心室隔膜厚度、收缩期心室隔膜厚度四个指标均明显大于C组。数据表明本研究中小鼠心脏呈现肥大适应,说明小鼠对本研究游泳训练较敏感,而且观察数据可发现心室内径扩大,有离心性肥大倾向。
3.2 运动影响下miRNA-1和热休克蛋白表达
miRNA在心脏发育和功能变化中起到重要调节作用,涉及的信号通路参与了心肌肥厚的发生,如Ras-MAPK、NFAT、PI3K-AKT通路。研究较多的是miRNA-1,发现miRNA-1在小鼠和人体的心肌肥大中起抑制作用[8]。MiRNA-1抑制心肌肥大机制较为复杂,认为miRNA-1通过抑制Ca2+/钙调蛋白(Calm)-神经钙蛋白(Cn)-NFAT路径抑制增殖,阻止了MEF2、GATA4这些转录因子对蛋白基因的诱导作用[9]。另外心肌细胞中,miRNA-1还能通过抑制热休克蛋白60(Hsp60)和Hsp70蛋白的表达促进心肌细胞的凋亡[4],对细胞凋亡的发生有一定辅助作用。热休克蛋白(HSP)是机体在各种刺激作用下激活后产生的一组在结构上高度保守的多肽。肌肉在运动与缺氧的情况下热休克蛋白的表达会有所增加,热休克蛋白赋予细胞保护作用,从而使细胞免遭高热、缺氧、缺血再灌注、自由基等损伤[10]。本研究中miRNA-1首先显著性下降,说明长期游泳耐力训练能降低miRNA-1的表达,这种变化和心脏结构肥大变化相对应,miRNA-1表达下降有效释放对下游相关蛋白的控制,肥大发生信号可进一步增强,可能是小鼠心脏肥大的一个机制。另外本研究考察了miRNA-1靶目标HSP60和HSP70的变化情况,尽管研究证实miRNA-1直接抑制HSP60和HSP70的蛋白翻译,但HSP60表达并没有发生预期明显上升的变化,而HSP70的变化和miRNA-1变化相反,其表达显著提升。总体上热休克蛋白表达上升,这说明本次训练负荷能对机体产生良好影响,心脏生理肥大发生同时热休克蛋白增加,可能对凋亡产生抑制,以后可以继续探究这种模型下具体凋亡的发生变化。
4 结论
8周游泳耐力训练可以诱导雄性C57BL/6小鼠心肌肥大,其中miRNA-1的下降和HSP70的升高可对心脏产生积极影响,分子变化可能是心脏肥大的机制之一,同时能够对抗凋亡等不利因素,从而产生运动训练后的心脏保护效应。
[1] ZHANG B, WANG Q, PAN X. MicroRNAs and their regulatory roles in animals and plants[J]. J Cell Physiol, 2007, 210(2)∶ 279-289.
[2] BARTEL DP. MicroRNA∶ genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2)∶ 281-297.
[3] ZHAO Y, SRIVASTAVA D. A developmental view of microRNA function[J]. Trends Biochem Sci, 2007, 32(4)∶189-197.
[4] Xu C, Lu Y, Pan Z, et al. The muscle-specific microRNAs miR-1 and miR-133 produce opposing effects on apoptosis by targeting HSP60, HSP70 and caspase-9 in cardiomyocytes[J]. J Cell Sci, 2007, 120(pt17)∶ 3045-3052.
[5] OLIVEIRA E M, SASAKI M S, CERENCIO M, et al. Localrenin-angiotensin system regulates left ventricular hypertrophy induced by swimming training independent of circulating renin: a pharmacological study[J]. J Renin Angiotensin Aldosterone Syst, 2009, 10(1): 15-23.
[6] DEBOSCH B, TRESKOV I, LUPU TS, et al. Akt1 is required for physiological cardiac growth[J]. Circulation, 2006, 113(17): 2097-2104.
[7] KIM J, WENDE A R, SENA S, et al. Insulin-like growth
factor I receptor signaling is required for exercise-induced cardiac hypertrophy[J]. Mol Endocrinol, 2008, 22(11): 2531-2543.
[8] CARE A, CATALUCCI D, FELICETTI F. MicroRNA-133 controls cardiac hypertrophy[J]. Nat Med, 2007, 13(5): 613-618.
[9] IKEDA S, HE A, KONG SW, et al. MicroRNA-1 negatively regulates expression of the hypertrophy-associated calmodulin and Mef2a genes[J]. Mol Cell Biol, 2009, 29(8): 2193-2204.
[10] 李俊平,马延超,张炜.一次力竭离心运动后大鼠骨骼肌HSP70的变化及针刺对其影响[J].北京体育大学学报, 2011,34(8):44-47.
(责任编辑、校对:孙海祥)
Effects of Exercise on the Expressions of miRNA-1 and Heat Shock Proteins in Mice
MA Zhi-yong, ZHAO Yong-cai
(Department of Physical Education, Tangshan Normal University, Tangshan 063000, China)
To discuss the effects of swimming training on the hearts of mice. Mice undertook a swimming protocol for 8 weeks, and cardiac structure were tested. miRNA-1, HSP60 and HSP 70 were detected by RT-PCR and Western blotting respectively. Results indicated cardiac hypertrophy had been induced, miRNA-1 decreased and HSP70 increased significantly, but HSP60 did not change. Cardiac adaptation and the changes of molecules can produce beneficial effects.
exercise; swimming; HSP70; miRNA; heart
G804.7
A
1009-9115(2015)02-0096-03
10.3969/j.issn.1009-9115.2015.02.028
河北省高等学校科学技术研究项目(Z2014121),唐山师范学院科学研究基金项目(2013D03)
2014-08-22
马志勇(1977-),男,河北唐山人,硕士,副教授,研究方向为运动健身与康复。

