血清m icroRNA⁃152和m icroRNA⁃602检测在肝癌诊断及手术疗效评估中的应用
周轶冰
(佳木斯市中心医院普外科,黑龙江佳木斯154002)
doi:10.3969/j.issn.1672-5565.2015.03.08
血清m icroRNA⁃152和m icroRNA⁃602检测在肝癌诊断及手术疗效评估中的应用
周轶冰
(佳木斯市中心医院普外科,黑龙江佳木斯154002)
为探讨microRNA⁃152和microRNA⁃602检测在肝癌诊断及手术疗效评估中的应用价值。采用实时荧光定量PCR检测佳木斯市中心医院2012年3月~2015年3月的19例肝癌血清标本中microRNA⁃152和microRNA⁃602的表达水平,分析microRNA⁃152和microRNA⁃602在乙型肝炎病毒(HBV)阳性组、HBV阴性组和健康对照组血清样本中的表达差异。结果发现HBV阳性血清样本中microRNA⁃152的表达水平(0.65±0.29)明显低于健康组(1.21±0.32),microRNA⁃602在HBV阳性血清样本中的表达(0.63±0.31)明显高于健康组(0.44±0.15),且水平表达的差异具有统计学意义(p<0.05)。可见血清样本中的microRNA⁃152和microRNA⁃602可以用于HBV阳性肝癌诊断的血清标记物,microRNA⁃152可以用于HBV阳性肝癌术后效果评价的血清标记物。
HBV;肝癌;MicroRNA⁃152;MicroRNA⁃602
肝癌是目前世界上最常见的恶性肿瘤之一,死亡率排第三位,多发于东南亚及非洲。在我国,肝癌引发的死亡率占第二位,我国每年肝癌新发病例占全世界的55%,寻找有效的肝癌诊断标记物,研究肝癌治疗手段及评估手术治疗效果至关重要。MicroRNA是一类小分子核糖核酸,长度大约20~25个核苷酸,一个microRNA可调节包括转录因子、细胞因子以及受体在内的成百上千个靶基因,这就使得microRNA可以对细胞从增殖到分化再到凋亡的整个生命周期进行有效的调控,还可以参与个体胚胎发育的生物学过程、机体代谢的生理过程以及肿瘤发生、发展的生命过程等[1-2]。
近年来有很多学者都致力于microRNA的研究,例如microRNA⁃18、microRNA⁃21、microRNA⁃221、microRNA⁃122、microRNA⁃125a、microRNA⁃150等均在肝癌组织和正常组织中的表达显示着明显的差异性。各种研究表明了microRNA不仅可以作为肝癌早期诊断标记物,还可以作为肝癌治疗效果评价的标记物。但是目前大多数的关于肝癌相关microRNA的研究都建立于肿瘤组织标本上,由于组织学肿瘤标记物存在标本采集受限、无法连续检测和随访跟踪不便等缺点,不便于在临床开展。
MicroRNA⁃152和microRNA⁃602被证明在HBV相关性肝癌组织中存在异常表达,而在肝癌患者血清中的表达尚未明确。本文主要探讨microRNA⁃152 和microRNA⁃602检测在肝癌诊断及手术疗效评估中的应用价值,采用实时荧光定量PCR检测佳木斯市中心医院2012年3月~2015年3月的19例肝癌血清标本中microRNA⁃152和microRNA⁃602的表达水平,分析microRNA⁃152和microRNA⁃602在HBV阳性组、HBV阴性组和健康对照组血清样本中的表达差异[3]。
1 材料与方法
1.1 统计资料来源
收集佳木斯市中心医院普外科2012年12月~2015年3月经病理切片证实为原发性肝癌且行手术切除的19例肝癌患者的血清标本作为实验组,其中HBV阳性11例,HBV阴性8例,男性12例,女性7例,年龄分布在56±4.6。HBV阳性实验组中ALT≤40U·L-1者4例,ALT>40U·L-1者7例;AFP<5μg·L-1者8例,AFP≥5μg·L-1者3例;肿瘤大小≥3cm者8例,肿瘤大小<3cm者3例;Ⅰ期2例,Ⅱ期5例,Ⅲ期4例。HBV阴性实验组中ALT≤40U·L-1者7例,ALT>40U·L-1者1例;AFP<5μg·L-1者4例,AFP≥5μg·L-1者4例;肿瘤大小≥3cm者5例,肿瘤大小<3cm者3例;Ⅰ期1例,Ⅱ期3例,Ⅲ期4例。收集15例正常血清样本作为健康对照组,男性8例,女性7例,年龄分布在55±9.2,ALT≤40U·L-1者14例,ALT>40U·L-1者1例;AFP<5μg·L-1者15例。各组别之间性别、年龄均无统计学差异(P>0.05)。经过对实验样本资料的统计发现,HBV⁃DNA定量、肿瘤大小以及肿瘤分期在HBV阳性肝癌患者和HBV阴性肝癌患者的样本中表达水平有显著差异,具有统计学意义(P<0.05)。
提取血清中的microRNA,采用荧光定量PCR各实验组血清样本中microRNA⁃152和microRNA⁃602的表达水平进行定量检测,分析 microRNA⁃152和microRNA⁃602在各实验组中的表达差异。
1.2 方法
首先用上海拜力生物科技有限公司生产的AM1560试剂盒提取并纯化总的microRNA。然后用特殊设计的颈环结构的反转录引物,通过RT⁃PCR技术将microRNA单链逆转录成为互补 DNA,即cDNA,再以此为模板通过PCR扩增系统进行DNA扩增。最后通过荧光探针法定量PCR技术检测样品中 microRNA⁃152和 microRNA⁃602的表达水平[4-6]。提取血清中microRNA的方法如下:
①抽取大约2mL外周血,放入EDTA管内,轻轻混匀,是血与管内抗凝物质充分接触,防止血细胞破裂。
②将盛有4mL全血的EDTA管放入4℃冰箱,在2h内分离血浆。
③离心10min,将上层液相小心吸出,避免吸取中间白色细胞层。
④将上层液相转入事先预冷的1.5mL离心管子,离心10min,以便进一步分离血浆和血细胞。
⑤将第三步离心以后得到的血浆,以500μL的体积分装,并转入-80℃冰箱长期保存。
⑥使用AM1560试剂盒提取microRNA,具体操作方法见说明书。
⑦使用紫外分光光度仪ZF型测定microRNA的浓度和纯度,具体操作方法见说明书[7-9]。
1.3 统计学处理
应用SPSS16.0统计软件进行统计学分析[10],实验组与对照组之间的年龄、AFP、HBV⁃DNA等定量临床参数采用非配对t检验来确定组间差异,使用均数x-±s表示,各实验组间microRNA⁃152和microRNA⁃602表达水平的差异显著性使用U检验,P<0.05认为差异有统计学意义,所有P均为双侧[11]。
2 结果分析
利用荧光定量PCR对健康对照组和HBV阳性肝癌患者术前、术后的血清样本进行microRNA⁃152 和microRNA⁃602的定量检测和分析,RT-PCR电泳图见图1和图2。
实验表明:(1)microRNA⁃152在HBV阳性肝癌患者术前实验组中的表达明显低于其在健康对照组中的表达(t=3.75,P=0.001),也明显低于术后实验组中的表达(t=3.92,P=0.003),且差异都具有统计学意义;(2)microRNA⁃602在HBV阳性肝癌患者术前实验组中的表达明显高于其在健康对照组中的表达(t=3.13,P=0.002),其术后实验组中的表达也要高于健康对照组中的表达(t=3.47,P=0.001),且差异具有统计学意义,具体数据见图3和图4。

图1 MicroRNA⁃152在HBV阳性肝癌实验组中的RT⁃PCR电泳图Fig1. MicroRNA⁃152 in HBV positive liver cancer rt⁃pcr electrophoresis figure in experimental group

图2 MicroRNA⁃602在HBV阳性肝癌实验组中的RT⁃PCR电泳图Fig2 MicroRNA⁃602 in HBV positive liver cancer rt⁃pcr electrophoresis figure in experimental group

图3 MicroRNA⁃152在HBV阳性肝癌各实验组中的表达情况Fig.3 MicroRNA⁃152 in HBV positive expression in the experimental group of liver cancer

图4 MicroRNA⁃602在HBV阳性肝癌各实验组中的表达情况Fig.4 MicroRNA⁃602 in HBV positive expression in the experimental group of liver cancer
利用实时荧光定量PCR对健康对照组和HBV阴性肝癌患者术前、术后的血清样本进行microRNA⁃152和 microRNA⁃602的定量检测和分析,RT⁃PCR电泳图见图5和图6。
实验表明:(1)MicroRNA⁃152在HBV阴性肝癌患者在术前实验组与健康对照组中的表达没有显著差异(t=2.03,P=0.07),术后实验组与健康对照组中的表达也没有显著差异(t=2.32,P=0.09),都不具有统计学意义;(2)MicroRNA⁃602在HBV阴性肝癌患者在术前实验组与健康对照组中的表达没有显著差异(t=2.18,P=0.12),术后实验组与健康对照组中的表达也没有显著差异(t=2.09,P=0.11),都不具有统计学意义,具体数据见图7和图8。
图5 MicroRNA⁃152在HBV阴性肝癌实验组中的RT⁃PCR电泳图Fig.5 MicroRNA⁃152 in HBV negative liver cancer rt⁃pcr electrophoresis figure in experimental group
图6 MicroRNA⁃152在HBV阴性肝癌实验组中的RT⁃PCR电泳图Fig.6 MicroRNA⁃602 in HBV negative liver cancer rt⁃pcr electrophoresis figure in experimental group
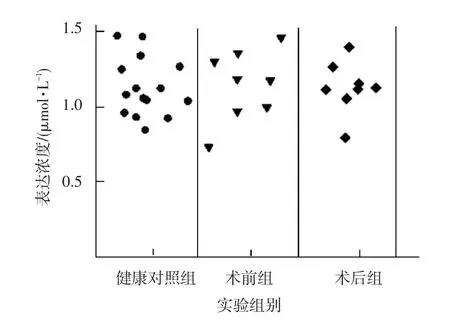
图7 MicroRNA⁃152在HBV阴性肝癌各实验组中的表达情况Fig.7 MicroRNA⁃152 in HBV negative expression in the experimental group of liver cancer
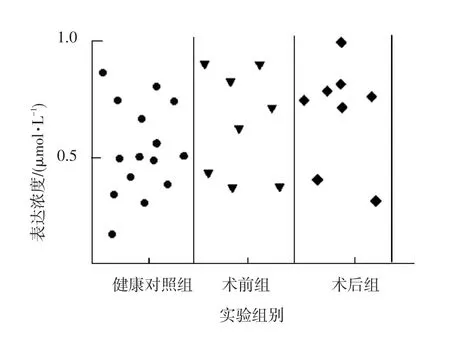
图8 MicroRNA⁃602在HBV阴性肝癌各实验组中的表达情况Fig.8 MicroRNA⁃602 in HBV negative expression in the experimental group of liver cancer
3 讨 论
研究发现,HBV阳性肝癌患者手术前血清样本中microRNA⁃152的表达水平显著低于健康对照组和手术后血清样本中的表达水平,但microRNA⁃152 在HBV阴性肝癌患者术前、术后以及健康对照组的血清样本中没有显著性差异,已有研究表明microRNA主要来源于细胞分泌,而HBV感染会导致肝细胞中microRNA⁃152的表达水平明显下调,所以HBV阳性肝癌患者血清中microRNA⁃152表达水平显著降低的主要原因在于HBV感染后抑制了肝细胞中microRNA⁃152的表达水平,从而抑制了细胞的主动分泌功能,导致肝癌血清中microRNA⁃152的表达水平下调。另外,本研究还发现,microRNA⁃152在肝癌患者术后血清样本中的表达水平显著高于术前血清样本中的表达水平,这主要因为,实验所选的术后血清样本都在手术后2日内完成,手术对肝细胞造成的损伤还没有恢复,可能导致肝细胞中microRNA⁃152漏入血液中,从而导致了术后血清样本中microRNA⁃152的表达水平显著升高。由于实验条件有限,无法进行大样本量的实验,为了能够更加深入的研究microRNA⁃152的机制,还需要长期跟踪随访,进行大样本量的长期研究。
该研究还表明,microRNA⁃602在HBV阳性肝癌患者术前和术后血清样本中的表达水平都显著高于健康对照组血清样本中的表达水平,具有统计学意义(p<0.05),但microRNA⁃602在术前与术后血清样本中的表达无显著性差异。我们还发现microRNA⁃602在血清样本中的表达水平在早期已经出现升高,有可能是由于microRNA⁃602在损伤早期,尚未有形态学上的变化之前,已经通过某种机制由肝细胞转移到血液循环。已有报道发现[12-15],microRNA⁃602在肝癌组织中的表达水平显著高于癌旁正常组织中的表达水平,虽然研究的样本类型不同,但是研究结果都指示了microRNA⁃602可能成为一种新的用于HBV阳性肝癌早期诊断的血清标记物,而microRNA⁃602在两种不同样本中表达之间的联系还有待我们进一步的研究。
综上所述,该研究发现在 HBV阳性肝癌患者术前血清样本中microRNA⁃152和microRNA⁃602存在表达异常的现象,在HBV阳性肝癌患者术前和术后血清样本中microRNA⁃152的表达也有显著性的差异,这些研究表明了microRNA⁃152和microRNA⁃602可以用于HBV阳性肝癌早期诊断的血清标记物,而且microRNA⁃152也有成为一种重要的HBV阳性肝癌手术治疗效果的评价指标,但是microRNA⁃152和microRNA⁃602在肝脏细胞中并不具有特异性,它们能否如该研究预期的一样,成为HBV阳性肝癌早期诊断的血清标记物还有待更进一步的证实,尤其microRNA⁃152在术前和术后血清样本中差异表达的确切机制更加需要大量样本的研究。
[1] HU X,LI L,SHANG M,et al.Association between microRNA genetic variants and susceptibility to colorectal cancer in Chinese population[J].Tumor Biology,2014,8 (3):378-183.
[2] DIKEAKOSP,THEODOROPOULOSG,RIZOS S,et al. Association of the miR⁃146a,miR⁃149,and miR⁃196a polymorphisms with gastric cancer risk and survival in the Greek population[J].Molecular Biology Reports,2014,16(2):145-148.
[3] MING R,WANG X,TONG J,et al.A single nucleotide polymorphism in microRNA⁃146a is associated with the risk for nasopharyngeal carcinoma[J].Mol.Carcinog,2013,46(S1):122-125.
[4] 黄琼华,黄天壬,利基林,等.广西壮族人群microRNA⁃146a基因多态性与肝癌遗传易感性的相关性研究[J].中国癌症防治杂志,2013,7(02):98-102. HUANG Qionghua,HUANG Tianren,LI Jilin,et al.Guan⁃gxi zhuang people mirna⁃146⁃a gene polymorphism and genetic susceptibility to cancer of the liver of the correla⁃tion research[J].Chinese Journal of Cancer Prevention and Control,2013,7(02):98-102.
[5] 徐国斌,易广新,熊斌,等.原发性肝癌术后早期肝内复发转移36例的介入治疗[J].介入放射学杂志,2013,6(04):76-79. XU Guobin,YIGuangxin,XIONG Bin,et al.Transfer of 36 cases of primary liver cancer early postoperative intra⁃hepatic recurrence of interventional therapy[J].Interven⁃tional Radiology Journal,2013,6(04):76-79.
[6] ZHANG F,FAN N,MU J,et al.Exportin 4 gene expres⁃sion and DNA promotermethylation status in chronic hep⁃atitis B virus infection[J].JViral Hepat,2014,7(4):333-338.
[7] SONIA A,MELO M.Disruption of microRNA nuclear transport in human cancer[J].Seminars in Cancer Biolo⁃gy,2014,14(1):342-346.
[8] 范丽丽,于湘友.乌司他丁对体外循环患者细胞黏附分子浓度影响及对肺损伤保护作用[J].中华实用诊断与治疗杂志,2012,44(26):57-60. FAN Lili,YU Xiangyou.Ulinastatin on the cell adhesion molecule concentration of patientswith extracorporeal cir⁃culation and the protection of lung injury[J].The Diagno⁃sis and Treatment of Practical Magazine,2012,44(26):57-60.
[9] 徐杰,宋樱花,马明远,等.乌司他丁对重度脓毒症患者心功能的影响[J].中华全科医学,2012,11(10):33-36. XU Jie,SONG Yinghua,MA Mingyuan,et al.Ulinastatin the influence of cardiac function in patients with severe sepsis[J].The Chinese General Medicine,2012,11 (10):33-36
[10]QU Ke.Circulating microRNA as biomarkers for hepato⁃cellular carcinoma[J].Clin Gastroenterol,2011,45(4):355-360.
[11]LIJi.Expression of serum miR⁃221 in human hepatocel⁃lular carcinoma and its prognostic significance[J].Bio⁃chem Biophys Res Commun,2011,406(1):70-73.
[12]邓志华,黄赞松.microRNA与消化系统肿瘤[J].生物医学工程与临床,2011,11(05):135-138.DENG Zhihua,HUANG Zangsong.Micrornas and diges⁃tive system tumors[J].Biomedical Engineering and Clini⁃cal,2011,11(05):135-138.
[13]孙铁为,陈晓宁,刘军,等.胃癌中微小RNA表达谱及miR⁃429表达水平的研究[J].中华实验外科杂志,2012,29(3):385-387. SUN Yiwei,CHEN Xiaoning,LIU Jun,et al.Small RNA expression in gastric cancer spectrum and miR⁃429 ex⁃pression levelof the research[J].The Experimental Surgi⁃cal Magazine,2012,29(3):385-387.
[14]居峰,左君波,朱阿考,等.胃癌组织中miR⁃148a基因甲基化状态与DNA甲基化转移酶的关系[J].中华实用诊断与治疗杂志,2013,27(4):361-363. JU Feng,ZUO Junbo,ZHU Akao,et al.Gastric cancer tis⁃sue ofmiR⁃148⁃a genemethylation status and the relation⁃ship between DNA methylation transferase[J].The Diag⁃nosis and Treatment of Practical Magazine,2013,27(4):361-363.
[15]聂宇,张洋,韩变梅,等.常规TRIzol法提取血清mi⁃
croRAN的改良[J].中华实用诊断与治疗杂志,2011,25(5):427-428.
NIE Yu,ZHANG Yang,HAN Bianmei,et al.Conventional TRIzolmethod to extract serum microRAN improvement [J].The Diagnosis and Treatment of Practical Magazine,2011,25(5):427-428.
Study on the expression and diagnostic significance ofm icroRNA⁃152 and microRNA⁃602 in hepatocellular carcinoma
ZHOU Yibing
(Jiamusi Center Hospital General Surgery,Heilongjiang Jiamusi 154002,China)
To explore the application value ofmicroRNA⁃152 and microRNA⁃602in the diagnosis of liver cancer and evaluation of therapeutic effects.The serum microRNA was extracted,and the levels of circulatingmicroRNA⁃152 and microRNA⁃602 were quantified by real⁃time quantitative RT⁃PCR.Expression differences ofmicroRNA⁃152 and microRNA⁃602 were analyzed in every experimental groups.Results show the expression level of the HBV positive hepatocellular carcinomamicroRNA⁃152 was significantly lower than that in the healthy group(p<0.05),while the expression level of microRNA⁃602 was higher than that in the healthy group(p<0.05).It is speculated that microRNA⁃152 and microRNA⁃602may be employed as novel serum markers for the diagnosis of HBV⁃positive liver cancer and microRNA⁃152 may be employed as novel serum markers for the evaluation of therapeutic effect.
Hepatitis B Virus;Hepatocellular Carcinoma;MicroRNA⁃152;MicroRNA⁃602
A
1672-5565(2015)03-192-06
2015-05-12;
2015-07-14.
周轶冰,男,主治医师,研究方向:肿瘤的血清标记物;E⁃mail:ttabb1021@163.com.

