硫化氢对糖尿病大鼠心肌纤维化和MMP-2/TIMP-2表达的影响*
李 芳,吴志雄,罗 健,肖 婷,曾 欧,张晶晶,杨 军
(南华大学附属第一医院心血管内科,湖南衡阳 421001)
论著·基础研究
硫化氢对糖尿病大鼠心肌纤维化和MMP-2/TIMP-2表达的影响*
李 芳,吴志雄,罗 健,肖 婷,曾 欧,张晶晶,杨 军△
(南华大学附属第一医院心血管内科,湖南衡阳 421001)
目的 观察硫化氢(H2S)对糖尿病大鼠心肌纤维化和基质金属蛋白酶-2(MMP-2)/基质金属蛋白酶抑制剂-2(TIMP-2)表达的影响。方法将40只SD成年雄性大鼠随机分为4组(每组10只):正常对照组(Control组)、糖尿病模型组(STZ组)、硫化氢处理糖尿病组(STZ+H2S组)、硫化氢处理正常组(H2S组)。以链脲佐菌素(STZ)腹腔注射诱导糖尿病大鼠模型;苏木素-伊红(HE)染色观察心肌纤维病理形态学变化;Western blotting检测大鼠心肌组织Ⅲ型胶原、MMP-2和TIMP-2的表达水平。结果与对照组相比,STZ组心肌细胞排列紊乱,Ⅲ型胶原及TIMP-2表达水平显著升高(P<0.05),而MMP-2表达明显降低(P<0.05),MMP-2/TIMP-2的比值下降;与STZ组相比,STZ+H2S组TIMP-2及Ⅲ型胶原表达明显下调(P<0.05),MMP-2表达明显升高(P<0.05),MMP-2/TIMP-2的比值明显增加。结论硫化氢可改善糖尿病大鼠的心肌纤维化程度,其机制可能与其上调MMP-2表达、下调TIMP-2表达有关。
硫化氢;基质金属蛋白酶2;糖尿病;心肌纤维化
随着糖尿病发病率的逐年上升,其并发症也日益受到重视。在其诸多慢性并发症中,糖尿病心肌病(diabetic cardiomyopathy,DCM)的危害性最大,其以心肌肥厚及心肌纤维化为主要病理改变特征。糖尿病心肌纤维化发病机制较为复杂,目前已发现与基质金属蛋白酶-2(MMP-2)/基质金属蛋白酶抑制剂-2(TIMP-2)的调控紊乱有关[1-6]。
已知硫化氢(H2S)作为气体信号分子,在心血管等多系统疾病中具有生物学效应[7-8]。但硫化氢与糖尿病心肌纤维化的发生、发展的关系及其可能调控机制,目前尚不十分清楚。
本实验以腹腔注射链脲佐菌素(streptozocin,STZ)诱导糖尿病大鼠模型,观察硫化氢对糖尿病大鼠心肌组织中MMP-2/TIMP-2的表达及心肌纤维化的影响,以探讨硫化氢对糖尿病心肌纤维化的影响及可能机制。
1 材料与方法
1.1 实验动物 40只8周SD大鼠,由南华大学动物实验中心提供。大鼠在清洁级实验室中分笼饲养,人工照明,12 h昼夜交替1次,大鼠均自由饮水、进食。
1.2 药物及试剂 兔源MMP-2、TIMP-2、Ⅲ型胶原一抗等购自中国博士德公司;抗兔二抗购于美国Proteintech公司;STZ购于美国MP生物公司;BCA蛋白定量试剂盒、细胞裂解液均购于碧云天公司;硫氢化钠(H2S供体)购自美国Sigma公司。
1.3 模型建立及分组 将40只大鼠随机均分为4组(每组10只),即正常对照组(Control组)、糖尿病组(STZ组)、硫化氢处理糖尿病组(STZ+H2S组)、硫化氢处理正常组(H2S组)。STZ组和STZ+H2S组大鼠按同等剂量(40 mg/kg)单次腹腔注射STZ,72 h后测血糖(尾静脉采血),若血糖浓度大于16.7 mmol/L则造模成功。建模成功后STZ+H2S组及H2S组大鼠每天腹腔注射NaHS溶液( 100 μmol/kg,以PBS为溶剂);Control组和STZ组每天腹腔注射等量的生理盐水,实验持续8周。
1.4 苏木素-伊红(HE)染色 为观察各组心肌纤维病理形态学变化,分别取4组大鼠左心室心肌组织,多聚甲醛固定24 h,石蜡包埋、切片后,HE染色观察。
1.5 Western blotting法 为检测各组大鼠心肌组织中Ⅲ型胶原的表达,分别取4组大鼠新鲜左心室心肌组织,提取蛋白后以SDS-聚丙烯酰胺凝胶电泳、湿转法将其转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜。用TBST配制的5%BSA封闭2 h后,Ⅲ型胶原一抗(稀释度为1∶400)和GAPDH一抗(稀释度为1∶8 000)孵育1 h后4 ℃过夜,洗膜后用HRP标记的二抗(1∶4 000)孵育1 h,洗膜后以ECL显色,曝光后扫描,用Image J图像分析软件进行光密度分析。GAPDH为内参。
1.6 Western blotting检测心肌MMP-2和TIMP-2的表达 取4组左心室心肌组织,SDS-聚丙烯酰胺凝胶电泳后,湿转法蛋白转膜,室温封闭2 h后以MMP-2和TIMP-2(稀释度均为1∶400)及GAPDH一抗(稀释度为1∶8 000)4 ℃孵育过夜,二抗室温孵1 h。洗涤和显影后行灰度扫描。同时测定MMP-2/ TIMP-2比值。
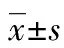
2 结 果
2.1 各组大鼠心肌组织超微结构 HE染色:对照组心肌细胞排列致密整齐,细胞间隙正常,心肌细胞间少有胶原纤维;STZ组心肌细胞排列松散紊乱,细胞间隙增宽,心肌细胞间可见呈堆积状分布的胶原纤维,间质可见纤维化,可见散在淋巴细胞及单核细胞浸润;STZ+H2S组心肌重构有明显改善,心肌细胞排列趋于整齐,结构清晰,大部分心肌纤维呈平行排列,间质有少量疏松结缔组织,散在淋巴细胞和单核细胞浸润,且胶原纤维成分较STZ组明显减少。H2S组大鼠心肌组织结构和纤维排列与对照组类似,见图1。
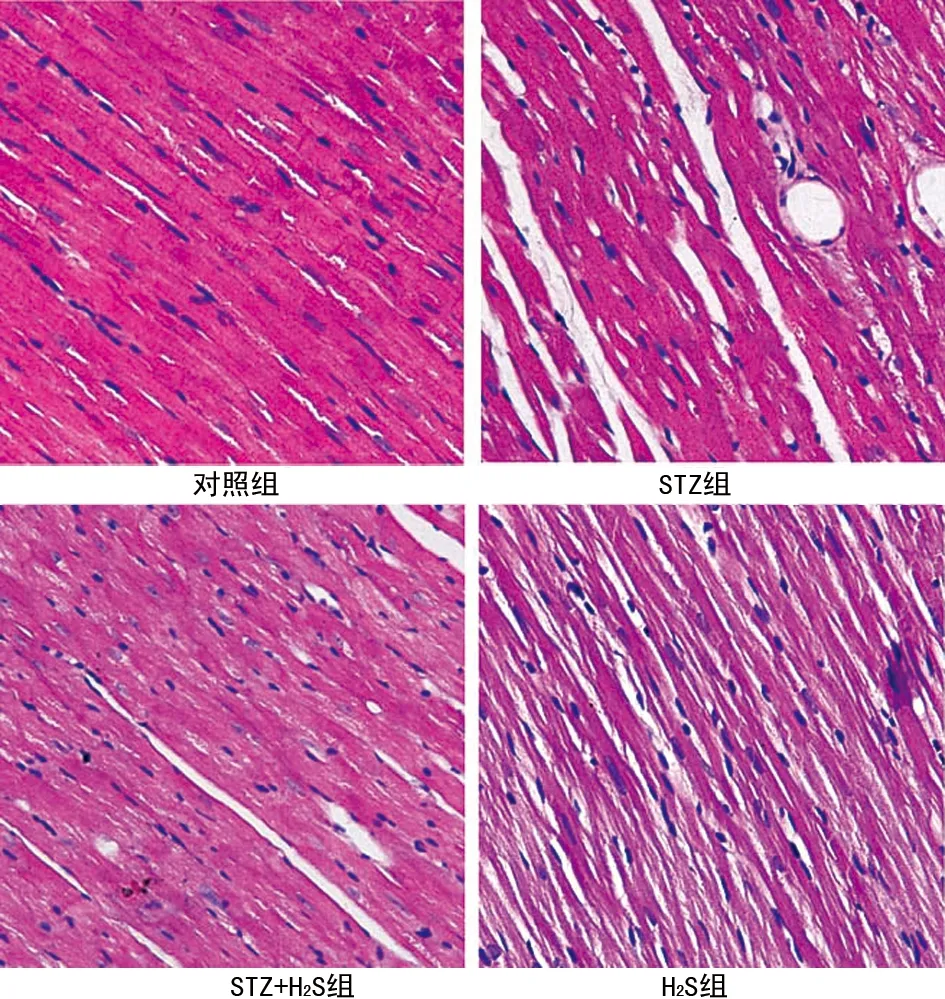
图1 各组大鼠心肌组织HE染色(×200)
2.2 各组大鼠心肌组织Ⅲ型胶原的表含量 Western blotting发现:与对照组相比,STZ组心肌组织中Ⅲ型胶原含量明显上调(P<0.05);与STZ组比较,STZ+H2S组心肌Ⅲ型胶原含量明显减少(P<0.05);H2S组与对照组相比,心肌组织Ⅲ型胶原含量无明显改变(P>0.05),见图2。
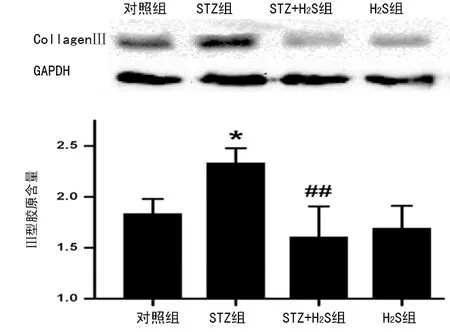
*:P<0.05,与对照组比较;#:P<0.05,与STZ组比较。
图2 各组大鼠心肌组织Ⅲ型胶原的表达
2.3 各组大鼠心肌组织MMP-2和TIMP-2的表达 Western blotting发现:与对照组相比,STZ组心肌组织中MMP-2蛋白表达水平下调(P<0.05),TIMP-2蛋白表达水平明显上调(P<0.05),MMP-2/TIMP-2二者比值减小;与STZ组相比,STZ+H2S组心肌组织中MMP-2水平显著升高(P<0.05),TIMP-2表达水平明显下降(P<0.05),MMP-2/TIMP-2二者比值增大;H2S组与对照组相比,心肌组织中MMP2和TIMP的表达水平差异无统计学意义(P>0.05),见图3。
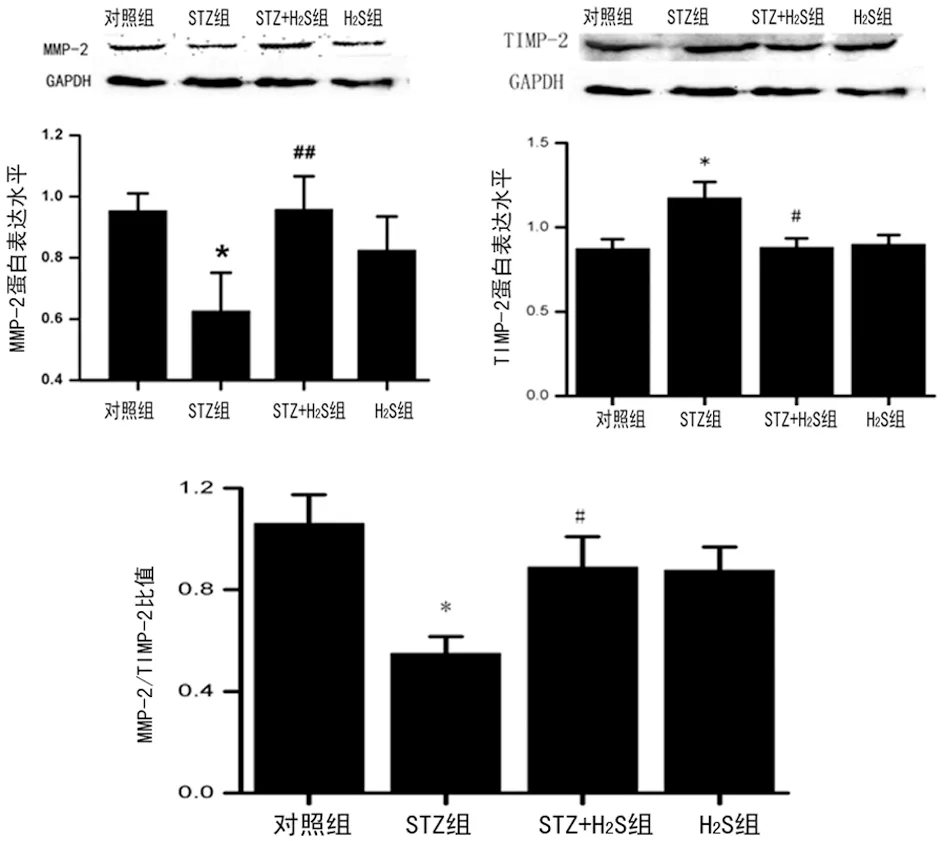
*:P<0.05,与对照组比较;#:P<0.05,与STZ组比较。
图3 各组大鼠心肌组织MMP-2和TIMP-2的表达水平
3 讨 论
DCM是糖尿病的重要慢性并发症,其主要病理改变是细胞外基质堆积、心肌肥厚及心肌间质纤维化[9]。其中,心肌间质纤维化是DCM心肌重构的主要标志,其通过降低心脏顺应性而导致心脏收缩及舒张功能障碍。糖尿病心肌间质纤维化的发病机制较为复杂,具体机制仍不很清楚,但有研究发现其发生、发展与MMPs/TIMPs的调控紊乱有关[1]。
基质金属蛋白酶家族(MMPs)是一大类锌依赖性内肽酶家族,在结构上具有很大同源性,并能有效降解心肌细胞外基质,MMPs家族中MMP-2在心肌组织中表达水平较高,是心肌内抗纤维化的重要成分[10]。基质金属蛋白酶抑制剂(TIMPs)能通过N-末端功能区的半胱氨酸残基与MMPs催化活性中心的锌离子结合,封闭其催化活性,使有活性的MMPs失活,或避免无活性的MMPs激活[11]。在TIMPs家族中,TIMP-2对MMPs的抑制作用最强。MMP-2的天然抑制物TIMP-2也存在于心肌组织中,并可通过与相应的MMP-2结合从而影响其活性,MMP-2/TIMP-2的平衡对维持心肌正常的胶原代谢具有重要意义[4-6]。已有研究发现,MMP-2表达水平的降低及TIMP-2表达水平的升高参与了糖尿病大鼠心肌纤维化的进程[1,3,12-13]。本研究发现,与正常大鼠比较,糖尿病大鼠心`肌组织中Ⅲ型胶原降解减少,出现胶原沉积,且间质纤维化程度高,此结果表明,糖尿病大鼠存在明显的心肌重构和心肌纤维化;而MMP-2表达水平显著降低,TIMP-2表达水平显著升高,MMP-2/TIMP-2 的比值明显下降,提示MMP-2/TIMP-2的失衡参与糖尿病心肌纤维化的过程。
H2S是继一氧化氮和一氧化碳之后的又一新型内源性气体信号分子[7]。有研究表明,内源性H2S在心血管系统疾病具有多种生物学效应,包括舒张血管平滑肌、降低血压、抑制心肌细胞凋亡、抑制血管平滑肌细胞增殖等[7]。本实验表明,糖尿病大鼠存在明显的心肌重构和广泛的心肌细胞纤维化,而经过硫化氢处理后,糖尿病大鼠心肌纤维化程度明显减轻,且Ⅲ型胶原表达明显减少,提示硫化氢作为内源性气体信号分子可能通过分子机制参与糖尿病心肌病的发生及发展过程,而硫化氢的干预可减轻糖尿病大鼠的心肌纤维化,进而延缓或阻止糖尿病心肌病的发生、发展,改善糖尿病并发症的预后。实验同时发现,硫化氢干预后糖尿病大鼠心肌组织MMP-2表达上调,TIMP-2表达出现下调,而MMP-2/TIMP-2的比值明显增加;且Ⅲ型胶原表达、间质纤维化程度均较STZ组明显下降,与STZ+H2S组MMP-2/TIMP-2比值的升高变化相一致,这些结果均表明硫化氢改善糖尿病心肌纤维化的作用机理可能是通过上调MMP-2,下调TIMP-2的表达,增加MMP-2/TIMP-2的比值实现的。但其中的具体调控机制仍有待进一步的研究。
[1]王岩,郭永川,梁前垒,等.参麦注射液对糖尿病心肌病大鼠心肌纤维化的干预作用及相关机制探讨[J].中国病理生理杂志,2014,30(3):449-453.
[2]李袁静,刘柳,汪道文,等.四氢生物蝶呤对糖尿病小鼠心肌损伤的保护作用[J].重庆医科大学学报,2012,37(6):498-501.
[3]Li CJ,Lv L,Li H,et al.Cardiac fibrosis and dysfunction in experimental diabetic cardiomyopathy are ameliorated by alpha-lipoic acid[J].Cardiovasc Diabetol,2012,11(1):73-78.
[4]Kugler A.Matrix metalloproteinases and their inhibitors[J].Anticancer Res,1999,19(2C):1589-1592.
[5]Kukacka J,Prusa R,Kotaska K,et al.Matrix metalloproteinases and their function in myocardium[J].Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2005,149(2):225-236.
[6]Polyakova V,Loeffler I,Hein S,et al.Fibrosis in endstage human heart failure:severe changes in collagen metabolism and MMP/TIMP profiles[J].Int J Cardiol,2011,151(1):18-33.
[7]李钢,杨双强.硫化氢对大鼠MIRI心肌细胞凋亡的影响及机制研究[J].重庆医科大学学报,2011,36(8):932-936.
[8]徐文明,郭润民,陈景福,等.硫化氢通过调控NF-κB通路抑制阿霉素引起的心肌细胞炎症与细胞毒性[J].中国病理生理杂志,2013,29(9):1561-1566.
[9]Trachanas K,Sideris S,Aggeli C,et al.Diabetic cardiomyopathy:from pathophysiology to treatment[J].Hellenic J Cardiol,2014,55(5):411-421.
[10]Peng J,Li X,Feng Q,et al.Anti-fibrotic effect of cordyceps sinensis polysaccharide:Inhibiting HSC activation,TGF-β1/Smad signalling,MMPs and TIMPs[J].Exp Biol Med(Maywood),2013,238(6):668-677.
[11]Fan D,Takawale A,Basu R,et al.Differential role of TIMP2 and TIMP3 in cardiac hypertrophy,fibrosis,and diastolic dysfunction[J].Cardiovasc Res,2014,103(2):268-280.
[12]Hou J,Zheng D,Zhong G,et al.Mangiferin mitigates diabetic cardiomyopathy in streptozotocin-diabetic rats[J].Can J Physiol Pharmacol,2013,91(9):759-763.
[13]焦岩.益气活血复方对慢性心衰大鼠MMP-2、TIMP-2水平影响的实验研究[D].沈阳:辽宁中医药大学,2013.
Effects of hydrogen sulfide on myocardial fibrosis and the expression of MMP-2/TIMP-2 in diabetic rats*
LiFang,WuZhixiong,LuoJian,XiaoTing,ZengOu,ZhangJingjing,YangJun△
(DepartmentofCardiology,theFirstAffiliatedHospitalofSouthChinaUniversity,Hengyang,Hunan421001,China)
Objective To explore the effects of hydrogen sulfide(H2S) on the expression of MMP-2,TIMP-2 and myocardial fibrosis in diabetic rats.MethodsTotally 40 SD rats were randomly divided into four groups(n=10):control group,diabetes group(STZ group),hydrogen sulfide treatment group (STZ+H2S group) and normal rats treating with hydrogen sulfide group(H2S group).Diabetes was induced in rats by intraperitoneal injection of streptozotocin(STZ).The pathological morphological changes in myocardial fiber were analyzed by HE staining.The expression levels of matrix metalloproteinase 2(MMP-2),tissue inhibitor of metalloproteinase 2(TIMP-2) and collagen Ⅲ were analyzed by Western blotting.ResultsCompared with control group,collagen accumulation and cardiac fibrosis were observed in diabetic rats′ myocardium,the expression levels of collagen Ⅲ and TIMP-2 significantly increased(P<0.05),while the level of MMP-2 decreased(P<0.05),and the ratio of MMP-2 over TIMP-2 decreased in STZ group.Compared with STZ group,TIMP-2 and collagen Ⅲ significantly decreased in STZ+H2S group(P<0.05),the expression of MMP-2 significantly increased (P<0.05),the ratio of MMP-2/TIMP-2 significantly increased.ConclusionH2S could attenuate myocardial fibrosis in diabetic rats,and its mechanism might be related with down-regulation of TIMP-2 and up-regulation of MMP-2.
hydrogen sulfide;matrix metalloproteinase 2;diabetes mellitus;myocardial fibrosis
10.3969/j.issn.1671-8348.2015.34.005
国家自然科学基金资助项目(81270181);国家自然科学基金资助项目(81202830)。
:李芳(1988-),在读硕士,主要从事心肌病方向的研究。△
,Tel:18007340658;E-mail:yangjunincn@163.com。
R543
A
1671-8348(2015)34-4765-03
2015-05-11
2015-07-10)

