CCL18在乳腺癌的表达及与患者预后的关系
叶熹罡 潘凌霄 陈 伦 郑文博
(广州医科大学附属第一医院乳腺外科,广东广州510120)
随着乳腺癌综合治疗的进步,乳腺癌患者的死亡率逐步下降,总的预后得到较大的改善。但是,肿瘤的转移复发是导致乳腺癌失败的重要原因。肿瘤细胞在机体内所处的微环境为肿瘤的发生、发展、侵袭、转移等提供了必要的物质基础[1-2]。肿瘤微环境中的多种细胞通过分泌趋化因子,来影响肿瘤细胞的生物学特性。因此,有关各种肿瘤相关趋化因子及其受体的结构和生物学功能一直是肿瘤研究领域的热点。
趋化因子是由白细胞或组织细胞组成性或诱导性表达的分泌型蛋白,以自分泌或旁分泌形式发挥作用。在肿瘤微环境中,通过改变肿瘤细胞生物学行为和激活基质干细胞(如血管内皮细胞、肿瘤相关巨噬和成纤维细胞),促进肿瘤的生长和转移[3-5]。趋化因子配体 18(chemokine CC-motif ligand 18,CCL18)属CC族趋化因子,主要由树突状细胞及巨噬细胞分泌。已有研究证实CCL18是儿童成淋巴细胞白血病的一个预测指标,在其血清中,CCL18的表达显著升高[6]。在乳腺癌组织中,肿瘤相关巨噬细胞亚群能分泌CCL18。但CCL18与乳腺癌的生物学关系尚不明确。本研究通过检测人乳腺癌中CCL18的表达情况,分析其与患者临床病理特征以及预后的关系,进一步阐明CCL18在乳腺癌发生发展中的作用,为乳腺癌的临床诊断与分子治疗提供更多科学合理的依据。
1 资料和方法
1.1 研究对象
依据随机原则,收集2006年1月至2010年7月期间在广州医科大学附属第一医院乳腺外科接受手术治疗的乳腺癌患者94例(均为女性)。术前均未行放、化疗或内分泌治疗。年龄介于23~81岁,中位年龄52岁。其中,发生肺、骨、肝等远处转移15例。组织病理类型判断参照2003版WHO乳腺肿瘤的病理学分类标准。其他临床病理资料,见表1。每例标本留取肿瘤组织10%甲醛固定,石蜡包埋,待行常规病理诊断及免疫组化。本试验所有入选乳腺癌组织标本的收集均征得患者同意,并签署知情同意书。全部患者有完整的临床病历资料和随访资料。全部患者的随访截止日期为2013年5月31日。
1.2 仪器
精密轮转石蜡切片机(HM325型,德国MICROM Gmbh公司),病理组织漂烘处理仪(ZMN-6802,常州市华利电子公司),冰箱(BCD.257F,Haier,中国),恒温箱(DK.8D型上海,中国),正立带照相系统显微镜(BX60,日本奥林巴斯公司),摇床(常州澳华仪器有限公司),微波炉(格兰仕,中国)。
1.3 试剂
免疫组化试剂盒EnVisionTMDetection kit(DAKO公司,美国),CCL18抗体为兔抗人多抗,(Abcam公司,美国),异丙醇、无水乙醇、二甲苯、山羊血清和苏木素均购于广州威佳公司。
1.4 实验方法
将4μm组织切片脱蜡,水化后置于蒸馏水;高温高压修复;3%H2O2室温浸泡10 min;PBS漂洗3次,每次5 min;每张切片各滴加封闭用10%正常山羊血清,室温下孵育30 min,甩去血清;每张切片滴加一抗(鼠抗人CCL18),平放于湿盒内,4℃孵育过夜;室温下复温30 min,PBS漂洗三次,每次5 min;滴加二抗,37℃孵育30 min;PBS洗涤,5 min×3次;滴加菌素亲生物蛋白—过氧化酶,37℃孵育15 min;PBS洗涤,5 min×3次;0.05%DAB 显色 5~10 min,在镜下观察显色情况,显色充分后终止着色;苏木素复染;水洗返蓝;梯度酒精至无水酒精脱水,二甲苯透明;中性树胶封片。显微镜下观察并摄像。
1.5 结果判断
CCL18判定标准:显微镜下读片,以棕黄色胞浆染色细胞为阳性反应。取任意5个高倍镜视野,以阳性细胞所占细胞总数的平均值作为CCL18阳性率:阳性细胞数<10%为阴性(-),≥10%为阳性(+)。均由两位病理科医师独立阅片,当结果不同时,取平均值为最终结果。
1.6 统计学处理
采用SPSS 17.0统计软件进行分析,应用卡方检验分析CCL18表达水平与乳腺癌临床病理特征的关系。关于预后的判断采用Kaplan-Meier生存分析和 log-rank 检验,检验水准 α 取 0.05,P<0.05 表示差异有统计学意义。
2 结果
2.1 CCL18在乳腺癌组织中的表达水平比较
使用免疫组化对94例乳腺癌患者组织检测CCL18的表达情况。在15例发生远处转移的患者中,10例患者(66.67%)为CCL18阳性。在79例未发生远处转移的患者中,29例患者(36.7%)为CCL18阳性。通过卡方检验得出两组的差异有统计学意义(P<0.035)。
2.2 乳腺癌组织CCL18水平与临床病理特征的关系
以CCL18阳性细胞所占细胞总数的平均值为界,将94例病例分为CCL18低表达组和CCL18高表达组。结果表明,CCL18的表达与肿瘤组织学分级、肿瘤大小、淋巴结转移情况和远处转有关(P<0.05),而与年龄、月经状态、激素受体等无关(P>0.05),见表 1。
2.3 CCL18表达量与乳腺癌患者预后的关系
Kaplan-Meier生存分析表明,CCL18低表达组的无病生存率(disease free survival,DFS)和总生存率(overall survival,OS)高于CCL18高表达组 (P<0.01),见图1。高表达CCL18患者的平均DFS和OS分别只有52.6个月(HR:3.719,95%置信区间,45.35-59.96)和 53.4个月(HR:3.240,95%置信区间,47.05-59.75),而低表达 CCL18患者的平均DFS和OS则分别有73.3个月(HR:0.95,95% 置信区间,71.44-75.16)和 82.9 个月(HR:1.701,95%置信区间,79.60 -86.27)。
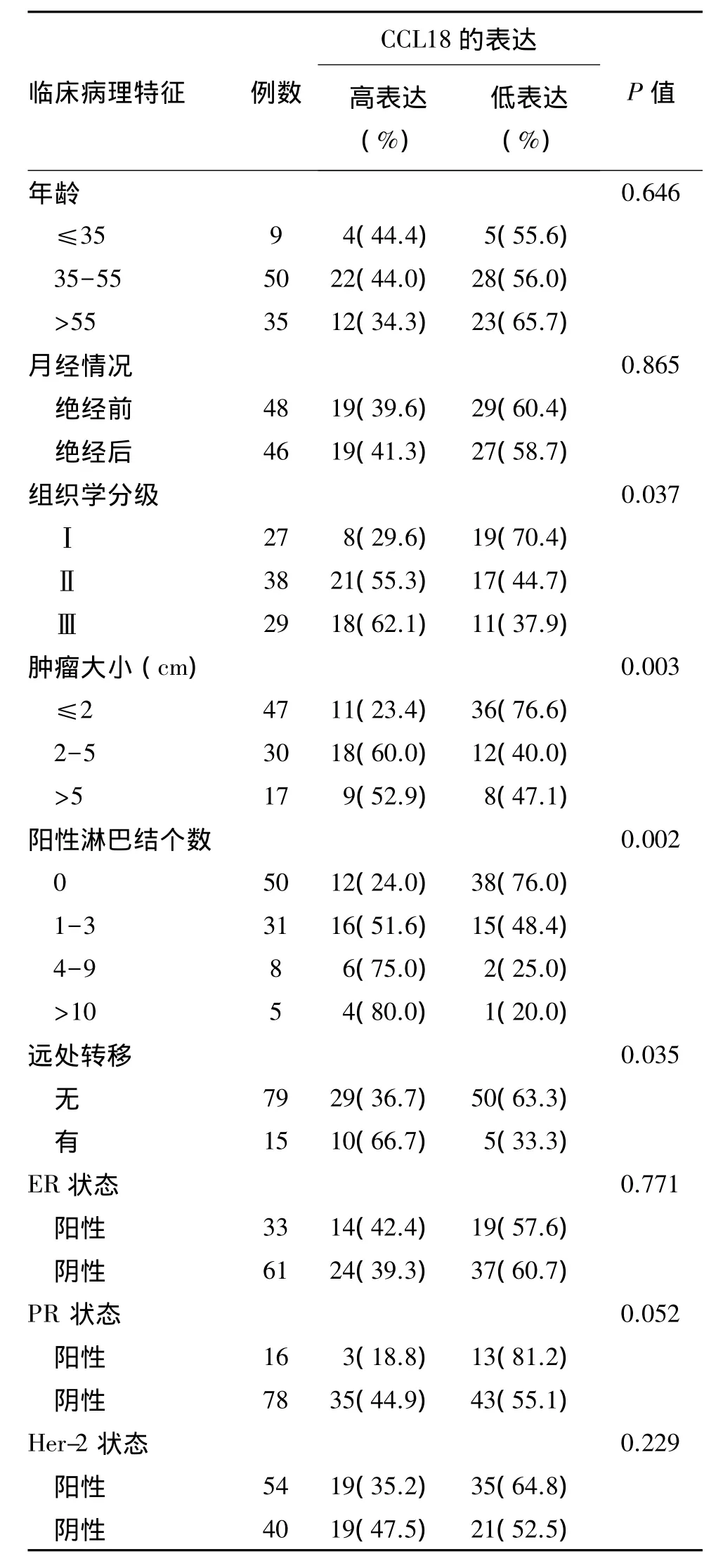
表1 乳腺癌中CCL18的表达及其与临床病例特征的相关性
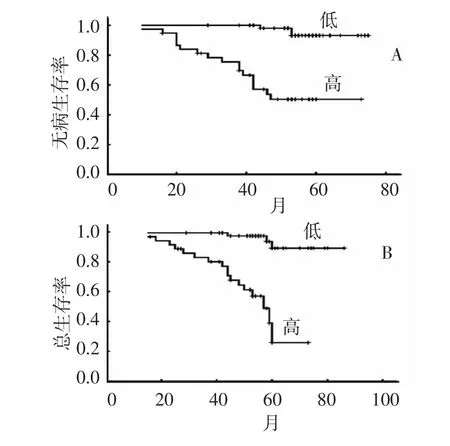
图1 CCL18高表达和低表达患者的Kaplan-Meier生存曲线
3 讨论
炎症趋化因子是由白细胞或组织细胞分泌的一类具有趋化作用的小分子蛋白质,分子量约8~10 kD左右。根据其分子N端的半胱氨酸结构,可以将炎症趋化因子分为CC、CXC、C、CX3C共4个亚组,其蛋白质水平近20%~50%同源。炎症趋化因子通过G蛋白耦联的受体激活白细胞,介导生物学活性[3,5]。炎症趋化因子在生理状态及免疫病理状态下对白细胞的迁移、成熟以及淋巴细胞的迁移和分化发育起着非常关键的作用。在肿瘤的生长和血管生成也起着重要的作用[7-8]。人黑色素瘤细胞系组成性表达 CXCL1(生长相关癌基因,GRO-α),CXCL8(IL-8)和CCL5(RANTES)。黑色素瘤细胞中这些趋化因子的过表达与肿瘤的生长、转移相关。用抗体中和这些趋化因子可使小鼠肿瘤生长延迟[9-10]。
CCL18属于CC族的趋化因子,基因定位于染色体17q11.2,曾被命名为人肺部活化调节趋化因子、树突状细胞趋化因子1、选择性巨噬细胞活化相关的 CC组趋化因子-1和巨噬细胞炎性蛋白-4[11-12]。CCL18 主要由树突状细胞及巨噬细胞分泌,靶细胞主要是淋巴细胞和未成熟的树突状细胞,可以吸引初始T细胞及皮质层的B淋巴细胞参与初次的免疫应答[13]。
已有研究表明,CCL18与多种恶性肿瘤的发生发展密切相关。在儿童特异类型的急性成淋巴细胞性白血病(如:T-ALL)血浆中,CCL18表达显著升高,并且与骨髓中的表达水平相似,提示血清CCL18的表达水平可作为儿童急性成淋巴细胞白血病的一个预测指标[6]。在卵巢癌患者腹水中,发现CCL18浓度显著高于对照组[14]。但在胃癌组织中CCL18的高水平表达预示生存期长,提示其抗肿瘤的生物学特性[15]。这些结果表明CCL18在不同恶性肿瘤中可能通过不同的信号途径发挥不同的生物学功能。
乳腺癌的发生发展与肿瘤细胞的生长,凋亡,侵袭等生物学特性有关[16]。研究发现,在乳腺癌患者血浆中CCL18浓度比正常组及乳腺良性疾病组明显升高。其在乳腺癌组织中的表达与肿瘤大小、淋巴结转移密切相关[17-18]。本研究对94例乳腺癌患者组织进行免疫组化分析,进一步证实CCL18高表达组的患者组织学分级较低,肿瘤较大,并且容易发生远处和淋巴结转移。表明CCL18可诱导肿瘤细胞的生长,并提高肿瘤细胞迁移、转移的能力。我们的实验表明,CCL18与肿瘤的受体情况无明显相关性,提示其可能未参与肿瘤细胞受体的生成过程。通过Kaplan-Meier生存分析表明,CCL18高表达组预后较差,提示CCL18的表达与乳腺癌的生长、转移相关,表明CCL18可作为评估乳腺癌预后的因素。
CCL18在不同肿瘤的相反作用使我们意识到CCL18调控肿瘤发生发展的机制是异常复杂的。在不同肿瘤组织中,CCL18有可能通过不同的信号通路发挥发挥不同的生物学作用。但相信随着人们对CCL18在肿瘤中异常表达原因的深入研究,其上下游调控网络的逐一建立,CCL18在肿瘤发生发展所作用的机制终会更加明晰,并会为以CCL18为靶点的分子治疗提供更为科学合理的依据。
[1] Hede K.Environmental protection:studies highlight importance of tumor microenvironment[J].J Natl Cancer Inst,2004,96(15):1120-1121.
[2]Laconi E.The evolving concept of tumor microenvironments[J].Bioessays,2007,29(8):738-744.
[3] Mantovani A,Allavena P,Sica A,et al.Cancer-related inflammation [J].Nature,2008,454(7203):436-444.
[4]Coussens LM,Werb Z.Inflammation and cancer[J].Nature,2002,420(6917):860-867.
[5]Fidler IJ.The pathogenesis of cancer metastasis:the ′seed and soil′hypothesis revisited [J].Nat Rev Cancer,2003,3(6):453-458.
[6]Struyf S,Schutyser E,Gouwy M,et al.PARC/CCL18 is a plasma CC chemokine with increased levels in childhood acute lymphoblastic leukemia[J].Am J Pathol,2003,163(5):2065-2075.
[7]Owen JD,Strieter R,Burdick M,et al.Enhanced tumorforming capacity for immortalized melanocytes expressing melanoma growth stimulatory activity/growth-regulated cytokine beta and gamma proteins[J].Int JCancer,1997,73(1):94-103.
[8]Strieter RM,Polverini PJ,Kunkel SL,et al.The functional role of the ELR motif in CXC chemokine-mediated angiogenesis[J].J Biol Chem,1995,270(45):27348-27357.
[9]Payne AS,Cornelius LA.The role of chemokines in melanoma tumor growth and metastasis[J].JInvest Dermatol,2002,118(6):915-922.
[10] Richmond A.Nf-kappa B.chemokine gene transcription and tumour growth [J].Nat Rev Immunol,2002,2(9):664-674.
[11]Adema GJ,Hartgers F,Verstraten R,et al.A dendriticcell-derived C-C chemokine that preferentially attracts naive T cells[J].Nature,1997,387(6634):713-717.
[12]Kodelja V,Muller C,Politz O,et al.Alternative macrophage activation-associated CC-chemokine-1,a novel structural homologue of macrophage inflammatory protein-1 alpha with a Th2-associated expression pattern [J].J Immunol,1998,160(3):1411-1418.
[13]Schutyser E,Richmond A,Van Damme J.Involvement of CC chemokine ligand 18(CCL18)in normal and pathological processes[J].J Leukoc Biol,2005,78(1):14-26.
[14] Schutyser E,Struyf S,Proost P,et al.Identification of biologically active chemokine isoforms from ascitic fluid and elevated levels of CCL18/pulmonary and activationregulated chemokine in ovarian carcinoma[J].J Biol Chem,2002,277(27):24584-24593.
[15]Leung SY,Yuen ST,Chu KM,et al.Expression profiling identifies chemokine(C-C motif)ligand 18 as an independent prognostic indicator in gastric cancer[J].Gastroenterology,2004,127(2):457-469.
[16]吴小进,米燕燕,杨 辉,等.黄芪多糖抑制人乳腺癌MCF-7细胞增殖和诱导凋亡[J].中华生物医学工程杂志,2014,20(2):106-109.
[17]Chen J,Yao Y,Gong C,et al.CCL18 from tumor-associated macrophages promotes breast cancer metastasis via PITPNM3 [J].Cancer Cell,2011,19(4):541-555.
[18]孙 平,张 洋,张 静.乳腺癌患者血清内 IL-6和CCL-18的表达及临床意义[J].现代肿瘤医学,2015,23(8):1072-1074.

