let-7对鼻咽癌细胞增殖及迁移的影响
郑明奋 张学辉 邹苑斌 张沈华 黄杰波
(广东省第二人民医院耳鼻咽喉头颈外科,广东广州510317)
鼻咽癌是来源于鼻咽黏膜上皮细胞的鳞状细胞癌恶性肿瘤。在中国广东、广西等地区鼻咽癌的发病率很高,且其5年生存率不高于70%[1]。鼻咽癌是一种与多种因素相关的疾病[2],遗传和表观遗传修饰在鼻咽癌的发生发展中发挥着重要的作用[3]。EB病毒感染、吸烟、喝酒都与鼻咽癌的发生有着密切的联系[4]。尽管局部放疗能在一定程度上抑制鼻咽癌的发展,但仍有约30%~40%的患者在4年内发生远处转移[2]。因此,了解其发病机制对于防治鼻咽癌具有重要意义。
最近的研究发现,microRNA的调节异常与多种肿瘤的发生发展有着密切的关系。microRNA是内源性的单链非编码微分子RNA,普遍存在动植物体内,长度一般约为22个核苷酸[5]。然而,microRNA在鼻咽癌的发病机制研究中尚未阐明[6,7]。let-7 是最早发现的一种 microRNA,研究表明let-7家族在多数肿瘤内呈低表达[8],并且发现 let-7可以抑制肿瘤细胞的增殖,转移,侵袭,并与预后相关[9],因此推测其可能成为潜在的治疗靶点和预后标记物。本研究通过转染let-7模拟物,增加细胞内let-7的表达研究let-7对鼻咽癌细胞增殖及细胞周期以及鼻咽癌细胞迁移的影响,进一步探索let-7抑制鼻咽癌细胞增殖的可能机制。本研究为临床治疗鼻咽癌的新靶点提供基础,也为其他肿瘤基因治疗提供参考。
1 材料与方法
1.1 材料
1.1.1 细胞株 正常人鼻咽部永生化上皮细胞NP69,人鼻咽癌 CNE-1和 CNE-2细胞,购自美国ATCC公司。
1.1.2 主要试剂 let-7 microRNA模拟物及对照的microRNA购于美国Dharmacon公司;RPMI1640培养基、0.25%胰蛋白酶购自美国Gibco公司;胎牛血清:浙江四季青公司;Keratinocyte-SFM 培养基,Lipofectamine2000转染试剂和 Trizol试剂购自美国Invitrogen公司;噻唑蓝(MTT)购自美国 Sigma公司;PrimeScriptTMRT reagent Kit逆转录试剂盒及SYBR®Premix Ex TaqTM实时定量PCR试剂盒购自TakaRa;细胞周期蛋白依赖性激酶 (cyclindependent kinase,CDK)6,c-myc 兔抗人单克隆抗体购于美国 Cell Signaling Technology;Anti-β-actin 抗体和Anti-rabbit HRP酶标IgG抗体购于美国Sigma-Aldrich;细胞培养瓶、细胞培养平板购自美国Corning;RIPA裂解液购于北京鼎国昌盛生物技术公司。细胞周期检测试剂盒购自南京凯基生物有限公司。
1.2 方法
1.2.1 细胞培养 正常人鼻咽部永生化细胞NP69接种于含10%胎牛血清的新鲜Keratinocyte-SFM培养基中,CNE-1和CNE-2细胞接种于含10%胎牛血清的新鲜RPM I1640培养基中,含100 U/L青霉素,100 mg/L链霉素,置于37℃、饱和湿度,5%CO2的培养箱中。
1.2.2 引物设计及合成 let-7 microRNA及内参U6引物由大连宝生物公司设计并合成,其中let-7的引物序列为:5′- TGAGGTAGGAGGTTGTATAGTT-3′,内参 U6的引物序列为:5′-CTCGCTTCGGCAGCACA-3′。
1.2.3 let-7在鼻咽癌细胞中的表达 提取正常鼻咽部永生化上皮细胞NP69,鼻咽癌细胞CNE-1和CNE-2总RNA并逆转录,用荧光定量PCR的方法检测这些细胞中 let-7 的表达。
1.2.4 细胞转染和荧光定量RT-PCR 取对数生长的细胞经胰酶消化、重悬铺6孔板,4×105/孔。实验设置let-7模拟物组,阴性对照(对照microRNA)组及空白对照3组。其中空白对照组只转染Lipofectamine2000,阴性对照组为 对照 microRNA+Lipofectamine2000,let-7 组为 let-7+Lipofectamine2000,按照 Lipofectamine2000使用说明转染。设置5个不同浓度梯度组,分别为10、20、50、80、100 nmol/L组,使用荧光显微镜观测转染羧基荧光素(FAM)标记的目的 microRNA,确定其转染效率。用荧光定量 RT-PCR 进一步验证let-7在CNE-2细胞中的相对表达量。每个样品3个复孔;PCR两步法条件:95℃ 10 s预 变 性 ;然 后 95 ℃ 5 s,60 ℃ 30 s,共40个循,各样品采用U6作为内参,let-7相对表达量采用2-CT方法计算。
1.2.5 细胞生长曲线测定 将处于对数生长期的细胞经胰酶消化、重悬以 1×104/孔铺24孔板,设3个复孔,待细胞贴壁后,弃去每孔培养液。加入含let-7(50 nmol/L)和NC microRNA 的新鲜培养液,另设置只加Lipofectamine2000的阴性对照组和不加细胞只加培养基的空白对照组。常规培养,于24、48、72和96 h用细胞计数板进行活细胞计数,每组3孔,取平均值绘制细胞生长曲线。
1.2.6 MTT法检测细胞增殖率 将处于对数生长期的细胞经胰酶消化、重悬按每孔100μL种于96孔板,每孔含1×103细胞,设7个复孔,培养24 h,弃去每孔培养液。加入含let-7(50 nmol/L)和NC microRNA的新鲜培养液,另设置只加Lipofectamine2000的阴性对照组和不加细胞只加培养基的空白对照组。加药后分别继续培养24、48、72 h 和96 h,每孔加入15 μL MTT,4 h 后吸弃孔中液体,每孔加入100μL二甲基亚砜溶液,振荡10 min,酶标仪570 nm测A值,取平均值绘制细胞增殖曲线。
1.2.7 细胞划痕实验 取对数生长期的 CNE-2细胞,将细胞按 5×105/孔分别接种至 6孔板内,每组设3个复孔,常规培养至融合度达到100%形成单层细胞后,用10μL无菌枪头沿孔底呈“一”字形划痕,PBS轻柔洗涤,加入无血清培养基继续培养,应用Image J软件观察并测量划痕0、48 h后细胞向致伤区迁移的距离,计算不同视野中10处划痕宽度,取其均值,根据原始细胞致伤区距离计算出细胞相对迁移率。胞迁移率(%)=(原划痕宽度-现划痕宽度)/原划痕宽度 ×100% 。
1.2.8 细胞周期检测 细胞收集后以冰PBS洗涤,75%冰乙醇振荡混匀,4℃固定过夜,洗涤离心后PBS重悬细胞,加RNA水解酶37%30 min,之后碘化丙啶室温避光染色30 min,流式细胞仪行细胞周期检测,重复3次。
(1)调节阀分为手动调节阀和电动调节阀两种。电动调节阀一般是由电气仪表专业根据设计参数进行选型。冷、热源系统中安装手动调节阀的位置一般在:①分水器的各个分支管上,对各支路流量进行调节;②换热器一次水的回水管上,调节换热器的供热量。手动调节阀要选择阀门开度和流量基本为等百分比型的,要根据管道的最大流量值确定调节阀的口径,一般情况下阀的口径要小于所安装管道的管径。
1.2.9 细胞周期相关调控因子检测 收集对照组和实验组 3组细胞,Trizol提取细胞总 RNA,按PScript@One Step RT-PCR Kit说明书进行反转录,SYBRTMPremix Ex TaqⅢ进行荧光定量 RT-PCR检测。细胞周期调控因子引物见表1。反应条件:95℃ 30 s热启动;95℃ 5 s变性,60℃ 34 s退火延伸,40个循环,每个样品设3个复孔,重复3次。
1.2.10 Western blotting检测c-myc和CDK6的表达取对数生长期状态良好的CNE-2细胞,以4×105个细胞每孔接种于 6孔板中,瞬时转染 let-7(50 nmol/L)和对照microRNA 72h后去除培养基,PBS洗3遍,RIPA裂解液裂解细胞后,12 000 g 4℃离心5 min,收集上清于-20℃保存。取16μL上述收集的蛋白上清,加入4μL SDS-上样缓冲液,于沸水中变性处理5 min后,等量上样于分离胶浓度10%、浓缩胶浓度5%的聚丙烯酰胺凝胶中电泳(SDS-PAGE电泳),电泳完毕后,采用湿转法将蛋白转膜至PVDF膜上,于常温下在脱脂奶粉浓度5%的TBST中封闭 1 h,然后分别加入 Anti-c-myc和 CDK6 抗体(1∶1 000)及 Anti-β-actin 抗体 (1∶3 000)4 ℃过夜,用TBST洗膜4遍后加入2抗Anti-rabbit IgG(1∶10 000)室温孵育1 h,TBST洗膜后加入发光液1 mL,暗室中用感光胶片记录蛋白条带结果。

表1 荧光定量RT-PCR引物
1.3 统计学方法
应用SPSS 13.0统计软件分析。计量资料以¯x±s表示,采用One-Way ANOVO统计学方法,P<0.05认为结果具有统计学意义。
2 结果
2.1 let-7家族在鼻咽癌细胞中的表达
用荧光定量PCR的方法检测let-7家族在鼻咽癌细胞CNE-2和CNE-1中的表达。结果显示,与正常鼻咽部上皮细胞NP69相比,CNE-2和CNE-细胞中 let-7 f家族 (let-7a,-7b,-7c,-7d,-7e,-7g,和 -7i)的表达显著降低(图 1),P<0.05。
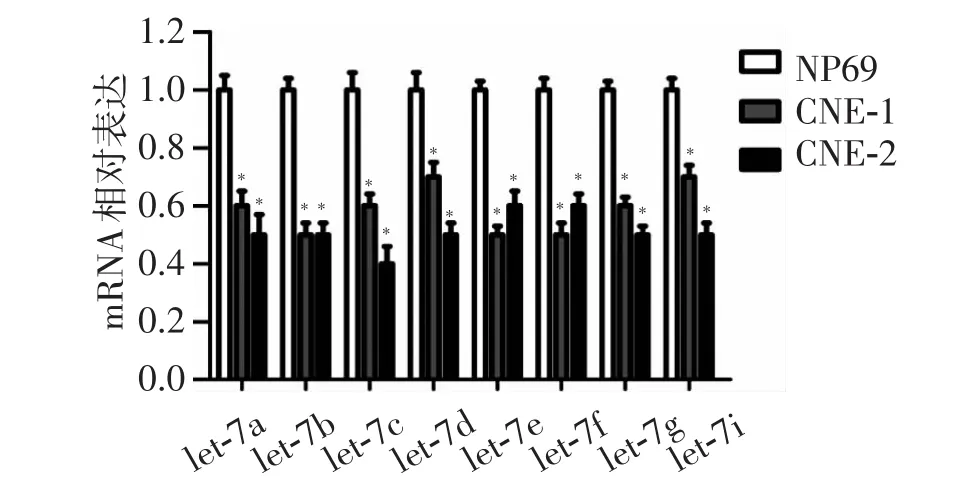
图1 let-7家族在鼻咽癌细胞(CNE-2和CNE-1)中的表达显著降低
2.2 let-7瞬时转染检测结果
分别使用5个浓度梯度组转染FAM标记的let-7,48 h后荧光显微镜观察转染效率,结果显示:50 nmol/L组的FAM标记 let-7转染效率最高,可高达90% 左右(图2),因此在后续的转染实验中let-7浓度均选用50 nmol/L。采用荧光定量PCR技术,检测转染let-7模拟物组、阴性对照组和空白对照组CNE-2 细 胞中的 let-7 相对含量,结果表明:let-7 的表达与对照组相比,随着转染浓度的增加而升高,在50 nmol/L处达到最高(图3)。

图2 CNE-2转染let-7(50 nmol/L浓度)模拟物48 h后荧光显微镜观察转染效率(×200)
2.3 let-7 对 CNE-2 细胞生长抑制作用
2.3.1 细胞计数 转染了let-7的实验组与转染了对照microRNA和空白对照组相比,转染了let-7的CNE-2细胞从转染后第3天起细胞增殖明显受抑(图4A),经统计学分析,差异具有统计学意义(P<0.05)。
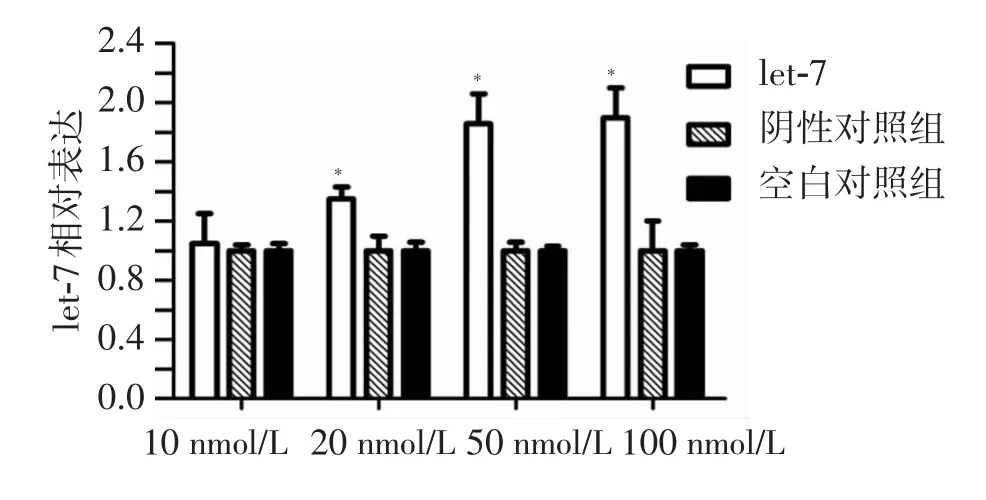
图3 荧光定量PCR法检测转染let-7后let-7 microRNA的表达
2.3.2 细胞增殖率的检测 MTT法检测细胞存活率来观察let-7对 CNE-2细胞的增殖抑制作用。结果表明,在第1、2天3组细胞的A值经单因素方差分析,差异无统计学意义(P>0.05),而在第3天、第4天3组细胞的A值差异均有统计学意义(P<0.05)(图 4B)。
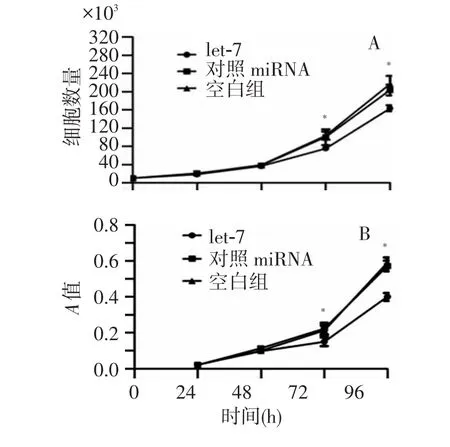
图4 let-7对CNE-2增殖的抑制作用
2.4 let-7 对 CNE-2 细胞迁移的影响
划痕48h后,转染let-7组的迁移率为 (0.56±0.01),转染了NC microRNA的阴性对照组为(0.85±0.02),空白对照组迁移率为 (0.83±0.03),与对照组相比,差异具有统计学意义(P<0.05)。3次重复实验结果显示,与空白组和阴性对照组相比,转染let-7后明显抑制鼻咽癌CNE-2细胞的迁移能力,见图 5-6。

图5 let-7对CNE-2迁移的抑制作用
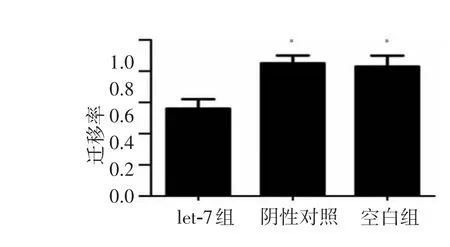
图6 let-7对CNE-2迁移的抑制比较
2.5 let-7 对 CNE-2 细胞周期的影响
let-7可显著影响鼻咽癌细胞周期分布(图7),使G0-G1期比例由68.23%±2.03%升高到82.90%±1.98%,两者比较差异具有统计学意义(P<0.05),S期比例由22.07%±1.14%降低到5.80%±0.87%(P<0.05),G2-M期比例由8.86%±1.10%升高到11.46%±1.60%,差异无统计学意义(P>0.05),见图 7-8。
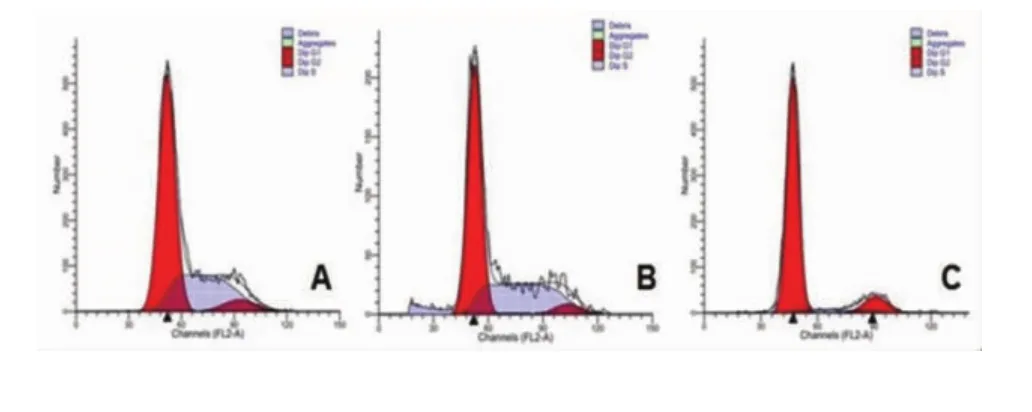
图7 let-7对细胞周期的影响
2.6 let-7对细胞周期调控因子的影响
应用荧光定量PCR法检测3组细胞的多种细胞周期调控因子的表达水平,结果显示高表达let-7后CDK6及 c-myc的 mRNA表达水平分别下降61.89%和58.21%,其他因子的表达差异无统计学意义(图9)。对 CDK6及 c-myc行免疫印迹法检测,结果显示,过表达let-7后CDK6及c-myc的表达亦下调(图10)。
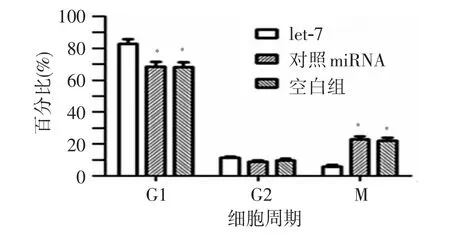
图8 let-7对细胞周期的影响比较
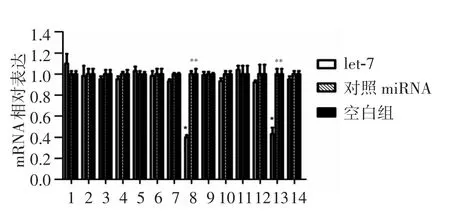
图9 let-7对CNE-2细胞周期调控因子的影响
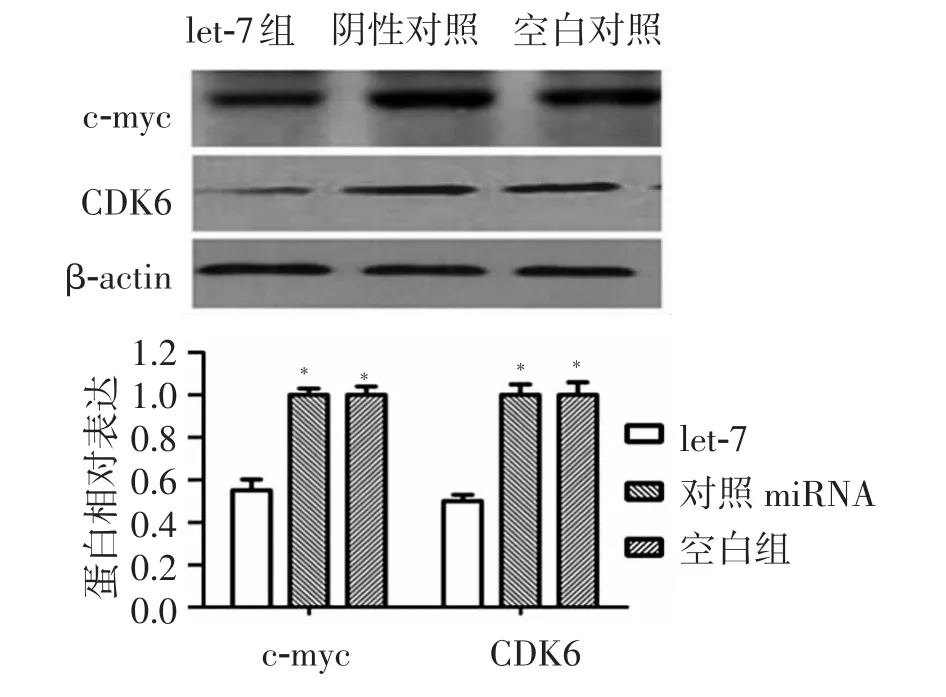
图10 Western blotting检测过表达let-7后c-myc和CDK 6蛋白水平的表达及比较
3 讨论
microRNA的表达调控异常与多种肿瘤相关,在肿瘤的发生发展中发挥着重要的作用。microRNA参与肿瘤细胞的许多生物学活动,如细胞增殖,分化和凋亡等[10-15],进而导致细胞周期和末端分化异常。因此,以microRNA为切入点,展开肿瘤相关microRNA的调控机理研究,对阐明肿瘤发生机制及肿瘤治疗具有重要意义。let-7是最早发现的一种microRNA,人 let-7 家族有 13 个成员,包括 let-7a 1、7a-2、7a-3、7b、7c、7d、7e、7f-l、7f-2、7g、7i、miR-98和 miR-202[16]。let-7 家族是一种抑癌 microRNA,在多种肿瘤中表达下调[17-18],并且 let-7 家族可以作为肿瘤预后的标记物,因为let-7家族的低表达与肿瘤预后不良相关,已有研究表明,低 let-7表达与肺癌预后不良相关[19]。
let-7已被公认为在肺癌发生发展中起着关键作用。研究发现,在143例肺癌患者中,44%患者癌组织中let-7家族的表达水平显著低于其在患者癌旁组织中的表达[20];microRNA 芯片结果提示,let-7家族的表达水平在肺癌组织中表现出特异性降低,而且let-7表达水平低的患者术后存期较短,预后较差[20-21],但恢复其正常表达有显著的肿瘤抑制作用[22-25]。最近的研究发现,let-7d 在鼻咽癌患者上皮细胞中表达显著降低,且与预后不良相关[26]。但let-7在鼻咽癌发生发展中的作用尚未阐明。本研究通过转染 let-7模拟物使 let-7 在 CNE-2细胞中的表达水平显著升高,并通过细胞计数和MTT实验验证过表达let-7后鼻咽癌细胞生长受到抑制,增殖活性明显下降,差异具有统计学意义。细胞周期结果显示,过表达 let-7后,G0-G1期细胞显著升高,而 S期细胞显著下降,并且过表达let-7可显著抑制细胞的迁移能力。
有研究表明,let-7 是通过抑制 c-myc,RAS,CDK6及CyclinD2的的表达发挥其抑癌作用的。let-7的靶基因包括Ras家族、高迁移率组 A蛋 白、c-myc和细胞周期调节因子(细胞分裂周期基因25A、细胞周期蛋白依赖性激酶6、细胞周期蛋白D2)[23,25,27]。其中最典型的两个是促进细胞增殖的Ras家族和参与细胞增殖分化的高迁移率组A蛋白。let-7可以抑制多种肿瘤中 c-myc的表达,例如结肠癌[28]。
为进一步探讨let-7抑制细胞增殖的机制,我们检测了细胞周期中G1-S调控点上的相关细胞周期蛋白(CCND1、CCND2、CCND3,CCNE1,CCNE2),细胞周期依赖性激酶(CDK2,CDK4,CDK6),以及p14,p16,p21,p53,c-myc 以及 pRb 等基因的表达。荧光定量PCR结果提示,过表达let-7后,CDK6和c-myc的表达均显著性下降,蛋白免疫印迹法的结果与荧光定量PCR的结果一致。研究结果表明,let-7可能通过抑制CDK6和c-myc的表达来抑制细胞增殖,本研究的结果与let-7在其他肿瘤中的生物学作用以及作用机制相一致。本研究为基因治疗鼻咽癌提供了靶标,使基因治疗鼻咽癌成为可能。并且本研究为深入探索let-7在鼻咽癌中的作用及作用机制提供了可靠的依据,也为其他恶性肿瘤的基因治疗提供参考。
[1]Lee AW,Yau TK,Wong DH,et al.Treatment of stage IV(A-B)nasopharyngeal carcinoma by induction-concurrent chemoradiotherapy and accelerated fractionation[J].Int J Radiat Oncol Biol Phys,2005,63(5):1331-1338.
[2]Dittmer DP,Hilscher CJ,Gulley ML,et al.Multiple pathways for Epstein-Barr virus episome loss from nasopharyngeal carcinoma[J].Int J Cancer,2008,123(9):2105-2112.
[3]Wong TS,Kwong DL,Sham JS,et al.Quantitative plasma hypermethylated DNA markers of undiVerentiated nasopharyngeal carcinoma[J].Clin Cancer Res,2004,10(7):2401-2406.
[4] Chang ET,Adami HO.The enigmatic epidemiology of nasopharyngeal carcinoma [J]. Cancer Epidemiol Biomarkers Prev,2006,15(10):1765-1777.
[5]Le QT,Tate D,Koong A,et al.Improved local control with stereotactic radiosurgical boost in patients with nasopharyngeal carcinoma[J].Int J Radiat Oncol Biol Phys,2003,56(4):1046-54.
[6]Lee RC,Feinbaum RI,Am bros V,et al.The C.elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J].Cell,1993,75(5):843-854.
[7]Chen HC,Chen GH,Chen YH,et al.MicroRNA deregulation and pathway alterations in nasopharyngeal carcinoma.Br JCancer,2009,100(6):1002-1011.
[8]Sengupta S,den Boon JA,Chen IH,et al.MicroRNA 29c is down-regulated in nasopharyngeal carcinomas,up-regulating mRNAs encoding extracellular matrix proteins[J].Proc Natl Acad Sci USA,2008,105(15):5874-5878.
[9]Li T,Chen JX,Fu XP,et al.microRNA expression profiling of nasopharyngeal carcinoma[J].Oncology Reports,2011,25(5):1353-1363.
[10]O′Hara AJ,Wang E,Dezube BJ,et al.Tumor suppressor miRNAs are underrepresented in primary effusion lymphoma and Kaposi sarcoma[J].Blood,2009,113(23):5938-5941.
[11]Bartel DP.MicrornAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[12] Ambros V.The functions of animal microRNAs[J].Nature,2004,431(7006):350-355.
[13] Bussing I,Slack FJ,Grosshans H.Let-7 microRNAs in development,stem cells and cancer[J].Trends in Molecular Medicine,2008,14(9):400-409.
[14]Jovanovic M,Hengartner MO.miRNAs and apoptosis:RNAs to die for[J].Oncogene,2006,25(46):6176-6187.
[15]Schickel R,Boyerinas B,Park SM,et al.MicroRNAs:key players in the immune system, differentiation,tumorigenesis and cell death[J].Oncogene,2008,27(45):5959-5974.
[16] Stefani G,Slack FJ.Small non-coding RNAs in animal development[J].Nature Review Molecular and Cellular Biology,2008,9(3):219-230.
[17] Rnush S,Slack FJ.The let-7 family of miRNAs[J].Trends cel1Biol,2008,18(10):505-516.
[18]Dahiya N,Sherman-Baust CA,Wang TL,et al.MicroRNA expression and identification of putative miRNA targets in ovarian cancer[J].PLOSONE,2008,3(6):e2436.
[19] Takamizawa J,Konishi H,Yanagisawa K,et al.Reduced expression of the let-7 microRNAs in human lung cancers in association with shortened postoperative survival[J].Cancer Research,2004,64(11):3753-3756.
[20] Lacerda TL,Cardoso PG,Augusto de Almeida L,et al.Inactivation of form yltransferase(wbkC)gene generates a Brucella abortus rough strain that is attenuated in macrophages and in mice[J].Vaccine,2010,28(34):5627-5634.
[21]Li S,Liu P,Xi L,et al.Expression of TMEM87B interacting with the human papillomavirus type 18 E6 oncogene in the Hela cDNA library by a yeast two-hybrid system[J].Oncol Rep,2008,20(2):421-427.
[22]Yanaihara N,Caplen N,Bowman E,et al.Unique microRNA molecular profiles in lung cancer diagnosis and prognosis[J].Cancer Cell,2006,9(3):189-198.
[23]Johnson CD,Esquela-Kerscher A,Stefani G,et al.The let-7 microRNA represses cell proliferation pathways in human cells[J].Cancer Res,2007,67(16):7713-7722.
[24]Esquela-Kerseher A,Trang P,Wiggins JF,et al.The let-7 microRNA reduces tumor growth in mouse model of lung cancer[J].Cell Cycle,2008,7(6):759-764.
[25]Childs G,Fazzari M,Kung G,et al.Low-level expression of microRNAs let-7 dand miR-205 are prognostic markers of head and neck squamous cell carcinoma[J].Am J Pathol,2009,174(3):736-745.
[26]Kumar M S,Erkeland SJ,Pester RE,et al.Suppression of non small cell lung tumor development by the let-7 microRNA family[J].Proc.Nat.Acad.Sci.U.S.A,2008,105(10):3903-3908.
[27]Boyerinas B,Parks M,Hau A,et al.The role of let-7 in cell differentiation and cancer[J].Endocr Relat cancer,2010,17(1):F19-F36.
[28]Akao Y,Nakagawa Y,Naoe T.Let-7 microRNA functions as a potential growth suppressor in human colon cancer cells[J].Biol Pharm Bull,2006,29(5):903-906.

