绿色荧光蛋白基因在木葡糖酸醋杆菌中的表达
钟 成,刘 淼,李 晶,韩培培,谭之磊,贾士儒
(工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457)
木葡糖酸醋杆菌(Gluconacetobacter xylinus)的静置培养过程中,在气液界面处生成细菌纤维素膜,这一现象被认为是木葡糖酸醋杆菌的趋氧性造成的[1].此外,李晶等[2]研究表明,木葡糖酸醋杆菌对氨基酸、碳源、酸和重金属等都有一定程度的趋化性.Sano 等[3]通过在水中外加电场,利用电解的作用产生氧气,诱导好氧性的木醋杆菌有序运动,从而实现了细菌纤维素的有序纤维结构.然而,目前研究者对微生物的趋化过程和鞭毛驱动蛋白的作用机理尚不明确.
绿色荧光蛋白(green fluorescent protein,GFP)是由238 个氨基酸组成的单体蛋白,其相对分子质量约为2,688.GFP 最初是由Shimomure[4]从多管水母属(Aequorea victoria)中分离出来的,以其良好的物理特性和荧光特性,而成为良好的报告基因和荧光标记分子,并在探索生命现象过程中得到了非常广泛的应用[5],可用于活细胞中直接观察细胞运动.本文通过构建重组质粒pMV24-gfp+,并在木葡糖酸醋杆菌中进行表达,证明其可作为选择标记用于今后的研究.开展GFP 相关的信号传导研究,可为研究木葡糖酸醋杆菌生物合成细菌纤维素与趋化性之间的关系提供重要的依据.
1 材料与方法
1.1 材料
1.1.1 菌种、质粒和培养基
木葡糖酸醋杆菌(Gluconacetobacter xylinus)CGMCC 2955 由工业发酵微生物教育部重点实验室筛选,中国普通微生物菌种保藏管理中心(China general microbiological culture collection center,CGMCC)保藏.大肠杆菌(E.,coli)DH5α 由工业发酵微生物教育部重点实验室保藏.
pMV24 穿梭载体由日本Mitsukan 集团有限公司赠予.
木葡糖酸醋杆菌培养基(g/L):葡萄糖25,酵母粉7.5,蛋白胨10,Na2HPO410,初始pH 6.0.固体培养基加2%琼脂.121,℃灭菌15,min.
LB 培养基(g/L):蛋白胨10,酵母粉5,氯化钠10,pH 7.0.固体培养基加 2%琼脂.121,℃灭菌15,min.
1.1.2 试剂与仪器
蛋白酶K,北京鼎国生物技术有限责任公司;溶菌酶、引物、Taq DNA 聚合酶、dNTPs,上海生工生物工程有限公司;DNA Marker、pCR2.1,T-Vector、DNA柱回收试剂盒、DNA 凝胶回收试剂盒,大连宝生物科技(北京)有限公司;RNase A,美国Genview 公司;限制性内切酶,Fermentas 公司.
电热恒温水浴锅,天津市中环实验电炉有限公司;台式高速离心机,上海医用分析仪器厂;稳压稳流电泳仪,北京六一仪器厂;基因扩增仪、凝胶分析仪、Micro pulser 型电转化仪,美国Bio-Rad 公司;荧光显微镜、BX51 型荧光显微镜,日本Olympus 公司.
1.2 方法
1.2.1 引物设计
设计引物分别在上游和下游加上 EcoRⅠ和XbaⅠ的酶切位点及相应保护碱基.F:5′-CGGAATT CAAGAAGATATACATATGGCT-3′;R:5′-CTCTAGA CTCGAATTCATTATTTGTAG-3′.下划线为酶切位点.
1.2.2 转基因木葡糖酸醋杆菌CGMCC,2955/pMV24-gfp+的构建
以质粒pMUTIN-gfp+为模板扩增gfp 基因.PCR体系为25,µL 反应程序:95,℃模板预变性5,min;95,℃模板变性30,s,50,℃引物退火30,s,72,℃引物延伸1,min,共33 个循环;最后72,℃延伸10,min.PCR 产物利用1%琼脂糖凝胶电泳进行分析.
取出后纯化PCR 产物.PCR 产物片段与表达载体pMV24 用EcoRⅠ和XbaⅠ双酶切.酶切后的gfp基因与pMV24 按3∶1 和5∶1 体系连接,得到重组质粒pMV24-gfp+.质粒构建流程如图1 所示.将重组质粒化转入E.,coli DH5α (方法见1.2.3),阳性克隆进行质粒提取并测序.将同源性最高(100%)的重组质粒命名为pMV24-gfp+.
提取pMV24-gfp+质粒,电转入木葡糖酸醋杆菌CGMCC 2955 感受态细胞(方法见1.2.4).随机挑取转化子,提取质粒,酶切验证并测序.验证正确的转化子命名为CGMCC 2955/pMV24-gfp+.

图1 质粒构建流程图Fig.1 Construction of pMV24-gfp+ plasmid
1.2.3 化学转化
于感受态细菌中加入5.0,µL 连接产物,轻轻搅拌混匀,冰浴30,min;42,℃水浴热激90,s,冰浴2,min;每管加LB 液体培养液900,µL,37,℃水浴60,min,180,r/min 振荡培养1,h;将上述菌液按原倍和稀释10倍分别涂布于含100,µg/mL 氨苄青霉素100,µL 和40,µg/mL 的X-Gal 的LB 平板,置于37,℃培养箱,37,℃正放至涂布液体基本被吸收,再倒置培养18~24,h.从平板上挑取单个分离良好的白色菌落.
1.2.4 木葡糖酸醋杆菌电转化
取甘油管中保存的木葡糖酸醋杆菌的菌液接入装有100,mL 液体培养基的500,mL 摇瓶中,30,℃、160,r/min 振荡培养24,h,向液体摇瓶中加入1,mL 纤维素酶(10,000,U/mL),30,℃酶解2,h.酶解后离心洗涤后的细胞,经10%甘油-氯化镁溶液洗涤、离心各2次,再以10%甘油悬浮、离心各2 次,最后用10%甘油溶液悬浮制成感受态细胞.电击条件为:电压2.40,kV、电容25,µF、电阻200,Ω.在含氨苄青霉素100,µg/mL 的抗性固体平板上筛选转化子.
1.2.5 转基因芽的GFP 荧光观察
在BX51 型荧光显微镜下观察转基因的细胞中GFP 荧光的表达情况,采用自动成像系统拍照.
2 结果与分析
2.1 目的基因的扩增结果与克隆载体的构建
以质粒pMUTIN-gfp+为模板扩增gfp 基因,扩增的片段与表达载体pMV24 用EcoRⅠ和XbaⅠ双酶切,结果如图2 所示.从电泳结果看,在PCR 扩增的gfp 基因与预期大小相符.经切胶回收,连接pCR2.1 T 载体,转化到大肠杆菌DH5α.阳性克隆测序结果分析显示gfp 基因片段与pMUTIN-gfp+的目的片段序列大小(717,bp)一致,二者的碱基序列相同.

图2 目的基因和穿梭质粒的双酶切电泳图Fig.2 Electrophoretogram of target gene and shuttle plasmid with restriction enzyme digestion
2.2 重组质粒的构建和鉴定
将EcoRⅠ和XbaⅠ双酶切处理后的pCR2.1,T/gfp+质粒,通过琼脂糖凝胶电泳分离T 载体片段和gfp 目的片段,将gfp 基因回收后,与pMV24 按3∶1和5∶1 体系分别过夜连接,并转化至大肠杆菌感受态细胞中.挑取绿色菌落,提取质粒并采用EcoRⅠ和XbaⅠ双酶切验证,结果如图3 所示.由图3(b)可以看出,在4,000,bp 和750,bp 的DNA Marker 条带附近有与预期大小抑制的条带出现.
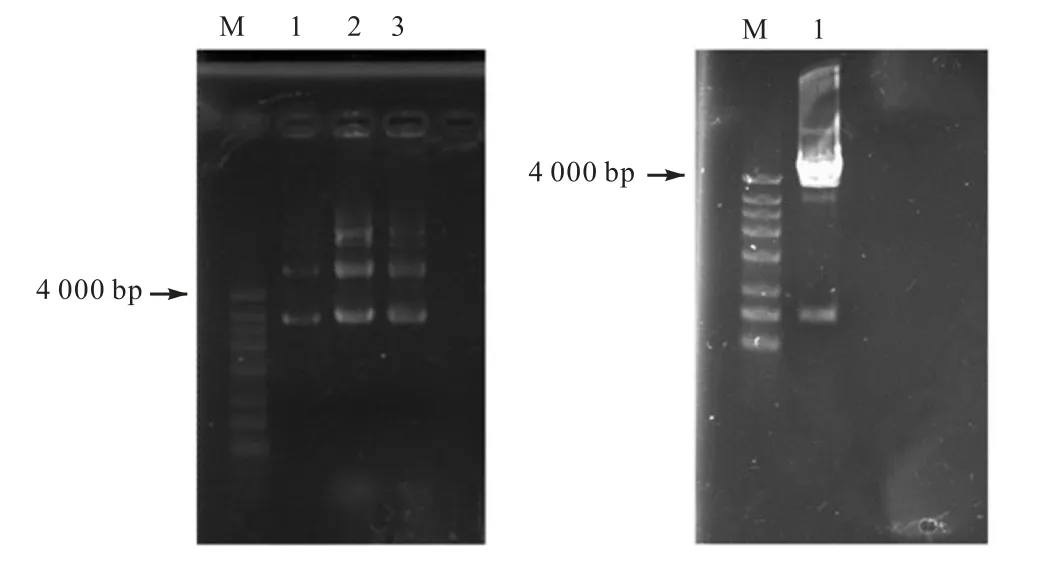
图3 gfp+转化子的鉴定Fig.3 Identification of gfp+ transformation
2.3 GFP在G.xylinus CGMCC 2955中的表达
将构建好的质粒pMV24-gfp+电转化至木葡糖酸醋杆菌中.将转化菌株置于荧光显微镜下进行观察,结果如图4 所示.转化菌株在荧光显微镜的蓝色激发光下可发出绿色荧光,拍照可观察到菌体发出绿色的荧光,说明重组质粒pMV24-gfp+在木葡糖酸醋杆菌中表达,证明其可作为选择标记用于今后木葡糖酸醋杆菌的趋化性研究.

图4 转化子荧光显微照片Fig.4 Fluorescence micrograph of transformant
3 讨论
作为一种报告基因,GFP 比lacZ、CAT 等报告基因有许多无可比拟的优越性:GFP 不具有种属依赖性,在多种原核和真核生物细胞中都表达;不需要反应底物与其他辅助因子,在蓝光的激发下可产生绿色荧光;通过替换特性氨基酸,可产生不同颜色的光,满足不同的研究需求等[6].因而,GFP 可广泛应用于报告基因、基因的表达与调控、蛋白质的定位、信号传导、转染与转化以及细胞的分离与纯化等领域[7],可在更接近自然真实状态的条件下进行活细胞实时定位观察.如在活细胞中直接观察蛋白质向细胞核、内质网运动的状态,还可实时观察到外界信号刺激下目的蛋白的变化过程.
然而,蛋白在原核表达系统中表达时,常常受到目的基因本身结构、转录水平调控和蛋白质折叠等诸多因素的影响.目的基因在原核表达系统的有效表达成为基因工程技术的难点之一,制约了蛋白质的功能研究和应用.本文所采用的穿梭质粒pMV24 是由日本Mizknan Holdings 中央研究院构建而成,目前已广泛用作醋酸菌属的穿梭质粒和表达质粒[8].Fukay等[8]使用pMV24 穿梭质粒研究Acetobacter polyoxogenes 中乙醛脱氢酶对醋酸产量的影响.本文也成功使用该质粒使GFP 蛋白在木葡糖酸醋杆菌中表达.此外,pMV24 质粒中的氨苄青霉素抗性筛选基因也正是木葡糖酸醋杆菌所缺失的.因而,阳性克隆细胞的筛选简便、成功率高.
目前,由于木葡糖酸醋杆菌的定向运动可直接引起细菌纤维素的规则性排列,使得木葡糖酸醋杆菌的趋化性广泛受到研究者的关注.孙臻[9]利用荧光染料coriphosphine O 对木醋杆菌(Acetobacter xylinus)进行染色,以观察微生物细胞在单根条纹管道和网格状微流控芯片中的运动.然而,其染色过程通常伴随着对菌体的离心和洗涤等多个处理程序,往往造成微生物细胞的损伤.而GFP 无毒性且是菌体在不受任何外界环境影响的前提下自发表达的,可在最自然的状态下追踪细胞的运动.或者,将GFP 与其他蛋白融合追踪蛋白的变化过程.Englert 等[10]就曾用表达绿色荧光蛋白和红色荧光蛋白的大肠杆菌对趋化性进行了定量分析.Sourjik 等[11-12]用荧光共振能量转移技术(fluorescence resonance energy transfer,FRET)研究了趋化信号传导系统中各种蛋白的相互作用.
综上所述,将GFP 基因在木葡糖酸醋杆菌中成功表达是追踪菌体细胞运动和胞内蛋白迁移的最佳选择,还可用于检测基因表达的时序性,例如观察使木葡糖酸醋杆菌具有趋化反应的鞭毛及其动力蛋白等分子发动机的形成.因此,本实验采用PCR 技术扩增出绿色荧光蛋白,以pMV24 穿梭质粒为载体,实现了GFP 绿色荧光蛋白基因在木葡糖酸醋杆菌中的表达;在荧光显微镜的蓝色激发光下可观察到绿色荧光;此转化子的成功构建为木葡糖酸醋杆菌趋化性的深入研究奠定了坚实的研究基础.
[1]Morgan J L W,McNamara J T,Zimmer J.Mechanism of activation of bacterial cellulose synthase by cyclic di-GMP[J].Nature Structural &Molecular Biology,2014,21(5):489-496.
[2]李晶,贾士儒,杨洪江,等.木葡糖酸醋杆菌趋化性的初步研究[J].天津科技大学学报,2012,27(1):1-4.
[3]Sano M B,Rojas A D,Gatenholm P,et al.Electromagnetically controlled biological assembly of aligned bacterial cellulose nanofibers[J].Annals of Biomedical Engineering,2010,38(8):2475-2484.
[4]Shimonura O.Structure of the chromophore of Aequorea green fluorescent protein[J].FEBS Letters,1979,104(2):220-222.
[5]Prasher D C,Eckenrode V K,Ward W,et al.Primary structure of the Aequorea victoria green fluorescent protein[J].Gene,1992,111(2):229-233.
[6]Cubitt A B,Heim R,A dams S R,et al.Understanding,improving and using green fluorescent protein[J].Ttrends in Biochemical Sciences,1995,20(11):448-455.
[7]Kain S R,Adams M,Kondepudi A,et al.Green fluorescent protein as a reporter of gene expression and protein localization[J].BioTechniques,1995,19(4):650-655.
[8]Fukaya M,Tayama K,Tamaki T,et al.Cloning of the membrane-bound aldehyde dehydrogenase gene of Acetobacter polyoxogenes and improvement of acetic acid production by use of the cloned gene[J].Applied and Environmental Microbiology,1989,55(1):171-176.
[9]孙臻.图案化细菌纤维素的可控生物制造[D].武汉:华中科技大学,2013.
[10]Englert D L,Manson M D,Jayaraman A.Flow-based microfluidic device for quantifying bacterial chemotaxis in stable[J].Competing Gradients Applied and Environmental Microbiology,2009,75(13):4557-4564.
[11]Sourjik V,Berg H C.Receptor sensitivity in bacterial chemotaxis[J].Proceedings of the National Academy of Sciences of the United States of America,2002,99(1):123-127.
[12]Sourjik V,Berg H C.Functional interactions between receptors in bacterial chemotaxis[J].Nature,2004,428(6981):437-441.

