滇重楼茎叶总皂苷提取工艺优化及其体外抗氧化活性分析
韦 蒙,许新恒,李俊龙,申世安,刘 静,丁春邦
四川农业大学生命科学学院,雅安 625014
滇重楼[Paris polyphyllavar.yunnanensis(Franch.)Hand.-Mazz.]是2010年版《中国药典》收载的中药材重楼的基原植物之一,为延龄草科(Trilliaceae)重楼属(Paris)多年生草本植物,以干燥根茎入药[1]。中医认为重楼具有清热解毒、消肿止痛、凉肝定惊之功效,主要用于止血、免疫调节、抗肿瘤、抗炎、抗菌抑菌、镇静镇痛等,已广泛应用于临床[2,3]。重楼的药用部位为根茎,主要活性成分为甾体皂苷、黄酮类和多糖类[4]。
滇重楼根茎生长缓慢,从种子发芽到生长成药用商品,一般需要10~15年。每年秋末10~11月,地上茎叶部分会枯萎倒下并被丢弃,其生物质的总产量要远高于地下部分。据文献报道,滇重楼茎叶含有与根茎相近的皂苷成分。因此,对滇重楼的地上茎叶部分进行开发利用,将大幅提高滇重楼的综合利用率,在一定程度上也可缓解重楼药材的供需矛盾,增加药农收入,推动滇重楼人工种植的发展[5,6]。
目前植物皂苷的提取方法主要有溶剂提取法、生物酶解提取法、微波辅助提取法和超声波辅助提取法等[7-10],其中,超声波辅助提取法是利用超声波能提高有效成分提取率的一种技术,具有低消耗、高效率、操作简便和节约时间的优点,已广泛应用于天然产物中有效成分的提取[11,12]。因此,本实验利用响应面法(response surface methodology,RSM)优化滇重楼茎叶中总皂苷的超声波辅助提取工艺,并分析所得总皂苷的抗氧化活性,为滇重楼茎叶的有效利用和开发提供理论依据和技术支撑。
1 材料与方法
1.1 材料与试剂
滇重楼茎叶,2013年10月采自云南省文山州重楼种植基地,经四川农业大学丁春邦教授鉴定为滇重楼[Paris polyphyllavar.yunnanensis(Franch.)Hand.-Mazz.]。晾干后粉碎常温保存。
石油醚(60~90 ℃)、甲醇、2,2-二苯基-1-苦味基肼(DPPH)、薯蓣皂苷元标准品、丙酮、水杨酸、邻苯三酚、盐酸、硫酸亚铁等。所有试剂均为分析纯。
1.2 仪器与设备
SHB-D(Ⅲ)型循环水式真空泵(巩义市予化仪器厂),UV-1750 型紫外分光光度计(Shimadzu,日本),FA2004B 型电子天平(上海精天电子仪器有限公司),UPT-T-101 型超纯水器(成都超纯水科技有限公司),DZTW 型调温热套、FW135 型高速万能粉碎机以及DZKW-S-6 型电热恒温水浴锅(北京永光明医疗仪器厂),RE-2000B 型旋转蒸发器(上海亚荣生化仪器厂),7D-4Z 型台式低速离心机(蜀科仪器有限公司),KQ-300DV 型超声波清洗器(昆山市超声仪器有限公司)。
1.3 试验方法
1.3.1 滇重楼茎叶总皂苷的提取工艺流程
晾干的滇重楼茎叶经粉碎过筛,依次用石油醚和丙酮除去色素。称取样品粉末10.0 g,置于锥形瓶中,超声辅助提取一定时间。提取液离心取上清液,检测总皂苷含量。提取液浓缩蒸发得到总皂苷浸膏。所得浸膏经大孔树脂分离纯化后真空干燥,得到总皂苷样品。
1.3.2 滇重楼茎叶总皂苷含量的测定
参考王俊等的方法[13]。取滇重楼茎叶总皂苷提取液0.5 mL,挥干溶剂,加入5%的冰醋酸-香草醛溶液0.2 mL,高氯酸0.8 mL。摇匀后30 ℃条件下反应30 min,加入冰醋酸5 mL 终止反应。410 nm处测定吸光度。以薯蓣皂苷作标准品,标准曲线为Y=7.2901X+0.054,R2=0.9954,表明在0~0.5 mg/mL 范围内线性关系良好。
总皂苷得率(%)=样品液中总皂苷浓度×样品液体积/滇重楼茎叶粉末质量×100%
1.3.3 单因素试验
以滇重楼茎叶中总皂苷得率为指标,研究料液比(1∶5、1∶10、1∶15、1∶20、1∶25 g/mL,固定提取温度55 ℃,超声功率210 W,提取时间1.5 h)、提取温度(40、45、50、55、60 ℃,固定料液比1∶15,超声功率210 W,提取时间1.5 h)、提取时间(0.5、1.0、1.5、2.0、2.5 h,固定料液比1∶15,提取温度55 ℃,超声功率210 W)、超声功率(150、180、210、240、270 W,固定料液比1∶15,提取温度55 ℃,提取时间1.5 h)对总皂苷得率的影响。试验3 次重复。
1.3.4 响应面法优化试验设计
在单因素试验结果的基础上,根据Box-Behnken设计原理,选择超声功率(A)、提取温度(B)、提取时间(C)和料液比(D)4 个因素为自变量,以滇重楼茎叶总皂苷得率为响应值(R),设计四因素五水平响应面试验(表1),预测滇重楼茎叶总皂苷超声辅助提取的最佳工艺。
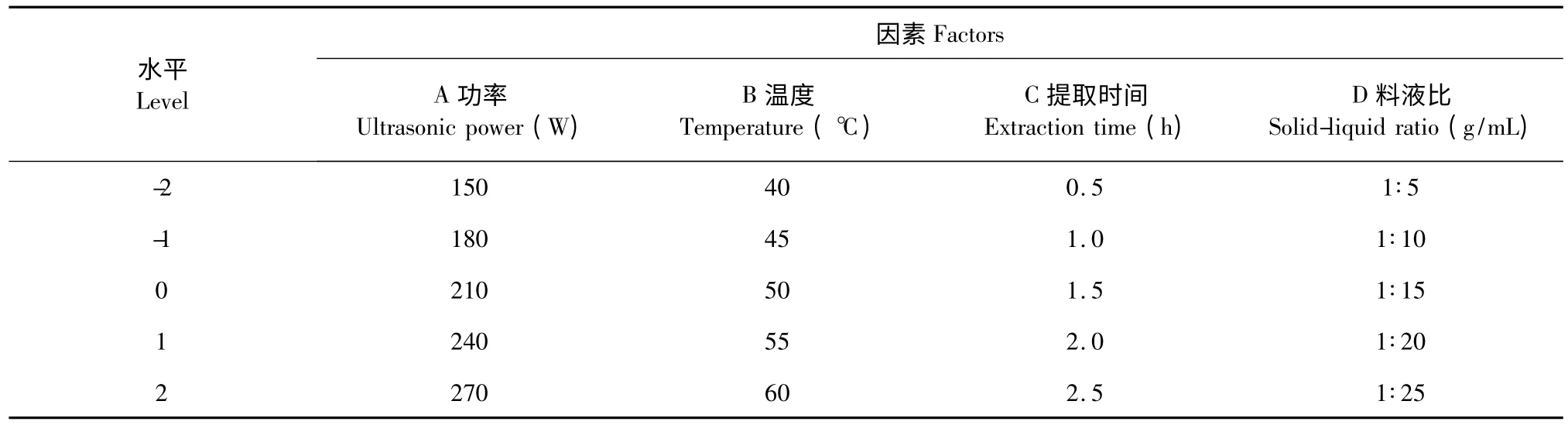
表1 响应面分析因素及水平表Table 1 Factors and levels of response surface experiment
1.3.5 滇重楼茎叶总皂苷的抗氧化活性测定
1.3.5.1 DPPH 自由基清除能力的测定
参考Liu 等[14]的实验方法,适当改进。用乙醇配制0.2 mmol/L 的DPPH 溶液,用甲醇配制一系列梯度的总皂苷溶液。向具塞试管中加入2 mL DPPH和2 mL 不同浓度的总皂苷溶液,混匀,黑暗条件下常温反应30 min,517 nm 测定吸光值。试验3 次重复。
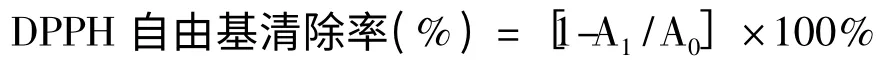
式中,A1为加入样品的反应液吸光值,A0为用甲醇代替样品的反应液吸光值。
1.3.5.2 羟自由基清除能力的测定
参考Saeed 的实验方法[15],适当改进。向具塞试管内按顺序加入9 mmol/L FeSO41 mL,9 mmol/L水杨酸-乙醇溶液2 mL,加入总皂苷溶液2 mL,最后加入8.8 mmol/LH2O22 mL 启动反应,37 ℃下反应0.5 h,510 nm 测定吸光值。试验3 次重复。
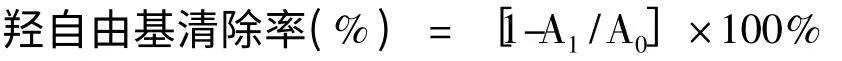
式中,A1为加入样品的反应液吸光值,A0为用甲醇代替样品的反应液吸光值。
1.3.5.3 超氧阴离子清除能力的测定
参考Chen 等[16]的实验方法,适当改进。向具塞试管内加0.05 mol/L pH 8.2 Tris-HCl 缓冲液5 mL,在25 ℃条件下预热5 min,加1 mL 总皂苷溶液,25 ℃反应20 min 后,加入0.4 mL 3 mmol/L 的邻苯三酚,混匀,25 ℃反应5 min,用0.5 mL 的浓盐酸终止反应,299 nm 测定吸光值。试验3 次重复。
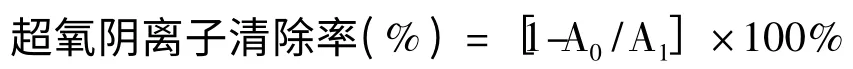
式中,A1为加入样品的反应液吸光值,A0为用Tris-HCl 缓冲液代替样品的反应液吸光值。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 超声功率对滇重楼茎叶总皂苷得率的影响
如图1A 所示,总皂苷得率随超声功率增加而增加,当功率达240 W 时,总皂苷得率为2.84%,表明超声功率240 W 时,原料中总皂苷已基本萃取到溶液中。考虑到节约能源与保护设备,故选择超声功率240 W。
2.1.2 提取温度对滇重楼茎叶总皂苷得率的影响
如图1B 所示,总皂苷得率随提取温度的上升而快速增加,当温度到达55 ℃后,总皂苷得率基本稳定,此时总皂苷得率为2.13%。表明55 ℃时,提取溶剂已很好地穿透滇重楼茎叶细胞。为减少溶剂挥发和节约能源成本,故选取最佳提取温度为55℃。
2.1.3 提取时间对滇重楼茎叶总皂苷得率的影响
如图1C 所示,随提取时间的增加,总皂苷得率迅速增加,当提取时间达2 h 时,总皂苷得率为2.38%,之后延长时间,总皂苷得率基本稳定。表明提取时间2 h 已能将原料中总皂苷基本溶出。为缩短提取周期、节约成本,故选取最佳提取时间为2 h。
2.1.4 料液比对滇重楼茎叶总皂苷得率的影响
由图1D 可知,随着料液比的增加,总皂苷得率不断增加,在料液比为1∶15(g/mL)时,总皂苷得率达到最大值2.12%,之后基本稳定。料液比为1∶15(g/mL)时,材料中的总皂苷基本溶出,继续增大溶剂量,其总皂苷得率无明显增加。考虑到节省溶剂成本,故选择最优料液比为1∶15(g/mL)。
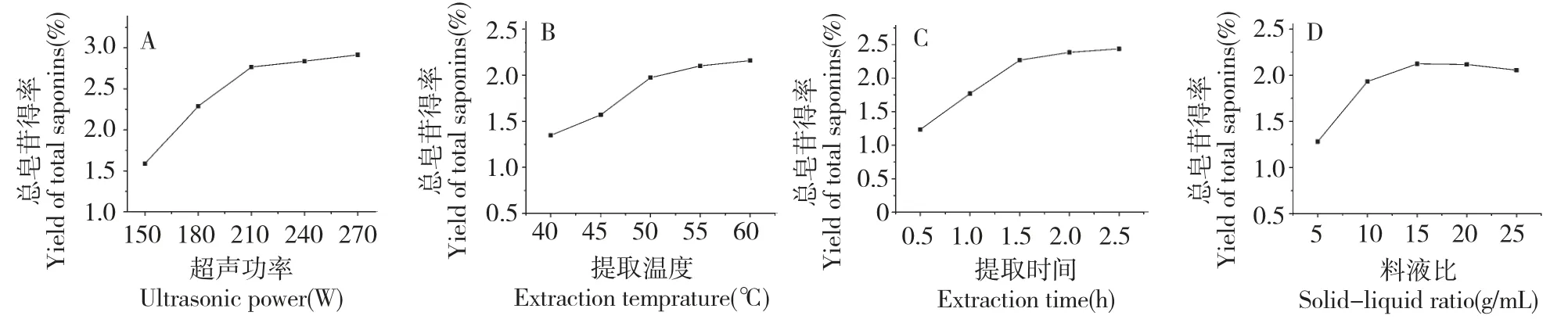
图1 超声功率(A)、提取温度(B)、提取时间(C)和料液比(D)对滇重楼茎叶总皂苷得率的影响Fig.1 Effects of ultrasonic power (A),extraction temperature (B),extraction time (C),solid-liquid ratio (D)on the extraction yield of total saponins
2.2 响应面法优化滇重楼茎叶总皂苷的提取工艺
2.2.1 响应面试验设计及结果
利用Design-Expert 7.0 软件对表2 中的试验结果进行二次多元回归拟合,得到滇重楼茎叶总皂苷得率(R)与超声功率(A)、提取温度(B)、提取时间(C)和料液比(D)之间的回归模型为:
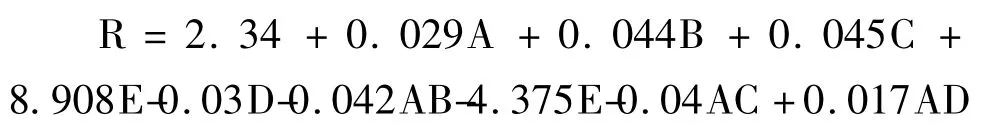

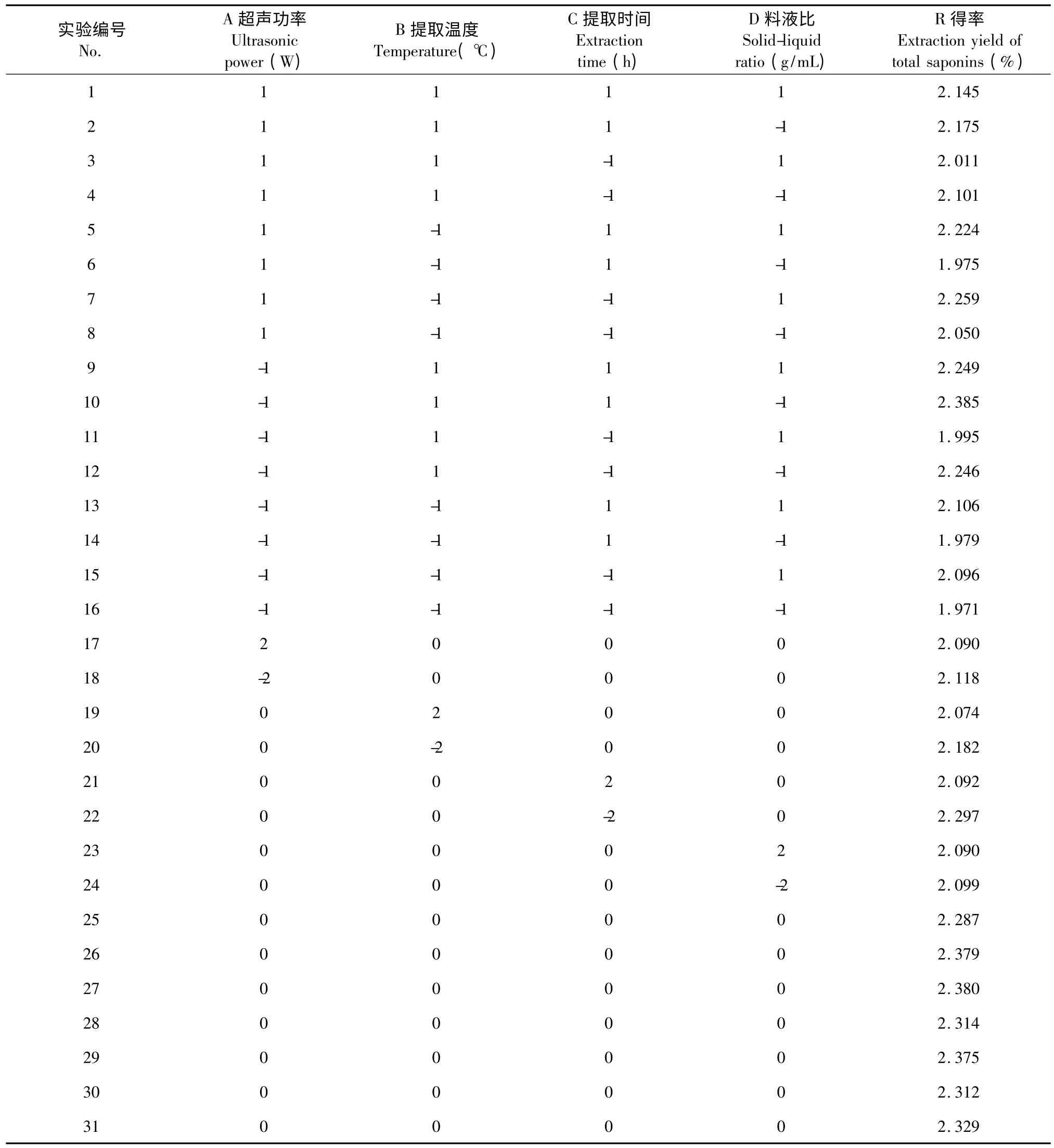
表2 Box-Behnken 中心组合设计方案及实验结果Table 2 Box-Behnken experimental design and the results of these experiments
2.2.2 回归模型方差分析与显著性检验
利用Design-Expert 7.0 软件对回归模型进行方差分析(analysis of variance,ANOVA)(表3),结果显示,模型极显著(P<0.01),失拟项不显著(P>0.05);R2=0.9143,说明该模型拟合度较好。因此该模型可以用于预测滇重楼茎叶总皂苷超声波辅助提取的最佳工艺。
各因素对滇重楼总皂苷得率显著性分析可以看出,显著性最强的是提取温度和提取时间,其次是超声功率,而料液比对总皂苷得率的影响不显著。因素间交互效应中,AB、BC 和BD 的交互效应显著。四个因素的二次项效应均显著。根据F值大小,可以得出各因素对滇重楼总皂苷得率的影响大小为提取时间>提取温度>超声功率>料液比。
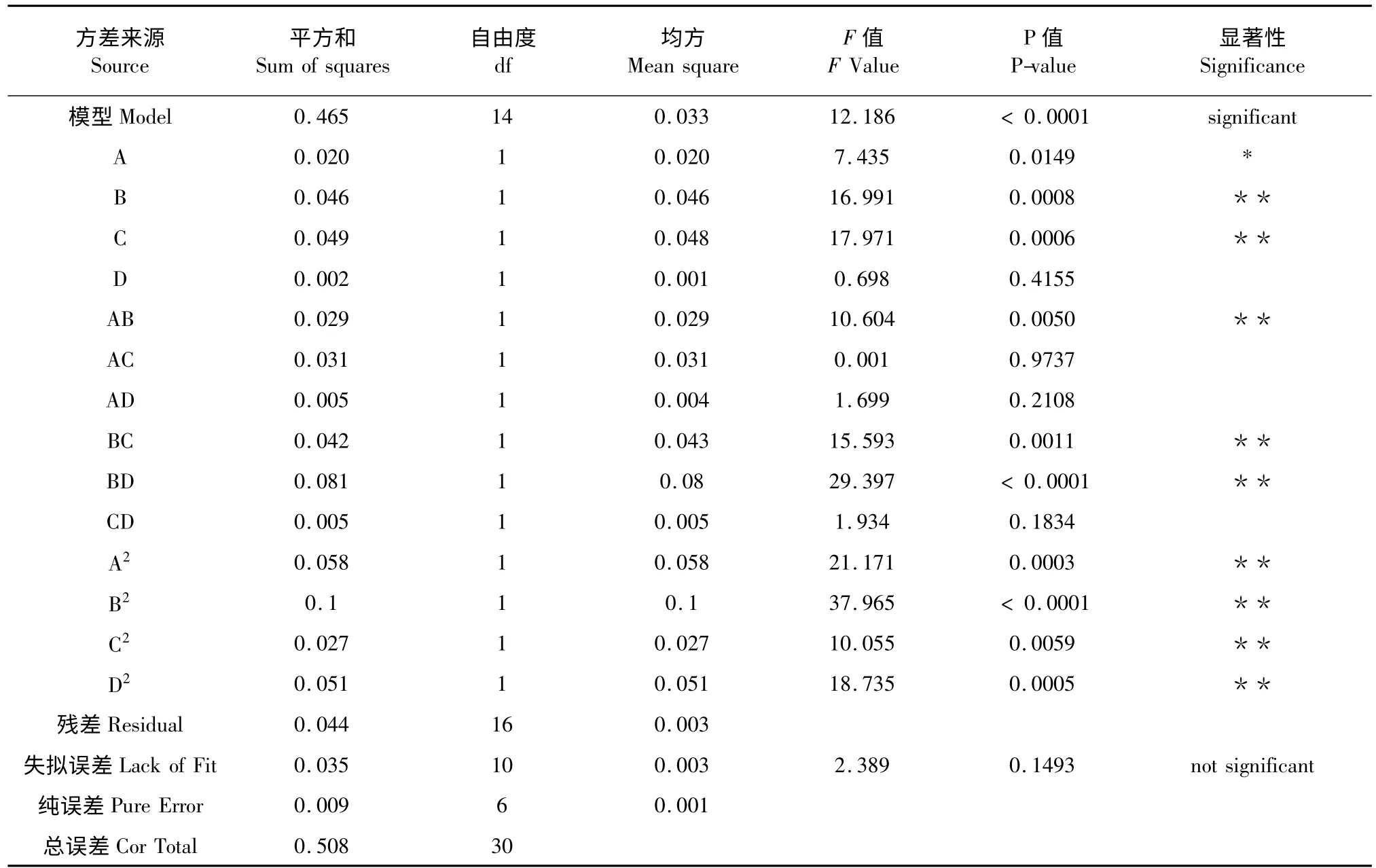
表3 回归模型方差分析Table 3 The variance analysis of regression model

图2 各因素间交互作用对总皂苷得率影响的响应面图[R=f(A,B)(A)、R=f(A,C)(B)、R=f(A,D)(C)、R=f(C,B)(D)、R=f(D,B)(E)、R=f(D,C)(F)]Fig.2 Response surface plots showing the effects of different variables on extraction yield of total saponins
2.2.3 响应面分析
根据回归方程,绘制总皂苷得率(R)和试验因素超声功率(A)、提取温度(B)、提取时间(C)和料液比(D)的响应面图(图2)。在其他因素条件固定不变的情况下,考察交互项之间的影响。根据图2的响应面与等高线变化规律可以看出,随着各因素值的增大,响应值R 逐渐升高;当R 值达到极值之后,随着各因素量的增大,响应值R 逐渐减小。比较各图可知,提取温度和超声功率的抛物线最陡(图2A),提取时间和料液比的抛物线(图2F)则较为平缓,与方差分析结果一致。等高线越密,表明因素对总皂苷得率的影响越大。从图2 可以看出,提取温度较提取功率对总皂苷得率的影响大(图2A);提取温度较提取时间对总皂苷得率的影响大(图2D);提取温度较料液比的影响大(图2E);提取时间较料液比的影响大(图2F),这与方差分析结果一致。
2.2.4 最佳工艺参数与验证试验
经响应面优化,超声辅助提取滇重楼茎叶总皂苷的最佳工艺参数为料液比1∶12.30(g/mL)、提取温度53.72 ℃、超声功率215.92 W、提取时间1.90 h。在此工艺条件下,滇重楼茎叶总皂苷得率的预测值为2.385%。
考虑到实际可操作性,将最佳工艺参数调整为料液比1∶12(g/mL)、提取温度54 ℃、超声功率210 W、提取时间2 h,在此条件下进行3 次重复验证试验,滇重楼茎叶总皂苷平均得率为2.360%,与预测值的相对误差为1.04%,表明该模型能用于指导超声辅助提取滇重楼茎叶总皂苷的提取工艺,具有实用价值。
2.3 滇重楼茎叶总皂苷的抗氧化活性分析
自由基拥有很高的反应活性,在生物体内能氧化细胞膜、变性蛋白质、甚至破坏DNA,进而损伤细胞和器官,甚至诱发多种慢性疾病危害健康,如动脉硬化、糖尿病和某些肿瘤等[17]。因此,需要抗氧化剂来清除多余的活性氧自由基以防止机体遭受氧化伤害。研究表明,皂苷具有抗氧化等多种生物活性[3]。
由图3 可知,在低浓度范围内,总皂苷溶液对自由基的清除率与样品浓度有明显的量效关系,清除率随浓度增加而增加;高浓度时,清除率趋于平缓。在6 mg/mL 时,总皂苷对DPPH 自由基清除率达98%,其IC50值为2.223 mg/mL。表明滇重楼茎叶总皂苷溶液具有很强的DPPH 自由基清除能力(图3A)。如图3B、C 所示,总皂苷对羟自由基和超氧阴离子清除活性较其对DPPH 的清除活性弱。在8 mg/mL 时,总皂苷对羟自由基和超氧阴离子的清除活性分别是58% 和64%,其IC50值分别为6.782 mg/mL 和4.638 mg/mL。表明滇重楼茎叶总皂苷溶液对羟自由基和超氧阴离子具有一定的清除能力。
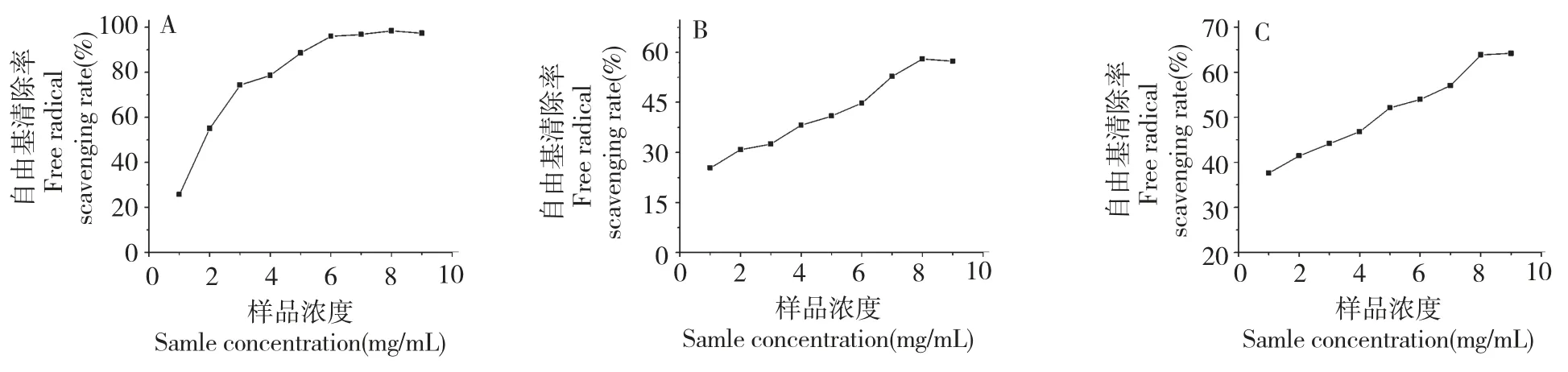
图3 总皂苷对DPPH(A)、羟自由基(B)和超氧阴离子(C)的清除能力Fig.3 DPPH (A),hydroxyl (B)and superoxide (B)radical scavenging activities of total saponins
3 结论
在单因素试验结果的基础上,采用响应面法优化得到超声辅助提取滇重楼茎叶总皂苷的最佳工艺条件为料液比1∶12(g/mL)、提取温度54 ℃、超声功率210 W、提取时间2 h,在此条件下进行3 次重复验证试验,滇重楼茎叶总皂苷平均得率为2.360%,与预测值的相对误差为1.04%。说明此优化工艺参数可靠,具有实用价值。
体外抗氧化试验结果表明,滇重楼茎叶总皂苷对DPPH 自由基、羟自由基和超氧阴离子均有较明显的清除效果,最大清除率分别为98%、58% 和64%,其IC50分别为2.223 mg/mL,6.782 mg/mL 和4.638 mg/mL。因此,滇重楼茎叶总皂苷具有较好的抗氧化活性。
1 China Pharmacopoeia Committee(国家药典委员会).Pharmacopoeia of People's Republic of China(中华人民共和国药典).Beijing:Chinese Medical Science and Technology Press,2010:243-244.
2 Hong Y(洪燕),Han YQ(韩燕全),Liu XG (刘向国),et al.Quality control ofPairsroot and advancement on pharmacological study.J Shanxi Coll Tradit Chin Med(山西中医学院学报),2014,14:66-69.
3 He HJ(何含杰),Zhang HY(章怀云),Chen LL(陈丽莉),et al.Polyphyllin pharmacological effects and clinical applications of research progress.J Chin Med Mater(中药材),2014,37:527-530.
4 Wu SS(武珊珊),Gao WY(高文远),Duan HQ(段宏泉),et al.Advances in studies on chemical constituents and pharmacological activities ofRhizoma Paridis.Chin Tradit Herb Drugs(中草药),2004,35:344-347.
5 Zeng WM(曾卫民),Zhao TZ(赵庭周).Analysis on utilization of stem and leaves growing on the ground ofParis polyphyallvar.yunnanensis.Chin Agric Sci Bull(中国农学通报),2012,28:266-270.
6 Pu W(卜伟),Zhao J(赵君),Shen ZQ(沈志强).Comparison of hemostatic,analgesic and anti-inflammatory effects of total saponins between the aerial and underground parts ofParis polyphyllavar.yunnanensis.Nat Prod Res Dev(天然产物研究与开发),2009,21:370-372.
7 Lin HC(林海成),Zhu HY(祝洪艳),He ZM(何忠梅),et al.Optimization of extraction technology for total saponins fromZiziphi spinoseasemen by orthogonal test.Chin J Exp Tradit Med Form(中国实验方剂学杂志),2014,21:22-25.
8 Zhao Y(赵岩),Yu T(于婷),Jin DM(金达明),et al.Enzymatic extraction of ginsenosides.Shanghai J Tradit Chin Med(上海中医药杂志),2014,48:103-113.
9 Ouyang LN(欧阳丽娜),Li LL(李兰林),Wu X(吴雪),et al.Saponins microwave extraction process orthogonal designPanax japonicus.Chin Tradit Herb Drugs(中草药),2010,41:1639-1642.
10 Gao X(高侠),Li YX(黎云祥),Cai LY(蔡凌云),et al.Ultrasonic-assisted solvent extraction of total saponins fromAcanthopanan trifoliatusleaves.Food Sci(食品科学),2009,30:69-72.
11 Pang TC(庞庭才),Hu SY(胡上英),Zhong QP(钟秋平),et al.Response surface optimization of ultrasound-assisted extraction of flavonoids from nutshell ofHeritiera littoralisDryand.J Chin Med Mater(中药材),2014,37:2290-2294.
12 Xie XJ(谢小俊),Lin LZ(林乐珍),Zheng GD(郑国栋).Extraction technology of polyphenols fromSmilax chinaL.by ultrasonic method.Food Sci Technol(食品科技),2014,39:231-234.
13 Wang J(王俊),Yang KD(杨克迪),Chen J(陈钧).Determination of diosgenin by spectrophotometry.Anal Lab(分析试验室),2004,23:73-75.
14 Liu F,Liu WH,Tian SG.Artificial neural network optimization ofAlthaea roseaseeds polysaccharides and its antioxidant activity.Int J Biol Macromole,2014,70:100-107.
15 Saeed T.Optimization of polysaccharides fromZagros oakleaf using RSM:Antioxidant and antimicrobial activities.Carbohydr Polym,2014,106:238-246.
16 Chen JJ,Zhang T,Jiang B.Characterization and antioxidant activity ofGinkgo bilobaexocarp polysaccharides.Carbohydr Polym,2012,87:40-45.
17 Maritim AC,Sanders RA,Watkins JB.Diabetes,oxidative stress,and antioxidants:a review.J Biochem Mole Toxicol,2003,17:24-38.

