氨氯地平抑制小鼠黑色素瘤高转移细胞株B16体内转移的作用及相关机制研究
张 旭 ,艾志国,扶 玲(惠州市中心人民医院药剂科,广东 惠州 516000)
恶性肿瘤最显著的生物学标志就是肿瘤的侵袭和转移,肿瘤一旦发生侵袭和转移,则病死率极高。影响肿瘤侵袭、转移的因素有很多,其中最让人关注的就是白细胞介素8(interleukin-8,IL-8)。IL-8 为肿瘤治疗的新靶点。IL-8 最初定义为中性粒细胞趋化因子,是一种多功能趋化因子,在炎症中有重要作用,后来还发现其可促进细胞有丝分裂与血管生成[1-2]。目前,很多肿瘤细胞均可高表达IL-8,且肿瘤细胞株转移和浸润能力与IL-8 表达程度称负相关。研究结果显示,IL-8 与肿瘤的生长、浸润、转移成一定的相关性,乳腺癌、结肠癌、肺癌等肿瘤均呈IL-8 高表达[3]。近几年来的研究结果显示,IL-8 的表达与细胞内Ca2+离子水平相关;其中,某些诱导型的IL-8 有钙离子浓度依赖性,如氧化型胆固醇诱导的IL-8分泌,给予钙通道阻滞剂可以显著抑制IL-8 的分泌和其信使核糖核酸(mRNA)水平的表达[4]。由此可推测,细胞内钙离子水平对恶性肿瘤侵袭、转移有极其重要的意义。氨氯地平为二氢嘧啶类钙通道阻滞剂,研究结果表明,氨氯地平可抑制人乳腺癌细胞MDA-MB-231 的侵袭,但具体机制尚不明确[5]。本实验采用黑色素瘤高转移细胞株B16 为侵袭株,研究不同剂量氨氯地平抑制肿瘤转移的作用及其相关机制。
1 材料与方法
1.1 实验动物与肿瘤细胞株
C57 BL/6J 小鼠,7 周龄,体质量18 ~20 g,来源于重庆医科大学动物中心;细胞株:黑色素瘤高转移细胞株B16,由重庆医科大学超声研究所提供。
1.2 药品与试剂
苯磺酸氨氯地平片(浙江新赛科药业有限公司,批号:H20010699);兔抗鼠IL-8 抗体(购自北京博奥森生物技术有限公司);DAB 显色试剂盒和SP-9000 通用型检测试剂盒(均购自北京中杉金桥生物技术有限公司);BCA 蛋白定量检测试剂盒(购自美国Hyclone 公司);IL-8 的上下游引物(由上海生物工程有限公司合成);mRNA 抽提TRIzol 试剂盒,逆转录-聚合酶链反应(RT-PCR)检测试剂盒(Toyobo 公司);其他试剂均为分析纯,符合实验要求。
1.3 方法
1.3.1 制作模型:将肿瘤细胞(1 ×106/L)接种在小鼠腋下,待肿瘤长至1 cm3时在无菌环境中取出肿瘤。制成单细胞悬液,浓度约为2 ×107/L。取出该悬液0.20 ~0.25 ml,分别接种于小鼠右腹股沟。对照组小鼠给予0.9%氯化钠注射液;治疗组小鼠给予不同剂量的氨氯地平(1、3、10 mg/kg),统计小鼠肿瘤生长情况及身体情况。
1.3.2 抑瘤作用:统计药物对肿瘤的抑制作用。各组小鼠接种后22 d,取出肿瘤称其质量并计算抑瘤率,抑瘤率(%)=(1 -实验组瘤质量/对照组瘤质量)×100%。
1.3.3 IL-8 蛋白表达:用免疫组织化学法,将肿瘤组织包埋于石蜡中,常规脱蜡,给予枸橼酸抗原修复;然后滴加30 ml/L H2O2去离子水于室温下孵育15 min;山羊血清封闭;倾去血清,滴加兔抗鼠IL-8 抗体(1 ∶100 稀释)放入冰箱过夜;加入山羊抗鼠免疫球蛋白G(IgG,含辣根过氧酶标记);二氨基联苯胺(DAB)染色,苏木精复染,脱水,透明封固;其中阳性标准为胞膜和胞浆有棕黄色颗粒沉着。用Imagepro Plus 5.0 图像分析软件,测量其累积光密度值,光密度值越大,反映细胞内蛋白免疫活性(表达)越高。
1.3.4 IL-8 的mRNA 表达:取各组肿瘤组织匀浆,TRIzol 剂一步法提取组织中总RNA,紫外分光光度法测定总RNA 的含量和纯度。内参照为β 肌动蛋白(β-actin),半定量RT-PCR 法检测IL-8 的mRNA 表达。IL-8 引物序列:上游引物5'-TACTCCAAACCTTT CCACCC-3',下游引物3'-AACTTCTCCACA ACCCTCTG-5,扩增片断长度为155 bp;β-action 引物:上游引物 5' GAGCTATGAG CTGCCTGACG' 3,下 游 引 物 3'-GTAGCACCTGGCGTTCACGA-5',产物长度为517 bp;25 μl 体系,互补脱氧核糖核酸(cDNA)为2.5 μl,上、下游引物各0.5 μl,其余试剂按检测试剂盒定量加入。预变性5 min,进入PCR 循环,循环参数:变性94 ℃、30 s,退火52 ℃,72 ℃延伸30 s,30 个循环,72 ℃延伸5 min。2%琼脂糖凝胶电泳,凝胶成像仪观察,半定量法分析DNA 灰度值,目的条带与内参β-action灰度值之比,即为目的基因的相对mRNA 含量。
1.4 统计学方法
采用SPSS 11.0 统计软件对数据进行分析,计量资料采用均数±标准差(¯x±s)表示,数据处理采用单因素方差分析,各组均数间的比较采用t检验,P<0.05 为差异有统计学意义;采用IPP 软件分析免疫组织化学结果。
2 结果
2.1 各组小鼠的抑瘤情况比较
各个剂量的氨氯地平均对肿瘤有抑制作用,且呈现出一定的剂量依赖性。与对照组比较,氨氯地平各剂量组小鼠的抑瘤情况与对照组比较,差异均有统计学意义(P<0.01),见表1。

表1 各组小鼠的抑瘤情况比较(¯x±s)Tab 1 Tumor inhibition rate in each group(¯x±s)
2.2 氨氯地平对IL-8 蛋白表达的影响
与对照组比较,治疗组小鼠IL-8 蛋白表达阳性数较少;随着氨氯地平给药剂量的加大,小鼠IL-8 蛋白表达阳性数减少呈现一定的剂量依赖性,各组差异均有统计学意义(P<0.05),见图1。
2.3 氨氯地平对IL-8 的mRNA 表达的影响
通过RT-PCR 电泳条带的灰度值来判断IL-8m 的RNA 表达,采用凝胶成像系统系统分析软件计算。结果显示,与对照组比较,治疗组小鼠IL-8 的mRNA 表达降低,且随着剂量的增加,IL-8 的mRNA 表达逐渐降低,见图2。
3 讨论
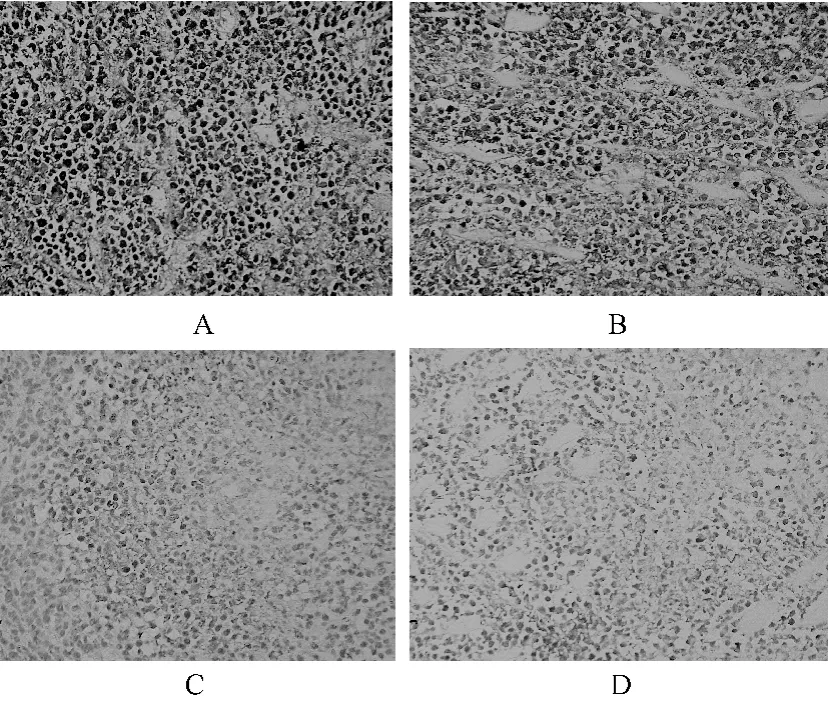
图1 不同剂量氨氯地平对小鼠肿瘤组织中IL-8 蛋白表达的影响(1 ×200)Fig 1 Effects of different dose of amlodipine on the expression level of IL-8 protein in each group(1 ×200)
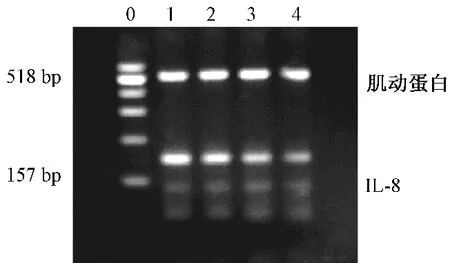
图2 不同剂量氨氯地平对小鼠肿瘤组织中IL-8 的mRNA 表达的影响Fig 2 Effects of different dose of amlodipine on the mRNA expression of IL-8
恶性肿瘤具有的侵袭和转移的特点,是其病死率极高、预后差的重要原因。肿瘤的侵袭、转移最关键的步骤是肿瘤血管的生成,该过程包括微血管基底膜蛋白水解、内皮细胞增生、迁移管状结构形成和成熟,这一过程是由很多血管生成因子如血管内皮生长因子、碱性成纤维细胞生长因子或血管生成抑制因子如INF-Y、ERL-CXC 的释放引起的。IL-8 是一种趋化因子,对炎症反应和免疫过程的调节起重要作用[6]。IL-8的表达强度与肿瘤组织(细胞)生长、侵袭和转移成正相关,IL-8 在肿瘤过程中参与很多环节,它被发现可以促进肿瘤生长,相关的作用机制可能与其自分泌作用或促进血管生长有关[7]。趋化因子通过两个方面对肿瘤产生影响,一是使免疫细胞活化,抑制血管的增生,从而产生抗肿瘤作用;二是促进肿瘤生长,增加肿瘤活性,使细胞外基质消化功能增加,从而进一步促进肿瘤的生长、侵袭、转移[8]。有研究认为,IL-8 在多种肿瘤的生长、转移过程中发挥了重要作用[9-11]。研究结果显示,IL-8 可以促进肿瘤血管的形成:转染IL-8 后的细胞培养液可以刺激人脐静脉内皮细胞增殖,同时该细胞可以促使裸鼠体内形成的肿瘤生长速度快,且血管丰富[12]。Heidmenan等[13]的研究结果表明,IL-8 可使血管的通透性增加,可促进肿瘤的浸润与转移。另外,IL-8 也可促进乳腺癌、非小细胞肺癌、卵巢癌、黑色素瘤等细胞的增生、迁移。一系列的研究结果显示,IL-8 以某种分泌形式作用于肿瘤细胞,从而产生促进肿瘤的生长、浸润与转移的作用。因此近几年来,将IL-8 作为肿瘤治疗的新靶点的研究备受关注。
本研究结果显示,氨氯地平对肿瘤的体内生长有一定的抑制作用,与前期的体外研究结果一致[14]。抑制肿瘤生长是抑制肿瘤转移的基础。在氨氯地平给药期间,小鼠整体生存状态良好,明显优于对照组,并且氨氯地平并未显示出明显的毒副作用。氨氯地平对肿瘤的抑制作用机制很可能与其通过阻断钙离子通道,下调IL-8 的转录有关,使其所介导的一系列肿瘤的转移和侵袭均受到一定程度的影响。但具体机制尚不明确,有研究分析IL-8 与肿瘤的抑制和抗转移作用,可能与抑制细胞凋亡、调节细胞外基质及其自分泌作用有关。
一方面,IL-8 可在白血病患者的B 细胞呈高表达,使白血病细胞的生存延长,可能是通过上调B 淋巴细胞瘤-2 基因的表达,抑制细胞凋亡,从而发挥效应。另一方面,研究结果表明,IL-8 可通过上调细胞及其相关基质黏附蛋白的表达,从而参加恶性肿瘤细胞的侵袭和转移过程。研究发现,IL-8 通过与肿瘤细胞膜上受体结合而促进肿瘤生长,并可提高肿瘤组织生长速度,促进肿瘤转移的发生,IL-8 若在肝癌患者中呈高表达,则其恶性程度高,预后极差,但具体机制尚需进行进一步的实验证明[15]。
[1] Baggiolini M,Walz A,Kunkel SL. Neutrophil-activating peptide-l/interleukin 8,a novel cytokine that activates neutrophils[J].J Clin Invest,1989,84(4):1045-1049.
[2] Koch AE,Polverini PJ,Kunkel SL,et al. Interleukin-8 as a macrophage-derived mediator of angiogenesis[J]. Science,1992,258(5089):1798-1801.
[3] Ebisuya M,Kondoh K,Nishida E. The duration,magnitude and compartmentalization of ERK MAP kinase activity:mechanisms for providing signaling specificity[J]. J Cell Sci,2005,118(Pt 14):2997-3002.
[4] Lemaire-Ewing S,Berthier A,Royer MC,et al.7beta-hydroxycholesterol and 25-hydroxycholesterol-induced interleukin-8 secretion involves a calcium-dependent activation of c-fos via the ERK1/2 signaling pathway in THP-1 cells:oxysterols-induced IL-8 secretion is calcium-dependent[J].Cell Biol Toxicol,2009,25(2):127-139.
[5] 徐兴华,孙文娟,周岐新,等. 氨氯地平对人乳腺癌细胞株MDA-MB-231 侵袭影响的体外实验[J]. 第三军医大学学报,2008,30(4):340-242.
[6] Kitadai Y,Takahashi Y,Haruma K,et al.Transfection of interl-eukin-8 increases angiogenesis and tumor genesis of human gastric carcinoma cells in nude mice[J].Br J Cancer,1999,81(4):647-653.
[7] Heidemann J,Ogawa H,Dwinell MB,et al. Angiogenic effects of interleukin 8(CXCL8)in human intestinal microvascular endothelial cells are mediated by CXCR2[J]. J Biol Chem,2003,278(10):8508-8515.
[8] Lee CY,Huang CY,Chen MY,et al. IL-8 increases integrin expression and cell motility in human chondrosarcoma cells[J]. J Cell Biochem,2011,112(9):2549-2557.
[9] Lee YS,Choi I,Ning Y,et al.Interleukin 8 and its receptor CXCR2 in the tumor microenvironment promote colon cancer growth,progression,and metastasis[J].Br J Cancer,2012,106(11):1833-1841.
[10] 高伟,赵晓霞,郭绪晓. 肺癌患者血清IL-6、IL-8 及TNF-a 的表达及临床意义[J].河北医药,2012,34(4):487-488.
[11] 杨同宁,于超,李佳佳,等.IL-8 对肺腺癌A549 细胞迁移的影响及其机制探讨[J].中国细胞生物学学报,2011,33(10):1102-1108.
[12] Wang J,Pan HF,Hu YT,et al.Polymorphism of IL-8 in 251 allele and gastric cancer susceptibility:a meta-analysis[J]. Dig DisSci,2010,55(7):1818-1823.
[13] Palella C,Hamilton DH,Fernando RI. Influence of IL-8 on the epithelial-mesenchymal transition and the tumor microenvironment[J].Future Oncol,2012,8(6):713-722.
[14] 李卫平,黄文静,孙洋,等.氨氯地平对小鼠肝癌H22 细胞的抑制作用及其机制[J].中国生物制品学杂志,2010,23(4):408-411.
[15] Li A,Duhey S,Varney ML,et al. IL-8 directly enhanced endothelial cell survival,proliferation and matrix metalloproteinases production and regulated angiogenesis[J].J Tmmunol,2003,170(6):3369-3376.

