胸腺五肽辅助治疗肺癌对免疫功能影响及其疗效的系统评价
李怡斯敖舒婷金 言
1(中国科学院深圳先进技术研究院 深圳 518055)
2(暨南大学药学院 广州 510632)
胸腺五肽辅助治疗肺癌对免疫功能影响及其疗效的系统评价
李怡斯1,2敖舒婷2金 言1
1(中国科学院深圳先进技术研究院 深圳 518055)
2(暨南大学药学院 广州 510632)
为了系统地评价胸腺五肽作为辅助药物治疗各种肺癌的疗效及其对机体免疫功能的影响,利用电子检索收集有关胸腺五肽联合放疗或化疗方案治疗肺癌的临床随机对照试验文献,对符合纳入标准的文献,采用RevMan5.3 软件进行系统评价。最终共纳入文献 9 篇,总样本量 784 例。Meta 分析结果表明,胸腺五肽作为辅助药物治疗各种肺癌提高总有效率的差异无统计学意义[OR=1.44, 95%CI(0.99, 2.10),P=0.06>0.05]。在对免疫功能的影响方面,胸腺五肽的使用显著增高外周血中的 CD3+细胞水平[OR=5.88, 95% CI(2.34, 9.42),P=0.001],CD4+细胞水平也显著上升[OR=8.32, 95%CI(5.22, 11.42),P<0.00001],CD4+/CD8+比值也有明显的提高[OR= 0.38, 95% CI(0.18, 0.59),P= 0.0002],但 CD8+细胞水平的差异无统计学意义[OR=-3.12, 95% CI (-9.02, 2.79),P>0.05]。总的来说,本研究在一定程度上反映了在辅助治疗肺癌方面,胸腺五肽能显著提高外周血中的 CD3+细胞水平、CD4+细胞水平、CD4+/CD8+比值。而对于治疗的有效率、CD8+细胞水平,差异无统计学意义。
胸腺五肽;肺癌;免疫功能;疗效;系统评价
1 引 言
世界卫生组织 2014 年公布的数据表明,癌症是全世界死亡的主要原因之一,而肺癌的发病率和死亡率已经超过其他癌症居于第一位,严重地威胁着人类的健康[1]。由于多数患者确诊时已经处于中晚期,往往不适宜手术,化疗和治疗成为主要治疗手段。而无论使用何种治疗手段,在杀伤肿瘤细胞的同时,正常的细胞也会受到损伤,从而引起一系列的不良反应,如恶心、呕吐、骨髓抑制和脱发等。其中,骨髓抑制会减少免疫细胞的数量及活性,从而使机体免疫功能下降,不但使患者更容易受到严重感染,更减弱了免疫系统对于肿瘤细胞的监控作用。此外,恶性肿瘤的生长过程本身也能引起免疫系统的功能减弱,使免疫系统对肿瘤细胞的抑制能力进一步下降,肿瘤的生长更难控制。因此,在恶性肿瘤的治疗中或治疗后,如何保护和重建机体的免疫系统,提高免疫功能是十分重要的一个环节。
胸腺肽是胸腺组织上皮细胞分泌的具有生物学活性的多种肽类的总称。目前常用的胸腺肽主要有以下几种:胸腺素 α1(Tα1)、胸腺生成素(TP)、胸腺体液因子(THF)和血清胸腺因子(FTS)[2]。其中,TP 是从人胸腺组织中分离出的含 49 个氨基酸的多肽,而胸腺五肽(TP5)是 TP的 32~36 位残基片段,残基顺序为 Arg-Lys-Asp-Val-Tyr,仍具有与 TP 相同的活性。胸腺五肽具有双向调节的作用,免疫功能受损或受到抑制时能增强免疫作用,免疫反应过强时能下调免疫强度从而使机体水平趋向正常,因此成为一种重要的免疫调节剂[3-6]。胸腺五肽以尚未发现明显不良反应的优势作为辅助化疗的药物被广泛应用于临床,并有临床试验报导其有效性。但其作为化疗药物的辅助药物治疗肺癌尚缺乏大样本多中心的随机对照试验,同时其临床疗效无可靠的循证医学证据支持,从而导致其有效性得不到保证。本研究以循证医学为指导,根据从数据库中搜索到的有关胸腺五肽的随机对照实验,对其作为辅助药物治疗各种肺癌时对机体免疫功能的影响和治疗效果进行系统评价。
2 实验方法
2.1 检索策略
中文文献在中国知网检索,以“胸腺五肽 AND 肺癌 AND (临床研究 OR 疗效观察 OR临床观察 OR 疗效分析 OR 疗效评价 OR 免疫功能)”检索。英文文献在 Google Scholar 以“Thymopentin AND lung cancer”检索。筛选获取文献后对所选文献的参考文献进行二次检索。
2.2 纳入标准
2.2.1 研究类型
纳入研究均为公开发表的随机对照试验,尚不考虑是否采用盲法。
2.2.2 研究对象
经病理学或细胞学确诊为肺癌的患者。
2.2.3 干预措施
对照组给予临床常规放疗或化疗,实验组在对照组的治疗基础上给予胸腺五肽辅助治疗。
2.2.4 结局指标
(1)总有效率(CR+PR)
按照 1979 年世界卫生组织(World HealthOrganization)制订的疗效判断标准或国际联盟癌症标准分为完全缓解(CR)、部分缓解(PR)、无变化(NC)、进展(PD)四种。
(2)比较治疗后外周血 T 细胞亚群:CD3+、CD4+、CD8+细胞数及 CD4+/CD8+比值。
2.3 排除标准
文献符合排除标准任意一条均认为该研究不应被纳入:(1)不满足纳入标准;(2)实验组与对照组相比除使用胸腺五肽外还使用其他药物。
2.4 资料提取
由两名评价员独立用统一的表格对每篇符合纳入标准的文献进行资料提取和质量评价,如遇分歧通过讨论解决。提取的信息包括作者、发表时间、病例数、确诊肺癌类型、治疗措施、给药方案、治疗时间、总有效率,外周血中 CD3+细胞水平、CD4+细胞水平、CD8+细胞水平、CD4+/CD8+比值。
2.5 文献质量评价
纳入随机对照试验的方法学质量评价采用Cochrane 协作网偏倚风险评价标准进行评价。其中随机对照实验的方法学质量评价包括:(1)是否采用随机分配方法;(2)是否实施分配方案隐藏;(3)是否使用盲法;(4)是否选择性报告研究结果;(5)是否有失访或退出;(6)是否有其他偏倚来源。纳入的 9 项研究均为随机对照试验,其中两项阐明了具体的随机方法,但均未提及分配隐藏、是否使用盲法以及其他偏倚来源(见图 1)。
2.6 统计分析
本研究应用 RevMan 5.3 软件进行数据处理,资料采用比值比(OR)及其 95%CI 为分析统计量。首先使用I2定量分析异质性大小,当P>0.05,I2<50% 时认为异质性较小,利用固定效应模型进行合并分析;当P<0.05,I2>50% 时,各研究间存在异质性,分析导致异质性的原因,如设计方案、测量方法、用药剂量、用药方法等因素是否相同,若经过分析处理后未找到导致异质性的原因或导致异质性的因素不可消除时,则可采取随机效应模型进行分析。
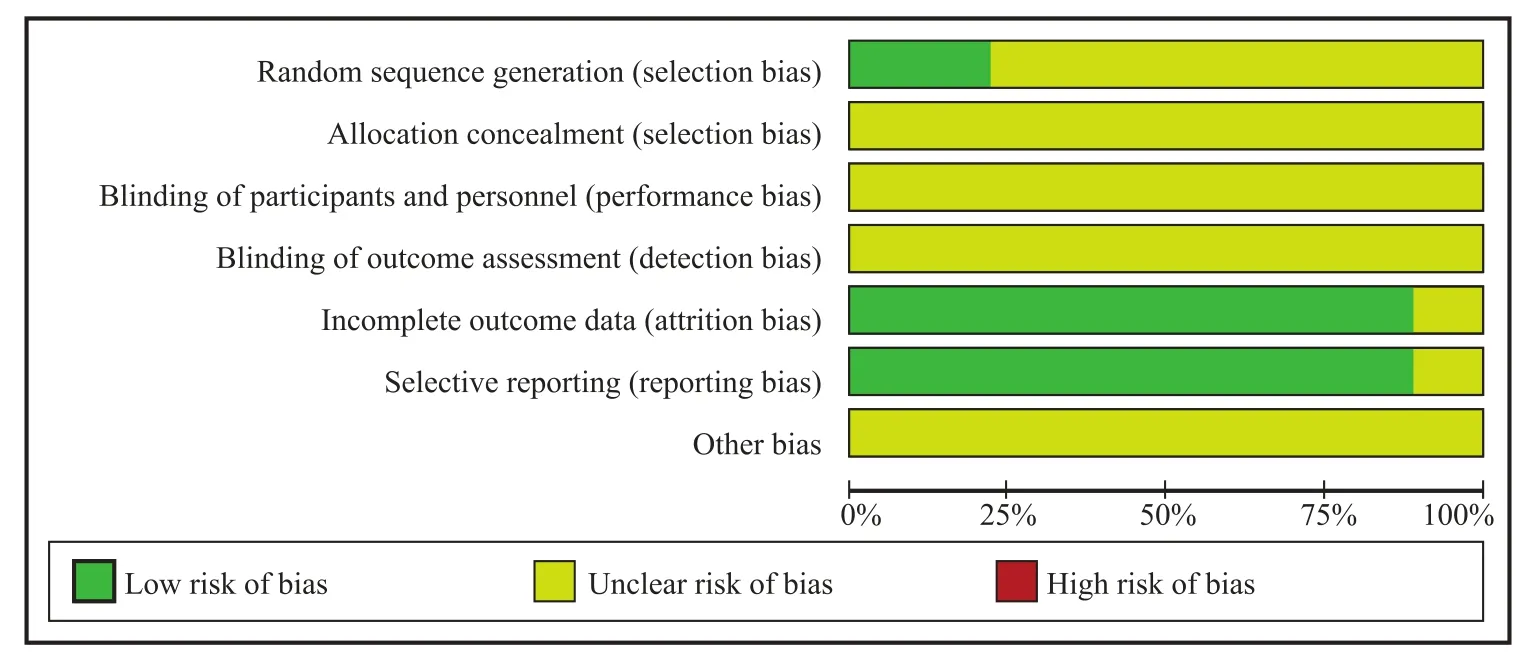
图 1 文献质量评价Fig. 1 Quality assessment of studies
3 结 果
3.1 文献检索结果
根据检索式结合计算机以及人工检索检出相关文献 258 篇,剔重后得到 248 篇。随后根据纳入排除标准、阅读文题和摘要、及进一步阅读全文后纳入相应文献 9 篇。在随后的二次检索中未纳入新增文献,最终纳入 9 项随机对照试验(RCT)。
3.2 纳入研究的一般情况
文献的筛选结果及结局指标如表 1 和表 2 所示,共纳入文献 9 篇[7-15],病例数总共 784 例。其中,实验组 389 例,对照组 395 例。结局指标包括总有效率(完全缓解+部分缓解)和治疗后外周血 T 细胞亚群(CD3+、CD4+、CD8+细胞数及CD4+/CD8+比值)。
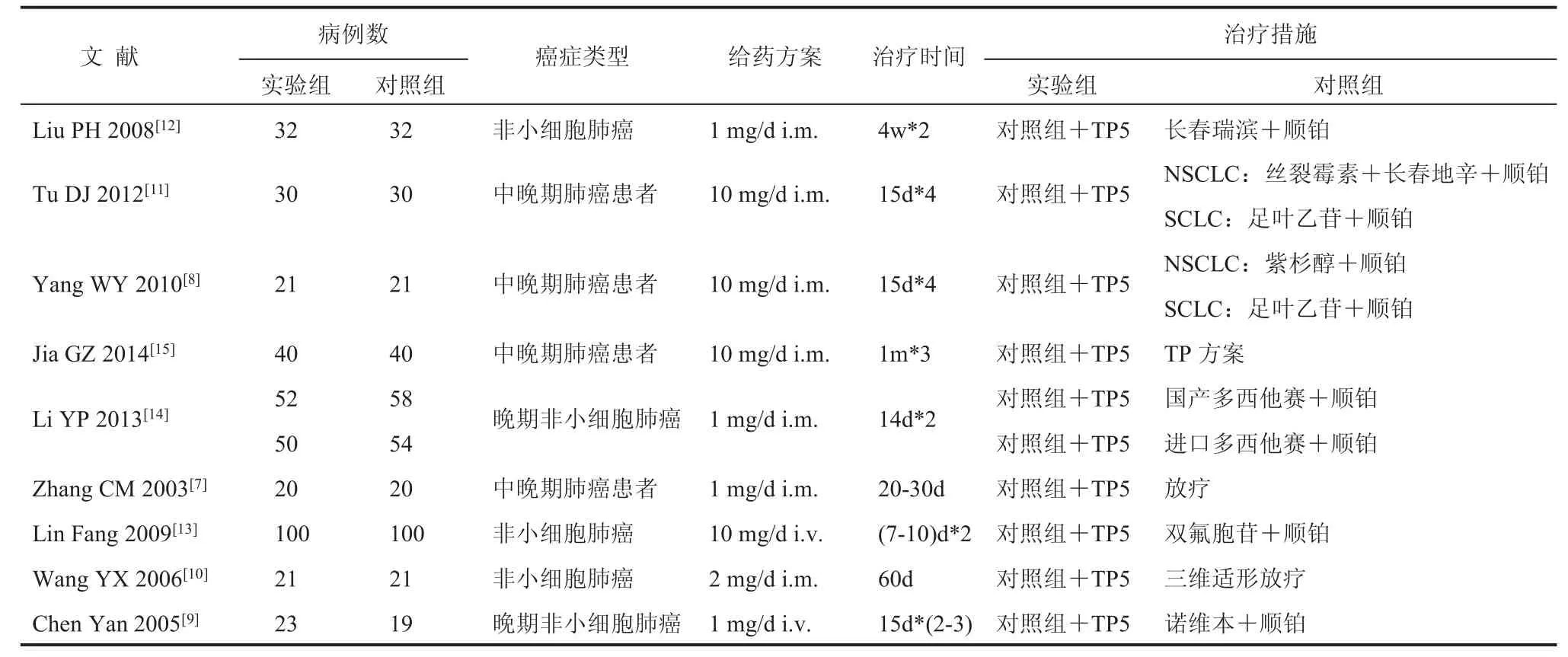
表 1 纳入文献基本情况Table 1 Basic information of included studies
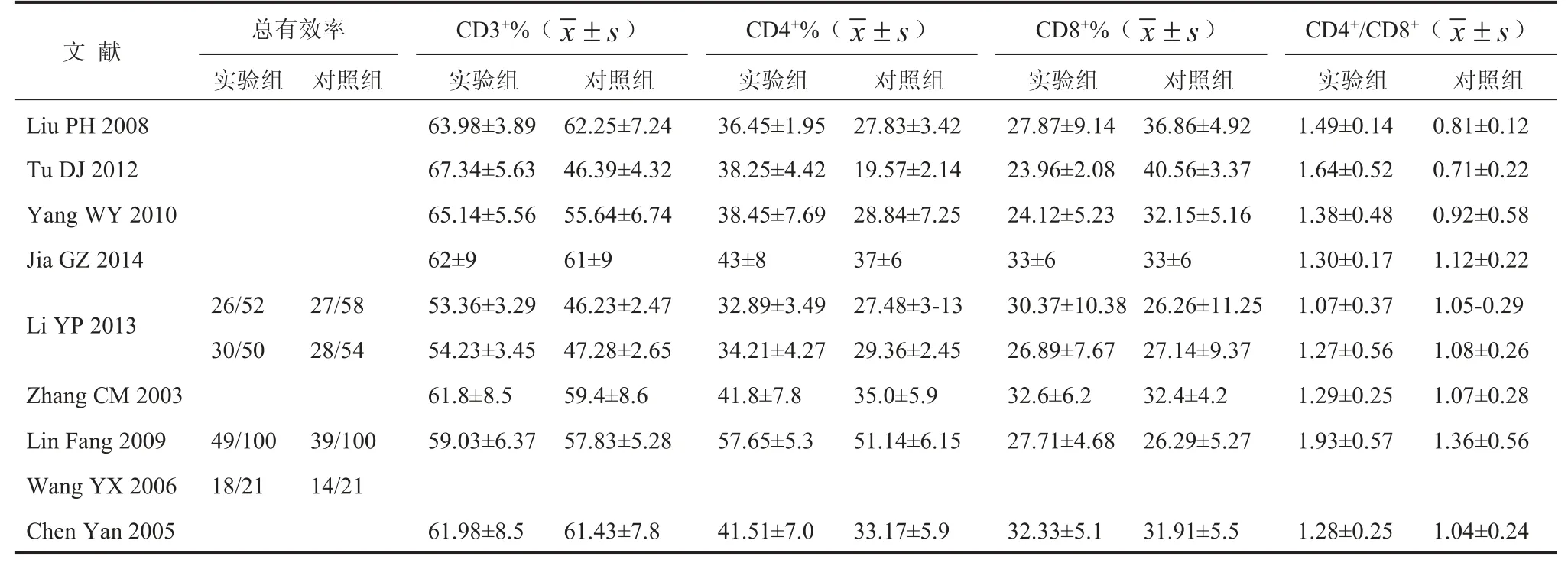
表 2 结局指标基本情况Table 2 Basic information of outcomes
3.3 Meta 分析结果
3.3.1 总有效率
总有效率是病人用药后完全缓解率与部分缓解率的总和,是判断药物是否有效的重要指标。本研究纳入的文献中有 3 个研究报告了患者的总有效率,各研究间统计学没有异质性(x2=1.27,P> 0.05,I2=0%),采用固定效应模型进行统计分析。Meta 分析结果显示差异无统计学意义[OR=1.44, 95%CI(0.99, 2.10),P=0.06>0.05],结果见图 2。
3.3.2 CD3+水平
CD3+代表总 T 细胞,在免疫抗肿瘤中发挥着重要的调控作用。本研究纳入的文献中 8 个研究报告了患者的 CD3+水平,各研究间统计学有异质性(x2=193.19,P<0.00001,I2=96%),采用随机效应模型进行统计分析。Meta 分析结果显示差异有统计学意义[OR=5.88, 95% CI(2.34, 9.42),P=0.001],实验组效果优于对照组,结果见图 3。3.3.3 CD4+水平
CD4+代表辅助性 T 细胞,促进其他 T 细胞亚群的成熟和 B 细胞分泌抗体。本研究纳入的文献中 8 个研究报告了患者的 CD4+水平,各研究间统计学有异质性(x2=185.78,P<0.00001,I2=96%),采用随机效应模型进行统计分析。Meta 分析结果显示差异有统计学意义[OR=8.32, 95%CI(5.22, 11.42),P<0.00001],实验组效果优于对照组,结果见图 4。
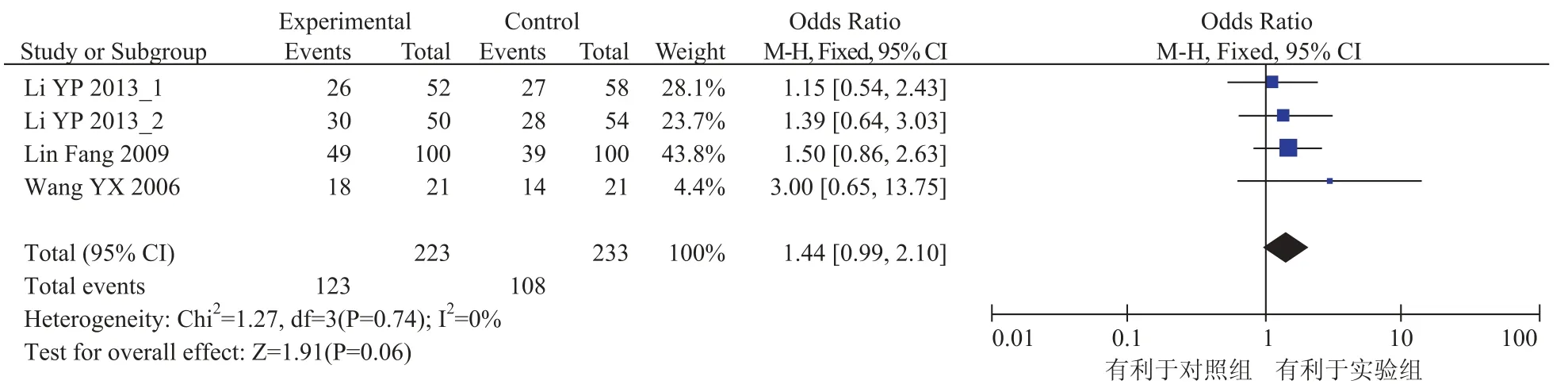
图 2 总有效率结果Fig. 2 Outcome of curative effect
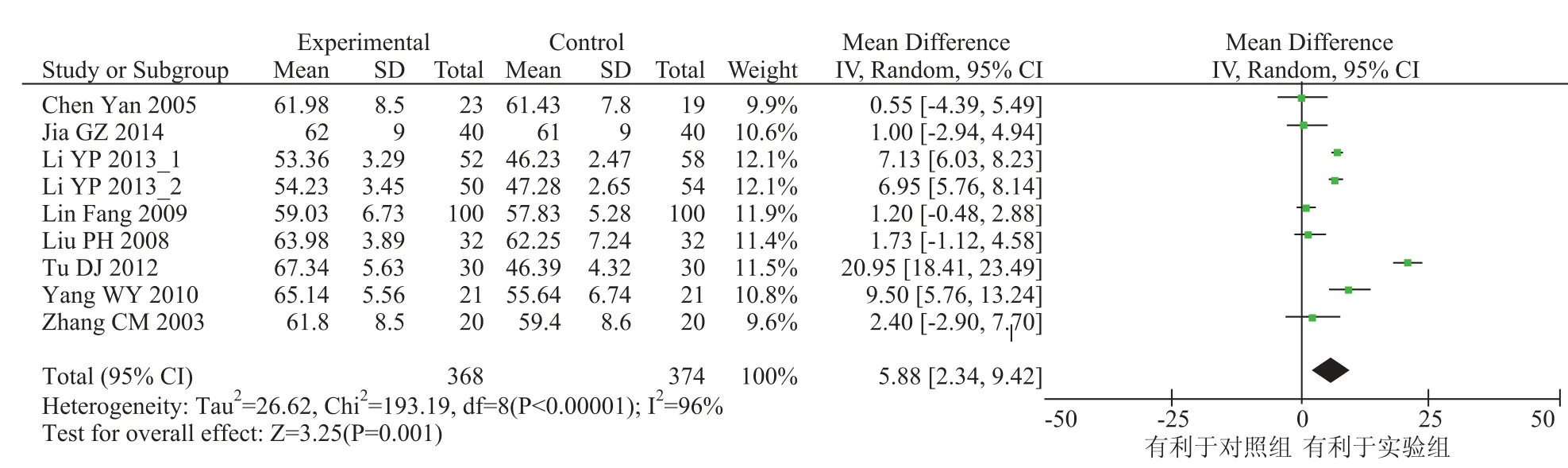
图 3 CD3+水平结果Fig. 3 Outcome of CD3+cell level
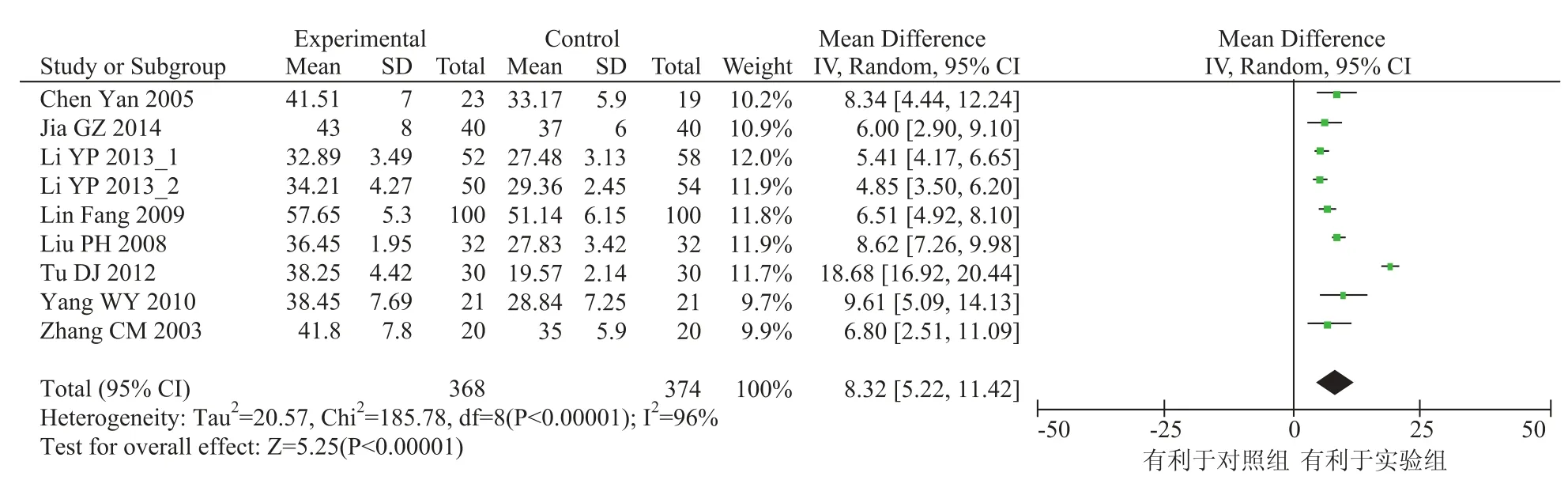
图 4 CD4+水平结果Fig.4 Outcome of CD4+cell level
3.3.4 CD8+水平
CD8+是细胞毒性 T 细胞和抑制性 T 淋巴细胞的表面标志,能抑制其他 T 细胞亚群和 B 细胞的活性,并能与抗原结合杀伤靶细胞。本研究纳入的文献中 8 个研究报告了患者的 CD8+水平,各研究间统计学有异质性(x2=408.55,P<0.00001,I2=98%),采用随机效应模型进行统计分析。Meta 分析结果显示差异无统计学意义[OR=-3.12, 95% CI(-9.02, 2.79),P>0.05],结果见图 5。3.3.5 CD4+/CD8+比值
CD4+/CD8+的比值对机体的特异性免疫起重要调节作用,其下降标志着 T 辅助细胞相对不足,与肿瘤的发生发展有密切的关系。本研究纳入的文献中 8 个研究报告了患者的 CD4+/CD8+比值,各研究间统计学有异质性(x2=179.01,P<0.00001,I2=96%),采用随机效应模型进行统计分析。Meta 分析结果显示差异有统计学意义[OR=0.38, 95% CI(0.18, 0.59),P=0.0002],实验组效果优于对照组,结果见图 6。
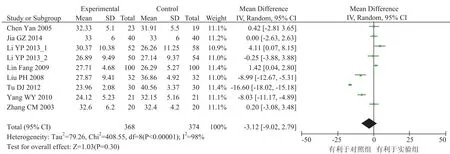
图 5 CD8+水平结果Fig. 5 Outcome of CD8+cell level
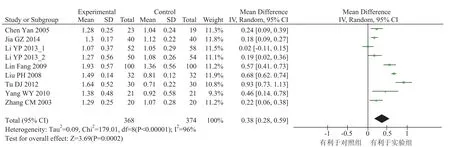
图 6 CD4+/CD8+比值Fig. 6 Outcome of CD4+/CD8+ratio
4 讨 论
免疫功能在机体中起重要作用,尤其对于恶性肿瘤患者,无论是肿瘤本身还是放化疗的影响,都会使机体的免疫功能受到抑制。而肿瘤的发生和机体的抗肿瘤免疫应答以及免疫监视密切相关,其中 T 淋巴细胞在肿瘤免疫中起中心调控的作用。T 细胞是一种淋巴细胞,在维持机体免疫自稳中发挥重要作用。其中,CD3+T 细胞代表总 T 细胞,在免疫抗肿瘤中发挥着重要的调控作用;CD4+T 细胞代表 T细胞辅助诱导亚群,能通过细胞接触依赖机制或抑制性细胞因子依赖机制发挥免疫调节、抑制功能[16];CD8+是细胞毒性 T 细胞和抑制性 T 淋巴细胞的表面标志,能抑制其他 T 细胞亚群和 B 细胞的活性,并能与抗原结合杀伤靶细胞;CD4+/CD8+的比值对机体的特异性免疫起重要调节作用,正常情况下其比值应维持动态平衡,该平衡决定了免疫反应的发生与否、发生的类型以及发生的总效应[13],其下降标志着 T 辅助细胞相对不足,与肿瘤的发生发展有密切的关系。因此,在化疗的同时使用免疫增强剂对患者的治疗能起积极作用。
本研究的 Meta 分析结果显示,各种类型的肺癌患者联合胸腺五肽治疗后,患者外周血中CD3+细胞的比例、CD4+细胞的比例、CD4+/ CD8+的比值明显比对照组升高,说明胸腺五肽在辅助化疗时能有效地提高免疫功能。但对于治疗的有效率及 CD8+的细胞比例,统计分析表明其差异无统计学意义。但本文纳入的 9 项研究中,只有 3 项研究对其总有效率进行了报道,共计 456 例,且分析结果P=0.06,所以对于胸腺五肽辅助治疗对总有效率的影响还需更多高质量的临床试验、更大的多中心的样本量去证实。而对于外周血中 T 细胞亚群的统计分析,共纳入 8项研究,其中只有两篇文章阐明其随机分组方法,其余的均仅有“采用随机分组字样”;无一篇文献提及是否分配隐藏;且均未提及是否使用盲法,检测手段受人为因素影响较大;多为小样本试验,还存在一定的局限性。而统计结果也显示出了很大的异质性,因为文献数目不多,病例数较少,无法进行亚组分析,无法消除其异质性。
综上,由于目前国内临床试验规范性较差,未收集到国外英文文献,收集到的研究文献质量不高,且与胸腺五肽合并用药的治疗手段并不统一,导致结果的偏倚性较大。此外,本研究只是对现有的资料进行综合分析,尚需对今后发表的文章进一步跟踪收集,才能得到更准确的结果。
[1] Stewart B, Wild CP. World Cancer Report 2014 [M]. IARC Nonserial Publication, 2015.
[2] 杨玲媛, 谢青梅, 毕英佐. 胸腺肽研究进展 [J]. 动物医学进展, 2008, 29(10): 57-60.
[3] Stiller MJ, Shupack JL, Kenny C, et al. A doubleblind, placebo-controlled clinical trial to evaluate the safety and efficacy of thymopentin as an adjunctive treatment in atopic dermatitis [J]. Journal of the American Academy of Dermatology, 1994, 30(4): 597-603.
[4] Merigan TC, Hirsch RL, Fisher AC, et al. The prognostic significance of serum viral load, codon 215 reverse transcriptase mutation and CD4+T cells on progression of HIV disease in a double-blind study of thymopentin [J]. AIDS, 1996, 10(2):159-165.
[5] 赵新, 曾令源, 尹序德, 等. 胸腺五肽在肿瘤化疗中的免疫调节作用 [J]. 四川肿瘤防治, 2002, 15(1): 12-15.
[6] 陈静, 陈青, 黄之杰, 等. 胸腺五肽在老年晚期肿瘤化疗中的辅助治疗作用 [J]. 中国老年学杂志, 2004, 10(24): 956.
[7] 张楚敏, 黄玉忠, 王建华. 中晚期肺癌体外放疗合并使用胸腺五肽临床观察 [J]. 中国误诊学杂志, 2003, 3(1): 103-104.
[8] 杨万毅, 陈绪元. 胸腺五肽配合化疗治疗中晚期肺癌患者的免疫状况观察 [J]. 重庆医学, 2010, 39(15): 2054-2056.
[9] 陈艳, 常建英, 付和谊, 等. 胸腺五肽预防晚期肺癌机会性真菌与寄生虫感染的研究 [J]. 中国人兽共患病杂志, 2005, 21(4): 309-311.
[10] 王云侠, 郑淑梅, 李枉, 等. 三维适形放疗联合胸腺五肽治疗老年晚期非小细胞肺癌 [J]. 药物流行病学杂志, 2006, 15(5): 263-265.
[11] 涂德军, 张启龙, 洪俊强, 等. 胸腺五肽辅助化疗对中晚期肺癌患者的 T 淋巴细胞亚群及生活质量影响的临床研究 [J]. 中国医药指南, 2012, 10(32): 192-194.
[12] 刘鹏辉, 廖国清, 王红梅. 胸腺五肽对晚期非小细胞肺癌化学治疗后免疫功能的影响 [J]. 新乡医学院学报, 2008, 125(3): 289-291.
[13] 林芳. 胸腺五肽辅助非小细胞肺癌化疗的疗效分析 [J]. 重庆医学, 2009, 38(16): 2060-2062.
[14] 李玉平, 张晓庆, 胡苹, 等. 胸腺五肽联合 TP 方案治疗晚期非小细胞肺癌的成本_效果分析 [J]. 中国药房, 2013, 24(4): 329-332.
[15] 贾果珍. 中晚期肺癌化疗联合使用胸腺五肽临床观察 [J]. 中国药物与临床, 2014, 14(8): 1103-1104.
[16] Baecher-Allan C, Viglietta V, Hafler DA. Human CD4+CD25+regulatory T cells [J]. Semin Immunol, 2004, 16(1): 89-97.
Evaluation of Thymopentin in Adjuvant Therapy for Patients with Lung Cancer: a Meta-analysis of Randomized Trials
LI Yisi1,2AO Shuting2JIN Yan1
1(Shenzhen Institutes of Advanced Technology,Chinese Academy of Sciences,Shenzhen518055,China)
2(College of Pharmacy,Jinan University,Guangzhou510632,China)
To evaluate the effect of thymopentin (TP5) on immune function and curative effect in adjuvant therapy for patients with lung cancer, we searched online for randomized, placebo-controlled trials that using TP5 as an adjuvant therapy with chemotherapy or radiotherapy for patients with lung cancer, and then evaluated the trials that meet criteria with the software RevMan5.3. As a result, 9 trials were included and 784 patients were observed. The meta-analysis shows that there is no significant change between the experimental group and the control group in terms of the curative effect of lung cancer (OR=1.44, 95%CI(0.99, 2.10),P=0.06>0.05). As to the effect of immune function, TP5 altered the CD3+cell level (OR=5.88, 95% CI(2.34, 9.42),P=0.001, CD4+cell level(OR=8.32, 95%CI(5.22, 11.42),P<0.00001), but did not alter the CD8+cell level (OR=-3.12, 95% CI(-9.02, 2.79),P>0.05)which led to a significant change of theCD4+/CD8+ratio(OR=0.38, 95% CI(0.18, 0.59),P=0.0002). To sum up, TP5 altered the CD3+cell level, CD4+cell level and CD4+/CD8+ratio but did not alter the CD3+cell level and curative effect.
TP5; lung cancer; immune function; curative effect; systematic
R 979.5
A
2015-03-03
:2015-04-21
深圳市科技创新委员会项目(JCYJ20130402113127506,JCYJ20120617115622211);深圳市海外高层次人才创新创业团队(孔雀团队) (1110140040347265)
李怡斯,本科生,研究方向为药学;敖舒婷,本科生,研究方向为药学;金言(通讯作者),博士,副研究员,硕士生导师,研究方向为分子免疫和肿瘤免疫治疗,E-mail:yan.jin@siat.ac.cn。

